Селеноводород
| Селеноводород | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
селеноводород | ||
| Традиционные названия | селенистый водород, селенид водорода, гидрид селена | ||
| Хим. формула | H2Se | ||
| Рац. формула | H2Se | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 80,9758 г/моль | ||
| Плотность | 3,310 г/л | ||
| Энергия ионизации | 9,88 эВ[1][2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −65,73 °C | ||
| • кипения | −41,25 °C | ||
| Давление пара | 962 587,5 Па[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,89 | ||
| Растворимость | |||
| • в воде | 0,70 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 7783-07-5 | ||
| PubChem | 533 | ||
| Рег. номер EINECS | 231-978-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | X1050000 | ||
| ChEBI | 16503 | ||
| ChemSpider | 518 | ||
| Безопасность | |||
| Токсичность | чрезвычайно токсичен для человека | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Селеноводоро́д (села́н, селени́д водоро́да, химическая формула — H2Se) — неорганическое бинарное соединение водорода и селена.
При стандартных условиях, селеноводород — это бесцветный тяжёлый газ. Горюч, очень ядовит, имеет резкий отвратительный запах. Самое токсичное соединение селена с опасным периодом воздействия 0,3 ppm в вдыхаемом воздухе за 8 часов.
Структура[править | править код]
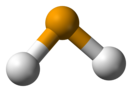
Молекула селеноводорода имеет «изогнутую» структуру H—Se—H с валентным углом 91°. Наблюдается три колебательные полосы в инфракрасном спектре: 2358, 2345 и 1034 см−1.
Физические свойства[править | править код]
При нормальных условиях селеноводород является тяжёлым бесцветным газом; плотность 3,310 кг/м3, почти втрое тяжелее воздуха. При повышении давления до 9,5 ± 0,1 атм сжижается при комнатной температуре. При нормальном давлении температура кипения равна −41,25 °C, температура плавления −65,73 °C.
Химические свойства[править | править код]
Химические свойства селеноводорода схожи со свойствами сероводорода, хотя H2Se обладает большей кислотностью (pKa = 3,89 при 25 °C), чем H2S (pKa = 11,0 при 25 °C). Имея более высокую кислотность, селеноводород лучше растворим в воде. Поскольку селеноводородная кислота (раствор селеноводорода в воде) является двухосновной кислотой, она обладает второй константой кислотности, соответствующей полной диссоциации; она равна pKa2 = 15,05 ± 0,02 при 25 °C[3]. Селеноводородная кислота образует с металлами соли — селениды, например селенид натрия Na2Se.
При горении селеноводорода в воздухе или кислороде образуется диоксид селена и вода:
При недостатке кислорода и пониженной температуре окисляется до элементарного селена[4]:
Получение[править | править код]
Для получения селеноводорода могут использоваться реакции взаимодействия селенидов активных металлов с водой или разбавленными кислотами, например гидролиз селенида алюминия Al2Se3, сопровождающийся образованием гидроксида алюминия:
Селеноводород образуется также в результате взаимодействия с кислотой селенида железа(II) FeSe:
Также может быть получен прямым синтезом их элементов при нагреве свыше 400 °С[5]:
Применение[править | править код]
H2Se используется в органическом синтезе для получения селеноуратов из нитрилов в реакциях присоединения по тройной углеродной связи[6]:
Также H2Se применяется в полупроводниковой промышленности для газофазного легирования полупроводников типа III—V (например, арсенида галлия) с целью придания им электронного типа проводимости.
Токсичность[править | править код]
Селеноводород чрезвычайно ядовит и считается наиболее ядовитым соединением селена[7] и намного более токсичен, чем сероводород. Однако он имеет настолько отвратительный запах, что случайно отравиться человеку им невозможно: порог ощущения запаха в воздухе 0,05 объёмных частей на миллион (ppm). При концентрации 0,3 ppm газ начинает раздражающе действовать на органы дыхания, а свыше концентрации 1,5 ppm запах становится совершенно невыносимым. Несмотря на очень высокую токсичность, смертельные случаи отравления им неизвестны.
Воздействие более высоких концентраций менее чем за минуту вызывает поражение органов дыхания с симптомами, сходными с симптомами простуды, продолжающимися несколько дней после однократного воздействия.
Предельно допустимая концентрация селеноводорода в воздухе производственных помещений 0,2 мг/м³[8][9]. Объёмная концентрация 1 ppm в воздухе соответствует массовой концентрации 3,31 мг/м³.
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0336.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Levy D. E., Myers R. J. Spectroscopic Determination of the Second Dissociation Constant of H2Se and the Activity Coefficients and Spectral Shifts of Its Ions (англ.) // J. Phys. Chem.. — 1990. — Vol. 94, iss. 20. — P. 7842—7847. — doi:10.1021/j100383a020. Архивировано 12 декабря 2021 года.
- ↑ LA CHIMICA DEL SELENIO. Дата обращения: 24 марта 2013. Архивировано из оригинала 4 апреля 2013 года.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., Band 1, Academic Press 1963, S. 418—419.
- ↑ Cohen V.I. A Convenient Synthesis of Mono-, N,N′-Di-, and Trisubstituted Selenoureas from Methyl Carbamimidothioates (S-Methylpseudothioureas) // Synthesis. — 1980. — Т. 60, вып. 3..
- ↑ US Environmental Protection Agency, Air Toxins website
- ↑ Гигиенические требования к копировально-множительному оборудованию и организации работ. Временные санитарные правила. 1997 г. Дата обращения: 20 октября 2018. Архивировано 9 ноября 2018 года.
- ↑ The National Institute for Occupational Safety and Health (NIOSH) / Hydrogen selenide. Дата обращения: 20 октября 2018. Архивировано 20 октября 2018 года.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |