Цитохром-bc1-комплекс
| Убихинол-цитохром с-оксидоредуктаза | |
|---|---|
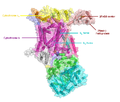
![Структура митохондриальной убихинол-цитохром с-оксидоредуктазы в комплексе с убихиноном[1].](http://upload.wikimedia.org/wikipedia/commons/thumb/7/70/Cytochrome1ntz.PNG/250px-Cytochrome1ntz.PNG) Структура митохондриальной убихинол-цитохром с-оксидоредуктазы в комплексе с убихиноном[1]. | |
| Идентификаторы | |
| Шифр КФ | 7.1.1.8 |
| Номер CAS | 9027-03-6 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9027-03-6 |
| UCR_TM | |
|---|---|
 | |
| Идентификаторы | |
| Символ | UCR_TM |
| Pfam | PF02921 |
| InterPro | IPR004192 |
| SCOP | 1be3 |
| SUPERFAMILY | 1be3 |
| TCDB | 3.D.3 |
| OPM superfamily | 345 |
| OPM protein | 3cx5 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Цитохро́м-bс1-ко́мплекс (комплекс цитохромов bc1) или убихинол-цитохром с-оксидоредуктаза, или комплекс III — мультибелковый комплекс дыхательной цепи переноса электронов и важнейший биохимический генератор протонного градиента на мембране митохондрий. Этот мультибелковый трансмембранный комплекс кодируется митохондриальным (цитохром b) и ядерным геномами[2].
Комплекс III был выделен из митохондрий сердца быка, цыпленка, кролика и митохондрий дрожжей. Он присутствует в митохондриях всех животных, растений и всех аэробных эукариот, а также на внутренней мембранах большинства эубактерий. Известно, что комплекс образует в целом 13 белковых петель, пересекающих мембрану[2].
Структурная организация комплекса III[править | править код]
В состав комплекса из митохондрий сердца быка (мол. масса ~ 248 кДа) входит порядка 11 белковых субъединиц, 8 из которых представляют собой мелкие гидрофобные мембранные белки с неизвестной (возможно, структурной) функцией. Бактериальные цитохромные комплексы могут содержать всего от 6 до 8 или даже 3 субъединицы[3]. Три главные субъединицы несут простетические группы. Цитохром b, в составе которого есть два гема b-типа с разными редокс-потенциалами: гем bL низким (Е°’~ —0,075…0,00 В) и гем bH с высоким (Е°' ~ — +0,05 В) потенциалом. Цитохром с1 несёт простетическую группу, гем типа-с (Е°' -+0,23…+0,25 В). Железосерный белок Риске имеет в своём составе 2Fe-2S-центр (Е°' ~ +0,28 В). Известно, что in vivo комплекс функционирует как димер[2].
Комплекс погружён во внутреннюю митохондриальную мембрану таким образом, что функциональная группа белка Риске и цитохрома с выходят в межмембранное пространство, тогда как два гема цитохрома b находятся в толще мембраны, причём bp приближен к её внутренней стороне, а bn — к наружной. Такое асимметричное расположение редокс-центров в мембране обеспечивает существование двух пространственно разделённых цепей транспорта электронов внутри одного комплекса. Первая, низкопотенциальная цепь транспорта электронов формируется за счёт двух гемов цитохрома b6 — низкопотенциального bL и высокопотенциального bH. Вторая, высокопотенциальная цепь включает белок Риске и гем цитохрома c. При окислении убиохинолов в цитохромном комплексе реализуется два сопряжённых потока электронов — по низкопотенциальному и высокопотенциальному пути[4].
Данные рентгеноструктурного анализа, позволяющие определить положение активных групп относительно друг друга, а также эксперименты с ингибиторами дали возможность понять, что электронный транспорт возможен не только между двумя гемами одного комплекса, но и между двумя гемами bL, расположенными на разных комплексах, ассоциированных в димер[5].
Субъединицы[править | править код]
У позвоночных bc1-комплекс, или Комплекс III, состоит из 11 субъединиц: 3 каталитических субъединиц, 2 коровые субъединицы и 6 низкомолекулярных субъединиц[6][7]. Протеобактериальные комплексы могут состоять всего из трёх субъединиц[8].
У растений Комплекс III бифункционален. Недавние исследования на митохондриях пшеницы (Triticum aestivum), картофеля (Solanum tuberosum) и шпината (Spinacia oleracea) показали, что две коровые субъединицы комплекса, обращенные в матрикс, обладают MPP (англ. Mitochondrial Processing Peptidase) — пептидазной активностью и принимает участие в транспорте белков в митохондрии[9][10].
MPP-пептидаза — это гетеродимер, который состоит из субъединиц α-MPP и β-MPP, каждая весом 50 кДа. Она отрезает у поступающих в митохондрию белков N-концевую сигнальную или транзитную последовательность из 40-80 аминокислот. В растениях MPP-пептидаза входит в состав цитохром-bc1-комплекса, что считается архаичным признаком. У животных произошла дупликация генов коровых субъединиц, так что MPP-пептидаза у них присутствует как независимый водорастворимый белок матрикса. Коровые субъединицы цитохром-bc1-комплекса тем не менее не утратили пептидазой активности, однако в составе bc1-комплекса она блокируется 9-й субъединицей, которая образуется в результате процессинга белка Риске. Тем не менее опыты с бычьим цитохром-bc1-комплексом показали, что при воздействии детергентов и диссоциации 9-й субъединицы коровые субъединицы вновь приобретают пептидазную активность[11].
Таблица субъединиц Комплекса III[править | править код]
| №. | Субъединица | Белок человека | Описание | Семейство белков Pfam |
|---|---|---|---|---|
| Каталитические субъединицы | ||||
| 1 | MT-CYB / Cyt b | CYB_HUMAN | Цитохром b | Pfam PF13631 |
| 2 | CYC1 / Cyt c1 | CY1_HUMAN | Цитохром c1 | Pfam PF02167 |
| 3 | Rieske / UCR1 | UCRI_HUMAN | Белок Риске | Pfam PF02921 , Pfam PF00355 |
| Коровые субъединицы | ||||
| 4 | QCR1 / SU1 | QCR1_HUMAN | Субъединица 1 (MPP-пептидаза) |
Pfam PF00675, Pfam PF05193 |
| 5 | QCR2 / SU2 | QCR2_HUMAN | Субъединица 2 (MPP-пептидаза) |
Pfam PF00675, Pfam PF05193 |
| Низкомолекулярные субъединицы | ||||
| 6 | QCR6 / SU6 | QCR6_HUMAN | Субъединица 6 | Pfam PF02320 |
| 7 | QCR7 / SU7 | QCR7_HUMAN | Субъединица 7 (связывает убихинон) |
Pfam PF02271 |
| 8 | QCR8 / SU8 | QCR8_HUMAN | Субъединица 8 | Pfam PF02939 |
| 9 | QCR9 / SU9 / UCRC | QCR9_HUMANa | Субъединица 9 | Pfam PF09165 |
| 10 | QCR10 / SU10 | QCR10_HUMAN | Субъединица 10 | Pfam PF05365 |
| 11 | QCR11 / SU11 | QCR11_HUMAN | Субъединица 11 | Pfam PF08997 |
- a У позвоночных сигнальный N-концевой пептид белка Риске массой 8 кДа сохраняется в комплексе как субъединица 9. Субъединицы 10 и 11 у человека соответствуют QCR9p и QCR10p у грибов.
TTC19 — недавно открытая малая субъединица комплекса; мутации в ней приводят к недостаточности комплекса III 2-го типа.
Реакция[править | править код]
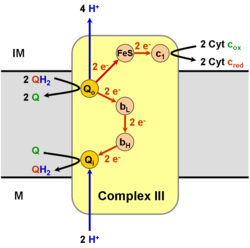
Цитохром-bс1-комплекс окисляет восстановленный убихинон (убихинол) и восстанавливает цитохром c (Е°'=+0,25 В) согласно уравнению:
QH2 + 2 цит. с+3 + 2Н+in →Q + 2 цит. с+2 + 4H+out
При этом имеет место: (1) перенос двух электронов с убихинола на цитохром c, (2) перенос двух протонов из матрикса (in) в межмембранное пространство (out), (3) перенос еще двух протонов из убихинола в межмембранное пространство. В результате, на внутренней мембране митохондрии или бактерии генерируется протонный градиент, а восстановленный цитохром c движется вдоль мембраны в водной фракции и переносит один электрон к следующему дыхательному комплексу — цитохромоксидазе[12][13].
Q-цикл[править | править код]
События, которые при этом происходят, известны как Q-цикл, который был постулирован Питером Митчеллом в 1976 году. Принцип Q-цикла состоит в том, что перенос Н+ через мембрану происходит в результате окисления и восстановления хинонов на самом комплексе. При этом хиноны соответственно отдают и забирают 2Н+ из водной фазы избирательно с разных сторон мембраны.
В структуре комплекса III есть два центра, или два «кармана», в которых могут связываться хиноны. Один из них, Qout-центр, расположен между железосерным кластером 2Fe-2S и гемом bL вблизи внешней (out) стороны мембраны, обращённой в межмембранное пространство. В этом кармане связывается восстановленный убихинон (QH2). Другой, Qin-карман, предназначен для связывания окисленного убихинона (Q) и расположен вблизи внутренней (in) стороны мембраны, контактирующей с матриксом.
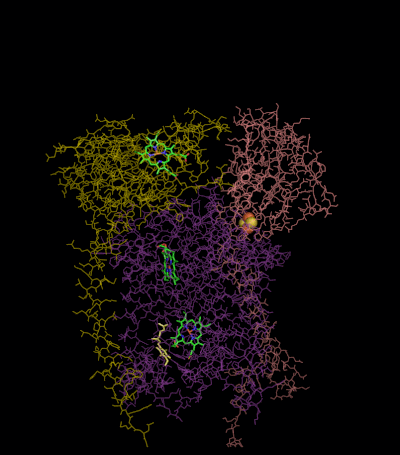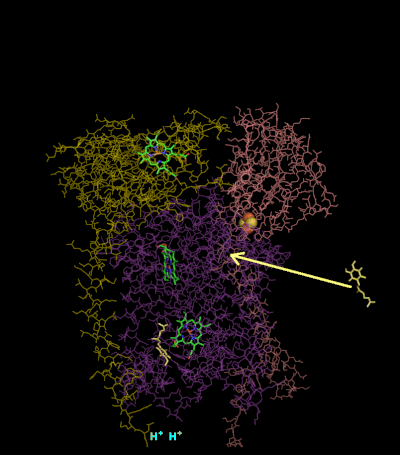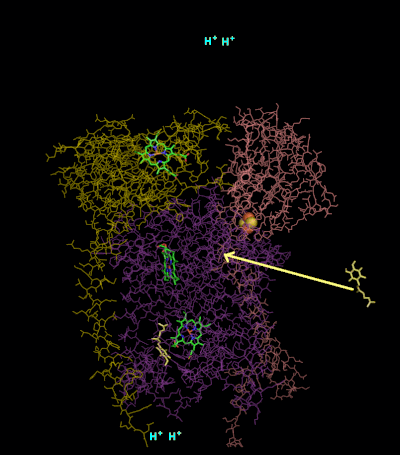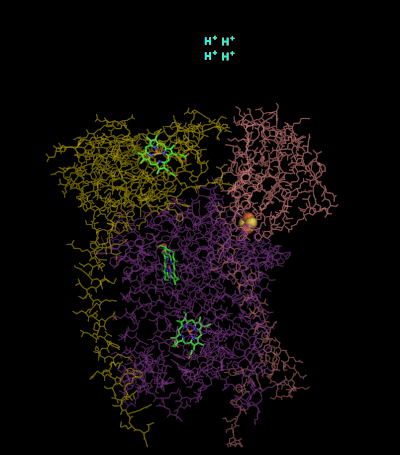
Первая часть Q-цикла
- QH2 связывается в Qout-сайте, окисляется до семихинона (Q•) железосерным центром белка Риске и отдаёт два протона в люмен.
- Восстановленный железосерный центр передаёт один электрон на пластоцианин через цитохром c.
- Q связывается в Qin-сайте.
- Q• передаёт электроны к гему bL цитохрома b по низкопотенциальной ЭТЦ.
- Гем bL передаёт электрон на bH.
- Гем bH восстанавливает Q до состояния Q•.
Вторая часть Q-цикла
- Второй QH2 связывается с Qout-сайтом комплекса.
- Пойдя по высокопотенциальной ЭТЦ, один электрон восстанавливает ещё один пластоцианин. Ещё два протона поступают в люмен.
- По низкопотенциальной ЭТЦ электрон от bH передаётся на Q•, и полностью восстановленный Q2− связывает два протона их стромы, превращаясь в QH2.
- Окисленный Q и восстановленный QH2 диффундируют в мембрану[14].
Необходимым и парадоксальным условием работы Q-цикла является тот факт, что время жизни и состояние семихинонов в двух центрах связывания разное. В Qout-центре Q• нестабилен и действует как сильный восстановитель, способный отдать е- на низкопотенциальный гем by. В Qin-центре образуется относительно долгоживущий Q•−, потенциал которого позволяет ему действовать в качестве окислителя, принимая электроны с гема bH. Ещё один ключевой момент Q-цикла связан с расхождением двух электронов, входящих в комплекс, по двум разным путям. Изучение кристаллической структуры комплекса показало, что позиция 2Fe-2S-центра относительно других редокс-центров может смещаться. Оказалось, что белок Риске имеет подвижный домен, на котором собственно и расположен 2Fe-2S-кластер. Принимая электрон и восстанавливаясь, 2Fe-2S-центр меняет своё положение, отдаляясь от Qout-центра и гем bL на 17 Å с поворотом на 60° и тем самым приближаясь к цитохрому c. Отдав электрон цитохрому, 2Fe-2S-центр, наоборот, сближается с Qout-центром для установления более тесного контакта. Таким образом, функционирует своеобразный челнок (шаттл), гарантирующий уход второго электрона на гемы bL и bH. Пока это единственный пример, когда электронный транспорт в комплексах связан с подвижным доменом в структуре белка[15].
Активные формы кислорода[править | править код]
Небольшая часть электронов покидает цепь переноса до того как достигнет Комплекса IV. Постоянные утечки электронов на кислород приводят к образованию супероксида. Эта небольшая побочная реакция приводит к образованию целого спектра активных форм кислорода, которые весьма токсичны и играют значительную роль в развитии патологий и старении (см. свободнорадикальная теория старения)[16]. Электронные протечки в основном происходят в Qin-сайте. Этому процессу способствует антимицин A. Он блокирует гемы b в их восстановленном состоянии не давая им сбросить электроны на семихинон Q•, что в свою очередь приводит к повышению его концентрации. Семихинон реагирует к кислородом, что и приводит к образованию супероксида. Образовавшийся супероксид поступает в митохондриальный матрикс[17][18] и межмембранное пространство, откуда он может попасть в цитозоль[17][19]. Этот факт можно объяснить тем, что Комплекс III, возможно, производит супероксид в форме незаряженного HOO•, которому легче проникнуть сквозь внешнюю мембрану по сравнению с заряженным O2•-[18].
Ингибиторы Комплекса III[править | править код]
Все ингибиторы Комплекса III можно разделить на три группы:
- Антимицин A связывается с Qin-сайтом и блокирует транспорт электронов от гема bH к окисленному убихинону Q (ингибитор Qin-сайта).
- Миксотиазол и стигмателлин связываются с Quot-сайтом и блокируют перенос электрона с восстановленного QH2 на железосерный кластер белка Риске. Оба ингибитора связываются с Quot-сайтом, но в разных, хотя и перекрывающихся, местах.
- Миксотиазол связывается ближе к гему bL и потому именуется «проксимальным» ингибитором.
- Стигмателлин связывается дальше от гема bL и ближе к белку Риске, с которым он взаимодействует.
Некоторые из этих веществ используются как фунгициды (например, производные стробилурина, наиболее известным из которых является азоксистробин, ингибитор сайта Qout) и противомалярийные препараты (атовакуон)[20].
Мутации в генах Комплекса III и связанные с ними заболевания[править | править код]
Мутации в генах Комплекса III обычно приводят к непереносимости физических упражнений[21][22]. Другие мутации могут вызывать септо-оптическую дисплазию[23] и мультисистемные расстройства[24]. Мутации в гене BCS1L, ответственном за правильное созревание Комплекса III, может привести к синдрому Бьёрнстада и синдрому GRACILE, который приводит к смерти в раннем возрасте. Фенотип многих из этих, а также других мутаций удалось оценить на таких системах как дрожжи[25].
В какой степени эти патологии вызваны биоэнергетической недостаточностью, а в какой избыточным образованием активных форм кислорода, на данный момент неизвестно.
Галерея[править | править код]
-
Цит. bc1 в мембране.
-
Цит. bc1 домашней курицы.
-
Бычий цит. bc1.
-
Цит. bc1 и цит. с из S. cerevisiae.
-
Белок Риске из M. laminosus.
-
Положение двух белков Риске в Цит. b6f.
-
Мономер цит. bc1, указаны субъединицы.
См. также[править | править код]
- НАДН-дегидрогеназный комплекс
- Сукцинатдегидрогеназа
- Цитохромоксидаза
- ETF-дегидрогеназа
- Респирасомы
- Альтернативная оксидаза
Примечания[править | править код]
- ↑ PDB 1ntz; Gao X., Wen X., Esser L., Quinn B., Yu L., Yu C.A., Xia D. Structural basis for the quinone reduction in the bc1 complex: a comparative analysis of crystal structures of mitochondrial cytochrome bc1 with bound substrate and inhibitors at the Qi site (англ.) // Biochemistry : journal. — 2003. — August (vol. 42, no. 30). — P. 9067—9080. — doi:10.1021/bi0341814. — PMID 12885240.
- ↑ 1 2 3 Ермаков, 2005, с. 240.
- ↑ Iwata S., Lee J.W., Okada K., Lee J.K., Iwata M., Rasmussen B., Link T.A., Ramaswamy S., Jap B.K. Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex (англ.) // Science : journal. — 1998. — July (vol. 281, no. 5373). — P. 64—71. — doi:10.1126/science.281.5373.64. — PMID 9651245.
- ↑ Ермаков, 2005, с. 177.
- ↑ Raul Covian, Bernard L. Trumpower. Regulatory interactions in the dimeric cytochrome bc1 complex: The advantages of being a twin (англ.) // Biochimica et Biophysica Acta[англ.] : journal. — 2008. — Vol. 1777. — P. 1079—1109. Архивировано 1 января 2016 года.
- ↑ Zhang Z., Huang L., Shulmeister V.M., Chi Y.I., Kim K.K., Hung L.W. et al. Electron transfer by domain movement in cytochrome bc1 (англ.) // Nature : journal. — 1998. — Vol. 392, no. 6677. — P. 677—684. — doi:10.1038/33612. — PMID 9565029.
- ↑ Hao G.F., Wang F., Li H., Zhu X.L., Yang W.C., Huang L.S. et al. Computational discovery of picomolar Q(o) site inhibitors of cytochrome bc1 complex (англ.) // J Am Chem Soc[англ.] : journal. — 2012. — Vol. 134, no. 27. — P. 11168—11176. — doi:10.1021/ja3001908. — PMID 22690928.
- ↑ Yang X.H., Trumpower BL. Purification of a three-subunit ubiquinol-cytochrome c oxidoreductase complex from Paracoccus denitrificans (англ.) // J Biol Chem. : journal. — 1986. — Vol. 261. — P. 12282—12289. — PMID 3017970.
- ↑ Jan Mach, Pavel Poliak, Anna Matušková, Vojtěch Žárský, Jiří Janata, Julius Lukeš, and Jan Tachezy,. An Advanced System of the Mitochondrial Processing Peptidase and Core Protein Family in Trypanosoma brucei and Multiple Origins of the Core I Subunit in Eukaryotes (англ.) // Genome Biol Evol[англ.] : journal. — April 5, 2013.. — Vol. 5, no. 5. — P. 860—875. — doi:10.1093/gbe/evt056. Архивировано 22 ноября 2015 года.
- ↑ Braun H.P., Emmermann M., Kruft V., Bödicker M., Schmitz UK. The general mitochondrial processing peptidase from wheat is integrated into the cytochrome bc1-complex of the respiratory chain (англ.) // Planta. : journal. — 1995. — Vol. 195, no. 3. — P. 396—402. — PMID 7766045.
- ↑ Kaiping Deng‡, Sudha K. Shenoy‡, Shih-Chia Tso, Linda Yu and Chang-An Yu§. Reconstitution of Mitochondrial Processing Peptidase from the Core Proteins (Subunits I and II) of Bovine Heart Mitochondrial Cytochrome bc1 Complex (англ.) // The Journal of Biological Chemistry : journal. — March 2, 2001. — Vol. 276. — P. 6499—6505.. — doi:10.1074/jbc.M007128200.
- ↑ Kramer D.M., Roberts A.G., Muller F., Cape J., Bowman M.K. Q-cycle bypass reactions at the Qo site of the cytochrome bc1 (and related) complexes (англ.) // Meth. Enzymol. : journal. — 2004. — Vol. Methods in Enzymology. — P. 21—45. — ISBN 978-0-12-182786-1. — doi:10.1016/S0076-6879(04)82002-0. — PMID 15047094.
- ↑ Crofts A.R. The cytochrome bc1 complex: function in the context of structure (англ.) // Annu. Rev. Physiol. : journal. — 2004. — Vol. 66. — P. 689—733. — doi:10.1146/annurev.physiol.66.032102.150251. — PMID 14977419.
- ↑ Ferguson S. J., Nicholls D., Ferguson S. Bioenergetics (неопр.). — 3rd. — San Diego: Academic, 2002. — С. 114—117. — ISBN 0-12-518121-3.
- ↑ Ермаков, 2005, с. 243.
- ↑ Muller, F. L., Lustgarten, M. S., Jang, Y., Richardson, A. and Van Remmen, H. Trends in oxidative aging theories (англ.) // Free Radic. Biol. Med.[англ.] : journal. — 2007. — Vol. 43, no. 4. — P. 477—503. — doi:10.1016/j.freeradbiomed.2007.03.034. — PMID 17640558.
- ↑ 1 2 Muller F. The nature and mechanism of superoxide production by the electron transport chain: Its relevance to aging (англ.) // AGE : journal. — 2000. — Vol. 23, no. 4. — P. 227—253. — doi:10.1007/s11357-000-0022-9.
- ↑ 1 2 Muller F.L., Liu Y., Van Remmen H. Complex III releases superoxide to both sides of the inner mitochondrial membrane (англ.) // J. Biol. Chem. : journal. — 2004. — November (vol. 279, no. 47). — P. 49064—49073. — doi:10.1074/jbc.M407715200. — PMID 15317809.
- ↑ Han D., Williams E., Cadenas E. Mitochondrial respiratory chain-dependent generation of superoxide anion and its release into the intermembrane space (англ.) // Biochem. J.[англ.] : journal. — 2001. — January (vol. 353, no. Pt 2). — P. 411—416. — doi:10.1042/0264-6021:3530411. — PMID 11139407. — PMC 1221585.
- ↑ Holmes J. H., Sapeika N., Zwarenstein H. Inhibitory effect of anti-obesity drugs on NADH dehydrogenase of mouse heart homogenates (англ.) // Research communications in chemical pathology and pharmacology : journal. — 1975. — Vol. 11, no. 4. — P. 645—646. — PMID 241101.
- ↑ DiMauro S. Mitochondrial myopathies (неопр.) // Curr Opin Rheumatol. — 2006. — November (т. 18, № 6). — С. 636—641. — doi:10.1097/01.bor.0000245729.17759.f2. — PMID 17053512.
- ↑ DiMauro S. Mitochondrial DNA medicine (неопр.) // Biosci. Rep.. — 2007. — June (т. 27, № 1—3). — С. 5—9. — doi:10.1007/s10540-007-9032-5. — PMID 17484047.
- ↑ Schuelke M., Krude H., Finckh B., Mayatepek E., Janssen A., Schmelz M., Trefz F., Trijbels F., Smeitink J. Septo-optic dysplasia associated with a new mitochondrial cytochrome b mutation (англ.) // Ann. Neurol.[англ.] : journal. — 2002. — March (vol. 51, no. 3). — P. 388—392. — doi:10.1002/ana.10151. — PMID 11891837.
- ↑ Wibrand F., Ravn K., Schwartz M., Rosenberg T., Horn N., Vissing J. Multisystem disorder associated with a missense mutation in the mitochondrial cytochrome b gene (англ.) // Ann. Neurol.[англ.] : journal. — 2001. — October (vol. 50, no. 4). — P. 540—543. — doi:10.1002/ana.1224. — PMID 11601507.
- ↑ Fisher N., Castleden C.K., Bourges I., Brasseur G., Dujardin G., Meunier B. Human disease-related mutations in cytochrome b studied in yeast (англ.) // J. Biol. Chem. : journal. — 2004. — March (vol. 279, no. 13). — P. 12951—12958. — doi:10.1074/jbc.M313866200. — PMID 14718526.
Литература[править | править код]
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
Ссылки[править | править код]
- cytochrome bc1 complex site (Antony R. Crofts) at uiuc.edu
- UMich Orientation of Proteins in Membranes families/superfamily-3 — Calculated positions of bc1 and related complexes in membranes
- MeSH Coenzyme+Q-Cytochrome-c+Reductase