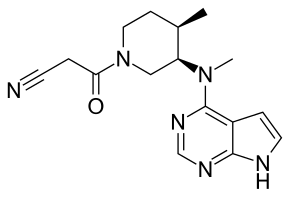
Тофацитиниб
Стиль этой статьи неэнциклопедичен или нарушает нормы литературного русского языка. |
| Тофацитиниб | |
|---|---|
 | |
| Химическое соединение | |
| Брутто-формула | C16H20N6O |
| CAS | 477600-75-2 |
| PubChem | 9926791 |
| DrugBank | DB08895 |
| Состав | |
| Классификация | |
| АТХ | L04AA29 |
| Другие названия | |
| Яквинус, Тофара | |
Тофацитиниб, продаваемый, среди прочего, под торговой маркой Xeljanz, представляет собой лекарство, используемое для лечения ревматоидного артрита, псориатического артрита и язвенного колита[1][2][3][4].
Общие побочные эффекты включают диарею, головную боль и высокое кровяное давление[3]. Серьезные побочные эффекты могут включать инфекции, рак и тромбоэмболию легочной артерии[3][5]. В 2019 году комитет по безопасности Европейского агентства по лекарственным средствам начал обзор тофацитиниба и рекомендовал врачам временно не назначать дозу 10 мг два раза в день людям с высоким риском тромбоэмболии лёгочной артерии[6]. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) также выпустило предупреждения о риске образования тромбов[7][8][9].
Он относится к классу ингибиторов янус-киназы (JAK)[1][2], который был открыт и разработан Национальными институтами здравоохранения и Pfizer.
Применение в медицине
[править | править код]Ревматоидный артрит
[править | править код]Цитрат тофацитиниба одобрен для медицинского применения в США с показанием «для лечения взрослых с умеренно или сильно активным ревматоидным артритом, у которых наблюдается неадекватный ответ на метотрексат или которые не переносят его»[1][10].
В Европейском союзе в сочетании с метотрексатом цитрат тофацитиниба показан для лечения активного ревматоидного артрита (РА) от умеренной до тяжелой степени у взрослых, которые неадекватно ответили на один или несколько противоревматических препаратов, модифицирующих болезнь, или которые не переносят его[2]. Его можно назначать в качестве монотерапии в случае непереносимости метотрексата или когда лечение метотрексатом нецелесообразно[2].
Вывод о том, что использование тофацитиниба с метотрексатом у людей с ревматоидным артритом, ранее не принимавших метотрексат, ассоциировалось со статистически значимыми и клинически значимыми преимуществами с точки зрения достижения показателей По критериям Американской коллегии ревматологов, ремиссии и анкеты оценки здоровья, означает, что тофацитиниб в сочетании с метотрексатом могут быть разумной альтернативой метотрексату для некоторых людей с активным ревматоидным артритом; однако потенциальные затраты и побочные эффекты тофацитиниба должны быть сопоставлены с этим, а варианты лечения должны быть индивидуализированы для каждого человека. Однако они намного дороже, и в большинстве стран использование тофацитиниба основывается на демонстрации неспособности реагировать на метотрексат и / или другие базовые противоревматические препараты, модифицирующие течение болезни. Мы также обнаружили, что у тех, кто не принимал метотрексат, не было доказательств того, что преимущества биологической монотерапии тофацитиниба лучше, чем метотрексата, что является важным открытием. Этот результат также подтверждает текущую практику использования метотрексата в первую очередь у людей с ревматоидным артритом, которые не привыкли к метотрексату[11].
Из-за ограниченного количества данных прямых сравнительных исследований биопрепаратов у людей с ревматоидным артритом (РА), лечение которых биологическим препаратом не помогло, практикующие врачи сталкиваются с дилеммой в выборе следующего биологического препарата или тофацитиниба. В этом обзоре приводится сводка сравнений биопрепаратов или тофацитиниба в качестве монотерапии с плацебо или в комбинации с метотрексатом (MTX) или модифицирующими болезнь противоревматическими препаратами (DMARD) с MTX / DMARD у людей с РА, у которых лечение биологическим препаратом провалился. Мы обнаружили доказательства среднего или высокого качества, что биологическая монотерапия (по сравнению с плацебо), а также биопрепараты + метотрексат (по сравнению с метотрексатом / DMARD) в целом были эффективны, с неубедительными доказательствами относительно вреда. В частности, результаты были неубедительными для отмены из-за побочных эффектов, серьезных нежелательных явлений и рака при биологической монотерапии по сравнению с плацебо и терапией биологическим + метотрексатом по сравнению с мета-аналитиками / DMARD в стандартных метаанализах и NMA с широкими доверительными интервалами, охватывающими нулевой эффект и потенциально важное увеличение каждого вреда. Это указывает на то, что необходимы дополнительные исследования для более уверенной оценки относительного вреда. В целом наш обзор поддерживает использование второго биологического препарата у людей, ранее безуспешно лечившихся этим биологическим средством. Только одно исследование предоставило данные о тофацитинибе, что ограничивает нашу уверенность в этом выводе[12][13].
Монотерапия тофацитинибом улучшила признаки и симптомы РА (ACR50), физическую функцию и ремиссию заболевания по сравнению с плацебо. Данных о рентгенологическом прогрессировании не было. Мы отметили неубедительные результаты для отмены из-за побочных эффектов, серьезных побочных эффектов и рака при использовании биологической монотерапии по сравнению с плацебо с широкими доверительными интервалами.
Монотерапия тофацитинибом улучшила признаки и симптомы РА (ACR50), физическую функцию и рентгенологическое прогрессирование по сравнению с активным компаратором (метотрексат / другие БМАРП). Достоверных различий в ремиссии РА не выявлено. Мы отметили неубедительные результаты для отмены из-за побочных эффектов, серьезных побочных эффектов и рака при использовании биологической монотерапии по сравнению с активным компаратором с широкими доверительными интервалами.
Мы предоставили как прямое, так и сравнения метаанализом (включая данные косвенного и прямого сравнения) данных для биологической монотерапии или монотерапии тофацитинибом по сравнению с плацебо или с препаратом сравнения (метотрексатом / другими DMARD) у людей с РА, ранее безуспешно получавших метотрексат / другие DMARD. Мы понимаем, что наш метаанализ (NMA) во многом полагается на косвенные доказательства, поскольку прямых сравнительных испытаний немного. Обнаружение большого соответствия между прямыми оценками и оценками NMA, как показано в таблицах Резюме выводов (SOF), подтверждает обоснованность подхода с использованием NMA для выполнения этих анализов и их надежность. Ввиду относительного отсутствия прямых сравнительных испытаний биопрепаратов у людей с РА, пациенты и медицинские работники сталкиваются с дилеммой при выборе биопрепаратов или тофацитиниба для людей, лечение которых традиционным метотрексатом или другими БПВП оказалось неэффективным. Наш NMA теперь предоставляет эти сравнения и оценки для биологических препаратов или монотерапии тофацитинибом у таких людей. Наш NMA также продвигает научно-обоснованную медицину, делая несколько наблюдений, сравнивая биологические монотерапии в различных дозах (стандартные, низкие и высокие) друг с другом, а также с препаратами сравнения, а также сравнивая различные группы препаратов, а именно TNF, не-TNF и тофацитиниб против анакинры. Для лучшего понимания сравнительных преимуществ и вреда биологической монотерапии или тофацитиниба необходимы дополнительные сравнительные данные об эффективности[14][15].
Ввиду очень небольшого количества прямых сравнительных испытаний биопрепаратов на людях с РА, практикующие врачи сталкиваются с дилеммой при выборе биопрепаратов или тофацитиниба для людей, которые прошли безуспешное лечение традиционным метотрексатом или другими БМАРП. В этом обзоре представлено обобщение прямых и NMA сравнений (включая данные косвенного и прямого сравнения) данных, касающихся этих биопрепаратов или тофацитиниба, в сочетании с метотрексатом или DMARD (в категориях биологических препаратов по механизму действия в сводных таблицах результатов; и по отдельности в основном) текст и приложения). Мы понимаем, что NMA, которая включает прямые и косвенные доказательства, во многом полагается на косвенные доказательства (особенно для межбиологических сравнений), поскольку прямых сравнительных испытаний биопрепаратов мало. Однако мы обнаружили большое соответствие между прямыми оценками и оценками NMA, как показано в таблицах SOF, что подтверждает надежность этого анализа. Однако необходимы дополнительные данные, чтобы прояснить сравнительную эффективность биопрепаратов + метотрексат / DMARD по сравнению с метотрексатом / DMARD в отношении вреда, такого как рак и инфекции, а также между категориями биопрепаратов и отдельных биопрепаратов в отношении сравнительной пользы и вреда[16][17].
Язвенный колит
[править | править код]В мае 2018 года FDA одобрило цитрат тофацитиниба «для лечения взрослых пациентов в США с умеренно или сильно активным язвенным колитом»[4]. Цитрат тофацитиниба - первый пероральный ингибитор JAK, одобренный для хронического использования при язвенном колите (ЯК) (тофацитиниб представляет собой небольшую молекулу, а не биологический препарат).
Доказательства с высокой степенью достоверности предполагают, что тофацитиниб превосходит плацебо в индукции клинической и эндоскопической ремиссии на 52 неделе у участников с умеренным и тяжелым ЯК, у которых был клинический ответ после восьми недель индукционного лечения тофацитинибом (10 мг два раза в день) или плацебо. Оптимальная доза тофацитиниба для поддерживающей терапии неизвестна. Доказательства с высокой степенью достоверности свидетельствуют об отсутствии повышенного риска побочных эффектов при приеме тофацитиниба по сравнению с плацебо. Однако мы не уверены в влиянии тофацитиниба на серьезные побочные эффекты из-за небольшого количества событий. Необходимы дальнейшие исследования для изучения долгосрочной эффективности и безопасности использования тофацитиниба и других пероральных ингибиторов JAK в качестве поддерживающей терапии у участников с умеренным и тяжелым ЯК в стадии ремиссии[18].
Побочные эффекты
[править | править код]Изначально тофацитиниб не был одобрен европейскими регулирующими органами из-за опасений по поводу его эффективности и безопасности[19], хотя к 2018 году его одобрила Европейская комиссия[20]. Исследования тофацитиниба на животных, проведенные до испытаний на людях, показали некоторый канцерогенез, мутагенез и ухудшение фертильности[1].
Наиболее частыми побочными реакциями, о которых сообщалось в течение первых трех месяцев контролируемых клинических испытаний (встречающихся у 2% и более пациентов, получавших монотерапию цитратом тофацитиниба или в комбинации с DMARD), были инфекции верхних дыхательных путей, головная боль, диарея и назофарингит ("простуда")[1].
FDA требует, чтобы на этикетке тофацитиниба было предупреждение о возможных травмах и смерти из-за таких проблем, как инфекции, лимфома и другие злокачественные новообразования, которые могут возникнуть в результате использования этого препарата[10]. У пациентов, получающих тофацитиниб, наблюдались серьезные инфекции, приводящие к госпитализации или смерти, включая туберкулез и бактериальные, инвазивные грибковые, вирусные и другие оппортунистические инфекции. Посттрансплантационное лимфопролиферативное расстройство, связанное с вирусом Эпштейна-Барра, чаще наблюдалось у пациентов с трансплантацией почки, получавших тофацитиниб на фоне приема иммуносупрессивных препаратов. Пациентам рекомендуется избегать использования цитрата тофацитиниба во время «активной серьезной инфекции, включая локализованные инфекции». Врачи рекомендуют с осторожностью применять его пациентам, у которых может быть повышенный риск перфорации желудочно-кишечного тракта. Рекомендуется лабораторный мониторинг из-за возможных изменений лимфоцитов, нейтрофилов, гемоглобина, ферментов печени и липидов. Тофацитиниб утверждает, что не имеет противопоказаний, но врачи рекомендуют снизить дозировку пациенту в сочетании с «мощными ингибиторами цитохрома P450 3A4 (CYP3A4)», такими как кетоконазол, или одним или несколькими комбинированными препаратами, которые приводят к умеренному ингибированию CYP3A4 и сильное ингибирование CYP2C19, такого как флуконазол. Кроме того, пользователям тофацитиниба следует избегать иммунизации живыми вакцинами[1].
Согласно постмаркетинговым исследованиям, тофацитиниб также может повышать риск тромбоэмболии легочной артерии. Перед назначением этого лекарства лечащим врачам следует учитывать факторы риска тромбоэмболии легочной артерии, включая возраст, ожирение, курение и иммобилизацию. Пациенты, принимающие это лекарство, независимо от показаний или факторов риска, должны находиться под наблюдением на предмет признаков и симптомов тромбоэмболии легочной артерии[21].
Механизм действия
[править | править код]Он является ингибитором ферментов янус-киназы 1 (JAK1) и янус-киназы 3 (JAK 3), что означает, что он препятствует сигнальному пути JAK-STAT, который передает внеклеточную информацию в ядро клетки, влияя на транскрипцию ДНК[22].
На модели установленного артрита на мышах тофацитиниб быстро лечил заболевание, подавляя продукцию медиаторов воспаления и подавляя STAT1-зависимые гены в суставной ткани. Эта эффективность на этой модели заболевания коррелировала с ингибированием как путей передачи сигналов JAK1, так и JAK3, что позволяет предположить, что тофацитиниб может оказывать терапевтический эффект через пути, которые не ограничиваются только ингибированием JAK3[23].
История
[править | править код]Потенциальное значение ингибирования JAK3 было впервые обнаружено в лаборатории Джона О'Ши, иммунолога из Национального института артрита, скелетно-мышечных и кожных заболеваний Национального института здоровья (NIH)[24]. В 1994 году NIH обратился к Pfizer с предложением о создании государственно-частного партнерства для оценки и вывода на рынок экспериментальных соединений, основанных на этом исследовании[24]. Первоначально компания Pfizer отказалась от партнерства, но согласилась в 1996 году после отмены политики NIH, согласно которой рыночная цена продукта, полученного в результате такого партнерства, должна быть соизмеримой с вложением доходов государственных налогоплательщиков и «потребностями в области здравоохранения и безопасности публики "[24]. Pfizer работал с лабораторией О'Ши над определением структуры и функции JAK3 и его рецепторов, а затем самостоятельно занимался открытием лекарства, доклинической разработкой и клинической разработкой тофацитиниба[25].
Во время разработки препарат был закодирован как CP-690,550[26]. Первоначально рекомендованное МНН (rINN) было тасоцитинибом[27], но оно было отменено в процессе утверждения INN как не оптимально отличимое от других существующих INN, поэтому было предложено название «тофацитиниб», и оно стало INN.
В ноябре 2012 года FDA одобрило тофацитиниб для лечения ревматоидного артрита. Два ревматолога, опрошенные журналом Nature Biotechnology, жаловались, что они были «шокированы» и «разочарованы» оптовой ценой в 2055 долларов в месяц[25].
Исследование 2014 года показало, что лечение тофацитинибом способно превращать белые жировые ткани в более метаболически активный бурый жир, что позволяет предположить, что он может иметь потенциальное применение при лечении ожирения[28].
В ноябре 2012 года FDA одобрило тофацитиниб «для лечения взрослых с умеренно или сильно активным ревматоидным артритом, у которых был неадекватный ответ на метотрексат или у которых была непереносимость[10]. FDA одобрило только дозу 5 мг два раза в день для основание на том, что более высокая доза не считалась адекватным соотношением риска и пользы[29].
Общество и культура
[править | править код]Наименование
[править | править код]Тофацитиниб продается как Xeljanz, за исключением России, где он продается как Jaquinus.
Исследование
[править | править код]В исследованиях III фазы он продемонстрировал эффективность при лечении псориаза. Изучается для лечения воспалительных заболеваний кишечника[30][31] и других иммунологических заболеваний, а также для предотвращения отторжения трансплантата органов[32][33][34][35].
Псориаз
[править | править код]Тофацитиниб - это лекарство, которое в настоящее время исследуется при псориазе. Он продемонстрировал свою эффективность при псориазе бляшек в фазе III рандомизированных контролируемых исследований по сравнению с плацебо и этанерцептом[29][36][37]. В частности, было показано, что доза тофацитиниба в десять мг дважды в день не уступает дозе этанерцепта 50 мг подкожно два раза в неделю[37]. Одобрение тофацитиниба для лечения псориаза было отклонено FDA из соображений безопасности[38].
Очаговая алопеция
[править | править код]Основываясь на доклинических исследованиях на мышиной модели этого заболевания[39], тофацитиниб был исследован для лечения очаговой алопеции. В ранних отчетах[40][41] о случаях предполагалась потенциальная эффективность, как и в открытом клиническом исследовании фазы II[42], опубликованном в тандеме с клиническим испытанием фазы II, показавшим то же самое для руксолитиниба[43].
Витилиго
[править | править код]В отчете о случае в июне 2015 года 53-летняя женщина с витилиго показала заметное улучшение после приема тофацитиниба в течение пяти месяцев[44].
Атопический дерматит
[править | править код]В сентябре 2015 г. были опубликованы результаты применения тофацитиниба у шести пациентов с резистентным атопическим дерматитом. У всех наблюдалось улучшение состояния атопического дерматита без каких-либо побочных эффектов[45].
Анкилозирующий спондилоартрит
[править | править код]По состоянию на 2016 год он проходит фазу II испытаний на лечение анкилозирующего спондилита[1]
Примечания
[править | править код]- ↑ 1 2 3 4 5 6 Xeljanz- tofacitinib tablet, film coated Xeljanz XR- tofacitinib tablet, film coated, extended release Xeljanz- tofacitinib solution. DailyMed (2 октября 2020). Дата обращения: 3 ноября 2020. Архивировано 30 ноября 2020 года.
- ↑ 1 2 3 4 Xeljanz EPAR. Европейское агентство лекарственных средств (EMA). — Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged. Дата обращения: 3 ноября 2020. Архивировано 28 октября 2020 года.
- ↑ 1 2 3 Tofacitinib Citrate. The American Society of Health-System Pharmacists. Дата обращения: 1 июня 2018. Архивировано 9 июля 2018 года.
- ↑ 1 2 "FDA approves new treatment for moderately to severely active ulcerative colitis". U.S. Food and Drug Administration (FDA) (Press release). 2018-05-30. Архивировано 15 декабря 2019. Дата обращения: 1 июня 2018.
{{cite press release}}: Указан более чем один параметр|archiveurl=and|archive-url=(справка) - ↑ Safety Alerts for Human Medical Products - Xeljanz, Xeljanz XR (tofacitinib): Safety Communication - Safety Trial Finds Increased Risk of Blood Clots in the Lungs and Death with Higher Dose in Rheumatoid Arthritis Patients. U.S. Food and Drug Administration (FDA). Дата обращения: 2 марта 2019.
- ↑ Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 13-16 May 2019, May 17, 2019. Европейское агентство лекарственных средств. Дата обращения: 17 мая 2019. Архивировано 17 мая 2019 года.
- ↑ Xeljanz, Xeljanz XR (tofacitinib): Drug Safety Communication - Due to an Increased Risk of Blood Clots and Death with Higher Dose. U.S. Food and Drug Administration (FDA) (26 июля 2019). Дата обращения: 10 августа 2019. Архивировано 15 декабря 2019 года.
- ↑ FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR). U.S. Food and Drug Administration (FDA) (Podcast). 2019-08-05. Архивировано из оригинала 12 декабря 2019. Дата обращения: 15 декабря 2019.
- ↑ FDA approves Boxed Warning about increased risk of blood clots and death with higher dose of arthritis and ulcerative colitis medicine tofacitinib (Xeljanz, Xeljanz XR). U.S. Food and Drug Administration (15 декабря 2019). Дата обращения: 15 декабря 2019. Архивировано 15 декабря 2019 года.
- ↑ 1 2 3 "FDA approves Xeljanz for rheumatoid arthritis". U.S. Food and Drug Administration (FDA) (Press release). 2012-11-06. Архивировано из оригинала 2 апреля 2014. Дата обращения: 1 декабря 2020.
{{cite press release}}: Указан более чем один параметр|archiveurl=and|archive-url=(справка) - ↑ Biologics or tofacitinib for people with rheumatoid arthritis naive to methotrexate: a systematic review and network meta‐analysis. Cochrane Library.
- ↑ Biologics or tofacitinib for people with rheumatoid arthritis unsuccessfully treated with biologics: a systematic review and network meta‐analysis. Cochrane Library.
- ↑ Биологические средства или тофацитиниб у людей с ревматоидном артритом при ранее безуспешном лечении биологическими средствами: систематический обзор и мета‐анализ. Cochrane Library.
- ↑ Biologic or tofacitinib monotherapy for rheumatoid arthritis in people with traditional disease‐modifying anti‐rheumatic drug (DMARD) failure: a Cochrane Systematic Review and network meta‐analysis (NMA). Cochrane Library.
- ↑ Монотерапия биологическими препаратами или тофацитинибом у людей с ревматоидным артритом, не поддающимся лечению болезнь‐модифицирующими антиревматическими средствами (БМАРС): Кокрейновский систематический обзор и сетевой мета‐анализ (СМА). Cochrane Library.
- ↑ Biologics or tofacitinib for rheumatoid arthritis in incomplete responders to methotrexate or other traditional disease‐modifying anti‐rheumatic drugs: a systematic review and network meta‐analysis. Cochrane Library.
- ↑ Биологические препараты или тофацитиниб для лечения ревматоидного артрита у больных, которые частично реагируют на метотрексат или другие традиционные противоревматические препараты: систематический обзор и сетевой мета‐анализ. Cochrane Library.
- ↑ Oral Janus kinase inhibitors for maintenance of remission in ulcerative colitis. Cochrane Library.
- ↑ Nordqvist C (2013-04-27). "Pfizer's Arthritis Drug Xeljanz (tofacitinib) Receives A Negative Opinion In Europe". Medical News Today. Архивировано 17 июля 2013. Дата обращения: 2 августа 2013.
- ↑ McKee, Selina EU approves Pfizer's Xeljanz for psoriatic arthritis (англ.). PharmaTimes (29 июня 2018). Дата обращения: 3 июня 2019. Архивировано 4 декабря 2020 года.
- ↑ FDA Warns of Risk for PE, Death With Higher Dose Tofacitinib (Xeljanz) for RA - Medscape - Feb 25, 2019.
- ↑ "Tofacitinib". Drugs in R&D. 10 (4): 271—84. 2010. doi:10.2165/11588080-000000000-00000. PMC 3585773. PMID 21171673.
- ↑ Ghoreschi K, Jesson MI, Li X, Lee JL, Ghosh S, Alsup JW, et al. (April 2011). "Modulation of innate and adaptive immune responses by tofacitinib (CP-690,550)". Journal of Immunology. 186 (7): 4234—43. doi:10.4049/jimmunol.1003668. PMC 3108067. PMID 21383241.
- ↑ 1 2 3 "Seeking Profit for Taxpayers in Potential of New Drug" Архивная копия от 7 мая 2021 на Wayback Machine, Jonathan Weisman, New York Times, 18 March 2013 (subscription firewall)
- ↑ 1 2 Garber K (January 2013). "Pfizer's first-in-class JAK inhibitor pricey for rheumatoid arthritis market". Nature Biotechnology. 31 (1): 3—4. doi:10.1038/nbt0113-3. PMID 23302910. Архивировано 29 августа 2021. Дата обращения: 1 декабря 2020.
- ↑ Kremer JM, Bloom BJ, Breedveld FC, Coombs JH, Fletcher MP, Gruben D, et al. (July 2009). "The safety and efficacy of a JAK inhibitor in patients with active rheumatoid arthritis: Results of a double-blind, placebo-controlled phase IIa trial of three dosage levels of CP-690,550 versus placebo". Arthritis and Rheumatism. 60 (7): 1895—905. doi:10.1002/art.24567. PMID 19565475.
- ↑ Herper M (2011-03-02). "Why Pfizer's Biggest Experimental Drug Got A Name Change". Forbes. Архивировано 3 марта 2011. Дата обращения: 3 марта 2011.
- ↑ Moisan A, et al. (2014). "White-to-brown metabolic conversion of human adipocytes by JAK inhibition". Nature Cell Biology. 17 (1): 57—67. doi:10.1038/ncb3075. PMC 4276482. PMID 25487280.
- ↑ 1 2 Di Lernia V, Bardazzi F (January 2016). "Profile of tofacitinib citrate and its potential in the treatment of moderate-to-severe chronic plaque psoriasis". Drug Design, Development and Therapy. 10: 533—9. doi:10.2147/DDDT.S82599. PMC 4743637. PMID 26889081.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Vuitton L, Koch S, Peyrin-Biroulet L (November 2013). "Janus kinase inhibition with tofacitinib: changing the face of inflammatory bowel disease treatment". Current Drug Targets. 14 (12): 1385—91. doi:10.2174/13894501113149990160. PMID 23627915.
- ↑ Zand MS (July 2013). "Tofacitinab in renal transplantation". Transplantation Reviews. 27 (3): 85—9. doi:10.1016/j.trre.2013.04.001. PMC 3713609. PMID 23849222.
- ↑ Kirk, Allan D. Textbook of Organ Transplantation Set / Allan D. Kirk, Stuart J. Knechtle, Christian P. Larsen … [и др.]. — John Wiley & Sons, 2014-07-21. — P. 245–. — ISBN 978-1-118-88962-6. Архивная копия от 14 января 2023 на Wayback Machine
- ↑ Wojciechowski D, Vincenti F (September 2013). "Tofacitinib in kidney transplantation". Expert Opinion on Investigational Drugs. 22 (9): 1193—9. doi:10.1517/13543784.2013.811231. PMID 23841583.
- ↑ Myrvang H (June 2012). "Transplantation: Tofacitinib safe and effective in renal transplant recipients". Nature Reviews. Nephrology. 8 (8): 432. doi:10.1038/nrneph.2012.120. PMID 22735765. Архивировано 29 августа 2021. Дата обращения: 1 декабря 2020.
- ↑ Kalluri HV, Hardinger KL (August 2012). "Current state of renal transplant immunosuppression: Present and future". World Journal of Transplantation. 2 (4): 51—68. doi:10.5500/WJT.v2.i4.51. PMC 3782235. PMID 24175197.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Papp KA, Menter MA, Abe M, Elewski B, Feldman SR, Gottlieb AB, et al. (October 2015). "Tofacitinib, an oral Janus kinase inhibitor, for the treatment of chronic plaque psoriasis: results from two randomized, placebo-controlled, phase III trials". The British Journal of Dermatology. 173 (4): 949—61. doi:10.1111/bjd.14018. PMID 26149717.
- ↑ 1 2 Bachelez H, van de Kerkhof PC, Strohal R, Kubanov A, Valenzuela F, Lee JH, et al. (August 2015). "Tofacitinib versus etanercept or placebo in moderate-to-severe chronic plaque psoriasis: a phase 3 randomised non-inferiority trial". Lancet. 386 (9993): 552—61. doi:10.1016/S0140-6736(14)62113-9. PMID 26051365. Архивировано 29 августа 2021. Дата обращения: 1 декабря 2020.
- ↑ "Pfizer Receives Complete Response Letter from FDA for Oral Xeljanz (tofacitinib citrate) Supplemental New Drug Application for Moderate to Severe Chronic Plaque Psoriasis" (Press release). Pfizer. 2015-10-14. Архивировано 1 октября 2020. Дата обращения: 1 декабря 2020.
- ↑ Xing L, Dai Z, Jabbari A, Cerise JE, Higgins CA, Gong W, et al. (September 2014). "Alopecia areata is driven by cytotoxic T lymphocytes and is reversed by JAK inhibition". Nature Medicine. 20 (9): 1043—9. doi:10.1038/nm.3645. PMC 4362521. PMID 25129481.
- ↑ Craiglow BG, King BA (December 2014). "Killing two birds with one stone: oral tofacitinib reverses alopecia universalis in a patient with plaque psoriasis". The Journal of Investigative Dermatology. 134 (12): 2988—2990. doi:10.1038/jid.2014.260. PMID 24940651.
- ↑ Jabbari A, Nguyen N, Cerise JE, Ulerio G, de Jong A, Clynes R, et al. (August 2016). "Treatment of an alopecia areata patient with tofacitinib results in regrowth of hair and changes in serum and skin biomarkers". Experimental Dermatology. 25 (8): 642—3. doi:10.1111/exd.13060. PMC 4963264. PMID 27119625.
- ↑ Kennedy Crispin M, Ko JM, Craiglow BG, Li S, Shankar G, Urban JR, et al. (September 2016). "Safety and efficacy of the JAK inhibitor tofacitinib citrate in patients with alopecia areata". JCI Insight. 1 (15): e89776. doi:10.1172/jci.insight.89776. PMC 5033755. PMID 27699252.
- ↑ Mackay-Wiggan J, Jabbari A, Nguyen N, Cerise JE, Clark C, Ulerio G, et al. (September 2016). "Oral ruxolitinib induces hair regrowth in patients with moderate-to-severe alopecia areata". JCI Insight. 1 (15): e89790. doi:10.1172/jci.insight.89790. PMC 5033756. PMID 27699253.
- ↑ Craiglow BG, King BA (October 2015). "Tofacitinib Citrate for the Treatment of Vitiligo: A Pathogenesis-Directed Therapy". JAMA Dermatology. 151 (10): 1110—2. doi:10.1001/jamadermatol.2015.1520. PMID 26107994.
- ↑ Levy LL, Urban J, King BA (September 2015). "Treatment of recalcitrant atopic dermatitis with the oral Janus kinase inhibitor tofacitinib citrate". Journal of the American Academy of Dermatology. 73 (3): 395—9. doi:10.1016/j.jaad.2015.06.045. PMID 26194706.
Ссылки
[править | править код]- Биологические средства или тофацитиниб у людей с ревматоидном артритом при ранее безуспешном лечении биологическими средствами: систематический обзор и мета‐анализ / Cochrane
- Монотерапия биологическими препаратами или тофацитинибом у людей с ревматоидным артритом, не поддающимся лечению болезнь‐модифицирующими антиревматическими средствами (БМАРС): Кокрейновский систематический обзор и сетевой мета‐анализ (СМА) / Cochrane
- Биологические препараты или тофацитиниб для лечения ревматоидного артрита у больных, которые частично реагируют на метотрексат или другие традиционные противоревматические препараты: систематический обзор и сетевой мета‐анализ / Cochrane
- Tofacitinib. Drug Information Portal. U.S. National Library of Medicine.
- Tofacitinib citrate. Drug Information Portal. U.S. National Library of Medicine.