Аммоний

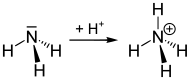
Аммоний — полиатомный катион с химической формулой . Аммоний с анионами образует соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений[1]. Ион аммония NH4+ является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1,43 Å[2].
Существует также короткоживущий свободный радикал аммония с формулой NH4[3] (см. Свободный аммоний).
Диссоциация солей аммония[править | править код]
При диссоциации солей аммония в водных растворах образуется катион аммония, например:
Свойства солей аммония[править | править код]
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
- Прочность солей аммония сильно различается. Чем сильнее кислота, тем более устойчива соль аммония. Так, соль сильной соляной кислоты хлорид аммония вполне стабилен при комнатной температуре, а соль слабой угольной кислоты карбонат аммония в этих условиях заметно разлагается.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
Если соль образована нелетучей кислотой, то нагревание протекает с разложением аммонийной соли:
- Если анион соли аммония содержит атом-окислитель, то при её нагревании происходит реакция внутримолекулярного окисления-восстановления, например:
- Восстановительные свойства аммония используются во взрывчатых веществах, например аммоналах.
Реакция обнаружения аммония[править | править код]
Реакция для обнаружения аммония — выделение аммиака при действии едких щелочей на соли аммония:
Широко используется для спектрофотометрического количественного анализа также реакция с реактивом Несслера.
«Свободный аммоний»[править | править код]
При взаимодействии раствора хлорида аммония с амальгамой натрия образуется «амальгама аммония» — тестообразная масса, выделяющая водород и аммиак[4].
При действии иодида аммония на синий раствор металлического натрия в жидком аммиаке наблюдается обесцвечивание, которое может быть интерпретировано как образование «свободного аммония»:
Заметное разложение этого раствора с выделением водорода идет при температурах выше −40 °C, образовавшаяся бесцветная жидкость легко присоединяет иод (предположительно — по схеме):
однако существование свободного радикала в этом случае сомнительно, в 1960-х годах предполагалось, что в этом растворе присутствуют сольватированные аммиаком атомы водорода [5].
Замещённые соединения аммония[править | править код]
Органические[править | править код]
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические[править | править код]
Тетрафтораммоний представляет собой аммоний, все четыре атома водорода в котором замещены фтором. Тетрафтораммоний является одним из немногих соединений, в которых азот имеет степень окисления +5, является сильнейшим окислителем и устойчив только в соединении с комплексными фтористыми анионами, например, тетрафтороборатом .
См. также[править | править код]
Литература[править | править код]
- Некрасов Б. В. Основы общей химии. — 14-е изд. — М.: Госхимиздат, 1962. — 976 с.
- Аммоний // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890. — Т. Ia. — С. 658—661.
Примечания[править | править код]
- ↑ Onium compounds// IUPAC Gold Book. Дата обращения: 19 июля 2012. Архивировано 15 ноября 2016 года.
- ↑ Н. С. Ахметов. Неорганическая химия. Учебное пособие для ВУЗов. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1975. — С. 394. — 672 с.
- ↑ Некрасов, 1962, с. 339.
- ↑ Некрасов, 1962, с. 659.
- ↑ Некрасов, 1962, с. 347.














![{\displaystyle {\ce {[NF4]^+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc6bd589f1a7e38d306676aeefb24a39278d877b)
![{\displaystyle {\ce {[BF4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91655ea3c1f87ae6afe09f78665b0ec810b908d0)