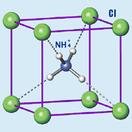
Хлорид аммония
| Хлорид аммония | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид аммония | ||
| Хим. формула | |||
| Физические свойства | |||
| Состояние | бесцветные кубические кристаллы | ||
| Молярная масса | 53,49 г/моль | ||
| Плотность | 1,526 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 337,6 °C | ||
| • сублимации | 337,6 (с разл.) °C | ||
| • кипения | 520 °C[1][2] | ||
| Энтальпия | |||
| • образования | -314,2 кДж/моль | ||
| Давление пара | 1 ± 1 мм рт.ст.[3] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 37,2 г/100 г (20 °C) | ||
| Классификация | |||
| Рег. номер CAS | 12125-02-9 | ||
| PubChem | 25517 | ||
| Рег. номер EINECS | 235-186-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | BP4550000 | ||
| ChEBI | 31206 | ||
| ChemSpider | 23807 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||

Хлори́д аммо́ния (хло́ристый аммо́ний; техническое название — нашаты́рь) — неорганическое соединение, соль аммония и соляной кислоты с химической формулой белый кристаллический слегка гигроскопичный порошок без запаха. Зарегистрирован в качестве пищевой добавки E510.
Хорошо растворяется в воде. Не образует кристаллогидратов.
Нахождение в природе[править | править код]
В природе хлорид аммония представлен минералом нашатырь, от араб. ﻧﺸﺎﺩﺭ (nūšādir) — «аммиак»[4].
Природный раствор хлорида аммония, находящийся в целоме, обеспечивает нейтральную плавучесть гигантских планктонных кальмаров — кранхиид и других крупных кальмаров так как водный раствор хлорида аммония в теле кальмаров имеет плотность ниже плотности морской воды[5][6].
Физические свойства[править | править код]
Бесцветные или белые кристаллы кубической сингонии (а = 0,38758 нм, z = 1, пространственная группа Pm3m). Относительная плотность = 1,526. Кубическая модификация стабильна ниже температуры 184,3 °C. Соединение возгоняется при 337,6 °C с разложением на аммиак и соляную кислоту[7][8] (правильнее: хлороводород или хлористый водород HCl).
Хорошо растворим в воде (37,2 г/100 мл), жидком аммиаке. Водные растворы вследствие гидролиза имеют слабокислую реакцию. Температура кипения насыщенных водных растворов 116 °C[7].
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Химические свойства[править | править код]
Реагирует со щелочами с выделением аммиака[8]:
- .
Реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света[8]:
- .
Реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
- .
Под действием электрического тока разлагается с образованием хлористого азота .
Получение[править | править код]
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия (промежуточный продукт при получении соды по методу Сольве):
- .
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор хлорида натрия .
Иногда используют реакцию взаимодействия аммиака с хлором:
- .
Реакция взаимодействия аммиака и соляной кислоты:
- .
Применение[править | править код]
- азотное удобрение (до 25 % азота) для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свёкла, рис, кукуруза);
- зарегистрирован в качестве пищевой добавки E510, в скандинавских странах и Финляндии применяется как пищевая приправа, в том числе в составе лакричных конфет «Tyrkisk Peber» «Salmiakki» и т. д.;
- используют при пайке как флюс (для удаления оксидной плёнки с поверхностей металлов);
- в гальванических элементах как компонент электролита;
- в медицине при отёках вызванных сердечной недостаточностью и для усиления действия диуретиков;
- в лабораторных технологиях для лизиса эритроцитов;
- как дымообразователь;(обратимо разлагается при нагреве на хлороводород и аммиак — трудноразделимую подвижную смесь газов, которая при остывании снова образует микрокристаллический порошок хлорида аммония в виде дыма, малоопасного для человека и животных.
- в фотографии как компонент быстрого фиксажа, для получения тиосульфата аммония непосредственно в растворе[9].
Примечания[править | править код]
- ↑ AMMONIUM CHLORIDE
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ http://www.cdc.gov/niosh/npg/npgd0029.html
- ↑ Криштофович А. Н. Геологический словарь / отв. ред. Спижарский Т. Н.. — Москва: Госгеолтехиздат, 1955. — Т. II М—Я. — С. 66. — 449 с., переиздание «Книга по требованию» ISBN 978-5-458-36654-0.
- ↑ И. И. Акимушкин, Ю. А. Филиппова. Подотряд Океанические кальмары (Oegopsida) // Жизнь животных. В 7 т. / гл. ред. В. Е. Соколов. — 2‑е изд., перераб. — М. : Просвещение, 1988. — Т. 2 : Моллюски. Иглокожие. Погонофоры. Щетинкочелюстные. Полухордовые. Хордовые. Членистоногие. Ракообразные / под ред. Р. К. Пастернак. — С. 141. — 447 с. : ил. — ISBN 5-09-000445-5.
- ↑ Denton, E. J.; Gilpin-Brown, J. B.; Shaw, T. I. (1969). "A Buoyancy Mechanism Found in Cranchid Squid". Proceedings of the Royal Society of London. Series B, Biological Sciences. 174 (1036): 271—279. Bibcode:1969RSPSB.174..271D. doi:10.1098/rspb.1969.0093. JSTOR 75757. S2CID 94534922. Архивировано из оригинала 22 апреля 2021. Дата обращения: 27 декабря 2020.
- ↑ 1 2 Крашенинников, 1988.
- ↑ 1 2 3 Гурлев, 1988, с. 286.
- ↑ Гурлев, 1988, с. 285—286.
Литература[править | править код]
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Крашенинников С. А. Аммония хлорид // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 155. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
В другом языковом разделе есть более полная статья Ammonium chloride (англ.). |