Хлорид ванадия(III)
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 июля 2023 года; проверки требует 1 правка.
| Хлорид ванадия(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорид ванадия(III) |
| Традиционные названия | Хлористый ванадий |
| Хим. формула | VCl3 |
| Физические свойства | |
| Состояние | фиолетовые кристаллы |
| Молярная масса | 157,30 г/моль |
| Плотность | 2,87; 3,00 г/см³ |
| Термические свойства | |
| Энтальпия | |
| • образования | -597,7 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7718-98-1 |
| PubChem | 62647 |
| Рег. номер EINECS | 231-744-6 |
| SMILES | |
| InChI | |
| RTECS | YW2800000 |
| ChemSpider | 10801024 и 56399 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д вана́дия(III) (трихлори́д вана́дия, трёххло́ристый вана́дий) — неорганическое соединение, соль металла ванадия и соляной кислоты с формулой VCl3, фиолетовые кристаллы, плохо растворимые в воде, образует кристаллогидрат с химической формулой VCl3·6H2O.
Получение[править | править код]
- Электролиз суспензии оксида ванадия(V) в разбавленной соляной кислоте:
- Разложение при нагревании хлорида ванадия(IV):
- Восстановление атомарным водородом хлорида ванадия(IV):
- Восстановление ванадием хлорида ванадия(IV):
Физические свойства[править | править код]
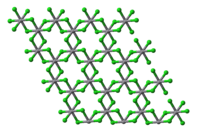
Хлорид ванадия(III) образует фиолетовые кристаллы тригональной сингонии, пространственная группа R 3, параметры ячейки a = 0,6012 нм, c = 1,734 нм, Z = 6.
Возгоняется при температуре выше 425 °C[1]. Растворим в воде. При кристаллизации из водных растворов осаживается кристаллогидрат состава VCl3·6H2O[1], который имеет строение [V(H2O)4Сl2]Cl.
Химические свойства[править | править код]
- Разлагается при нагревании в инертной атмосфере:
- Реагирует с концентрированными серной и азотной кислотами:
- Реагирует с щелочами:
- Восстанавливается водородом:
- Реагирует с хлоридами щелочных металлов:
- Реагирует с монооксидом углерода в сероуглероде:
Примечания[править | править код]
- ↑ 1 2 Коршунов, 1988.
Литература[править | править код]
- Коршунов Б. Г. Ванадия галогениды // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 351. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |












![{\displaystyle {\mathsf {VCl_{3}\ {\xrightarrow {KCl,800^{o}C}}\ K[VCl_{4}],K_{3}[VCl_{6}],K_{2}[V_{2}Cl_{9}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ccc5d518cac36956a41c779243762c1b12582e2)
![{\displaystyle {\mathsf {2VCl_{3}+12CO+4Mg\ {\xrightarrow {135^{o}C}}\ Mg[V(CO)_{6}]\downarrow +3MgCl_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ca6a74fdf30ad219f46129d231b0a96b00df283)
![{\displaystyle {\mathsf {Mg[V(CO)_{6}]+2HCl\ {\xrightarrow {}}\ V(CO)_{6}+MgCl_{2}+H_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89abd4d05ce75604aa00726f69a16c3041d77cff)