Обсуждение:Дисульфид кобальта(II)
Наименование статьи: Идентификация[править код]
Это точно не оно? В «справочнике» и «энциклопедии» не разные ли вещества описываются? WBR, BattlePeasant 04:18, 13 марта 2014 (UTC)
- То вещество по ссылке называется «сульфид кобальта(IV)». --Tretyak 19:44, 13 марта 2014 (UTC)
- Но ведь ни в справочнике, ни в энциклопедии это вещество не называется «дисульфидом кобальта(II)». WBR, BattlePeasant 07:32, 16 марта 2014 (UTC)
- Ни в справочнике, ни в энциклопедии их не называют с использованием международной номенклатуры. Название «Дисульфид(2-) кобальта(II)» рекомендует ИЮПАК. --Tretyak 16:52, 16 марта 2014 (UTC)
- Не рекомендует. Потому статья и стоит к переименованию. starless 20:22, 16 марта 2014 (UTC)
- Рекомендует!.. лат. dura lex, sed lex… см. ВП-КПереиМ --De Riban5 11:08, 3 апреля 2014 (UTC)
- Не рекомендует. Потому статья и стоит к переименованию. starless 20:22, 16 марта 2014 (UTC)
- Ни в справочнике, ни в энциклопедии их не называют с использованием международной номенклатуры. Название «Дисульфид(2-) кобальта(II)» рекомендует ИЮПАК. --Tretyak 16:52, 16 марта 2014 (UTC)
- Но ведь ни в справочнике, ни в энциклопедии это вещество не называется «дисульфидом кобальта(II)». WBR, BattlePeasant 07:32, 16 марта 2014 (UTC)
Co4+ не бывает такого иона (катиона)! …и, соответственно, Сульфид кобальта (IV) не существует в природе
Соединения Co (III) менее устойчивы, чем соединения железа (III), и проявляют более сильно выраженную окислительную способность (бинарные соединения и соли кобальта (III) нестойки (и нехарактерны) и легко переходят в соли кобальта (II); соединения Co (IV) ещё менее устойчивы):
Co(OH)3 + 4H2SO4 = 4CoSO4 + 10H2O + O2↑
(Co2O3 или) Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
Особая (необычная) устойчивость Co3+ (и отсутствие её таковой для Co4+), т.е. валентно-электронная [низкоспиновая] d6-конфигурация (3d64s0) может объясняться в рамках теории поля лигандов (или делокализованных молекулярных орбиталей) → теория химической связи в координационных соединениях (Теория кристаллического поля).
O=Co=O, S=Co=S
Два атома S (или O) просто «раздавят» (поляризуют, деформируют) катион Fe, или Co, или Ni (в отличие от IV-ковалентных C, Sn, Pb, Ti, Zr, Hf и платиновых благородных металлов)…
Металлический радиус атома / Условный радиус иона E2+
Fe = 0.126 / 0.080 nm
Co = 0,125 / 0,078
Ni = 0.124 / 0.074 (условный радиус иона E4+ невозможно найти в справочной литературе, т.к. катионы Fe4+, Co4+, Ni4+ не существуют в химии, или весьма редки; Fe4+ ≈ 0,62 Å только для аниона [FeO3]2-)
Ковалентный радиус атома / Условный радиус иона E2 −
(F−) = 0,064 / 0,133
O = 0,066 / 0,136
S = 0,104 / 0,182 нм
As = 0,120 / 0,191
В предполагаемой (мифической) молекуле S=Fe=S (S=Co=S) векторная сумма дипольных моментов двух связей Fe—S[1] (Co—S) отличается от нуля. Суммарный дипольный момент (& полярность и поляризация/деформация) выталкивает оба атома серы из линейного (180°) в угловое (≈менее 60°) строение и сближает два атома серы настолько, что между ними осуществляется ещё одна димерная (персульфидная —S—S—) связь. Железо (& Кобальт) при этом переходит из гипотетического (малореального) IV-валентного в более энергетически выгодное (устойчивое) II-валентное состояние. Получается структура замкнутого треугольника (типа циклопропана и/или CaC2, MgO2, BaO2), где все три атома – железо и две серы – II-валентны.
- ↑ предположим, что при образовании хим. связи в молекуле мы не знаем о порядке связи – одинарна (Fe—S) или двойная (Fe=S) она
Так ли эдак, может не так, может — примерно так... может и не прав?..
Если Оксид кобальта(IV) (& CoF4) известен, то Сульфид кобальта(IV) не существует…
Предлагаю статью переименовать в Персульфид кобальта
ВП:К переименованию/7 февраля 2014#Дисульфид(2-) железа(II) → Дисульфид железа(II) --De Riban5 10:50, 11 апреля 2014 (UTC)
- «Суммарный дипольный момент… выталкивает оба атома серы…» это кошмар какой-то. Вы вообще имеете представление об том, какими факторами определяются углы между ковалентными связями? Не настала ли пора сделать паузу в поучениях в сторону Википедии и самому повысить уровень знания матчасти? Incnis Mrsi 12:36, 12 апреля 2014 (UTC)
Спасибо за замечание. Да ладно… Я вас умоляю (→Одесский язык), если у вас есть аргументы в пользу IV-валентности кобальта — милости просим (выражайтесь конкретнее — следует воздержаться от простых ссылок на EN-wiki в качестве ответа на аргумент другого участника, — такой диалог непродуктивен). По поводу II-валентного (и невозможности IV-валентного) соединения — существует немалое число доводов. И мы перечислили всего лишь малую толику. Степень ионности (эффективный электростатический заряд), Полярность (дипольный момент), Поляризация (деформация)/Поляризуемость[1], а также наличие валентных электронов и неподелённых электронных пар на гибридных орбиталях (Co (II) 3d74s0, Co (IV) 3d54s0 → [d1s1p3 (?)]-гибридизация (по типу Cr 3d54s1 → d2s1p3)). ...и не в последнюю очередь тот фактор, что в декаде переходных металлов (d-элементов) 4-го периода [короткого варианта] таблицы ПСХЭ Димона Менделеева Sc — Mn — Zn электроны поначалу наращивают, а к концу завершают 3d- валентный электронный слой, и в первой половине (до Mn) возможны (устойчивы) высшие степени окисления [отвечающие № группы; Mn → VII], а во втором (в т.ч. и в частности Fe, Co, Ni) — низшие — +2, +3 (d-сжатие - типа f-сжатия) [наверно необходимо ещё учесть аномалию непериодического возрастания атомной массы по мере роста Z (заряда атомного ядра/ порядкового № элемента): Co (≈59) < Ni (58,7); и, возможно, «провал» электрона после триады железа (VIII группы) у Cu (3d104s1)]. Стараюсь не учить, а грызть гранит матчасти (по принципу — Дурачёк любит учить, а умный любит учиться; Век живи, век учись…). Стараюсь не учить — а напомнить, ведь некоторые может не знают (может — путают), может подзабыли. Все ж мы люди. ...не Боги горшки лепят.
- ↑ Поляризуемость элемента имеет зачастую даже большее значение, чем его электроотрицательность/полярность. Так, атом серы, обладающий меньшей электроотрицательностью по сравнению с атомом кислорода, за счёт большей по объёму электронной оболочки (большей поляризуемости) легче распределяет/обобществляет (делокализует) заряд, чем атом кислорода. …Чем стабильней образующиеся ионы, тем больше вероятность гетеролитического/ионного разрыва связи (чем больше размер атома, тем легче он поляризуется и тем легче происходит гетеролитический разрыв связи). Стабильность образующегося аниона [элемента] тем выше, чем больше его поляризуемость. Отрицательный [электронный] заряд в персульфид-ионе делокализуется в значительно большем объёме, чем в пероксид-ионе.
…Росту деформируемости (поляризуемости) способствует увеличение радиуса иона и уменьшение положительного заряда ядра. Кислородный ион поляризуется легче, чем ион фтора, так как у него меньше положительный заряд ядра и больше радиус. Анион серы деформируется ещё легче, потому что у него больше внутренних электронных слоев и есть (правда, совсем пустые) d-орбитали, которые он использует при образовании химических связей.
Ситуация похоже аналогична со случаем Se.
O=Se=O (типа OO2 & SO2 …угол искажённый треугольный ≈120° но не, т.е. ≠ 120°), SeF4 (типа SF4 …искажённый тетраэдрический угол ≈109,5° но никак не, т.е. ≠ 109,5°) известны, но с серой Se даёт персульфид Se2+ [—S—S—]2− (Se (IV) стремится → Se (II))
— Эта реплика добавлена участником De Riban5 (о • в) 11:09, 15 апреля 2014 (UTC)
- Я ничего не говорил про 4-валентность. Я говорил об том, что геометрия ковалентных связей определяется геометрией орбиталей, а рассуждать вышеприведённым образом о «дипольном моменте ионной связи» в кристалле глупо. С какой стороны не посмотри, а мысль Ваша ускользает. Сам тезис, что-де переходный металл (со своими гибридными sd-орбиталями) не станет выбрасывать две ковалентные связи в противоположные направления, по-видимому, разумен. Но неразумны (и показывают невладение азами квантовой химии) рассуждения о выталкивании атомов путём неуказанного дипольного момента непонятно чего. Потом, пускай даже молекула имеет гнутую геометрию, это само по себе не означает наличие каких-то связей между крайними атомами. Причём я не утверждаю, что в этих веществах нет связи «сера–сера» — моих знаний для такого недостаточно. В отличие, по-видимому, от Ваших. Incnis Mrsi 12:14, 15 апреля 2014 (UTC)
- (Показана теоретическая возможность/невозможность дисульфида S=Co=S, и возможная практическая (реальная) возможность образования и существования персульфида CoS2 → Co2+[-S—S-]2−; это лишь предположение, более точными фактами мы не располагаем) Исходя из дипольного момента мы получим сведения о полярности связи; согласно последней можем судить о степени ионности химического соединения (насколько оно ионно/ ковалентно; вроде так...). Мы говорим о метрических свойствах (валентных углах... топологии...) одной молекулы хим. соединения CoS2 (пары-тройки атомов), но не кристалла (1010…1050…10100 атомов) (угол, кстати и там, и там [почти и/или =] 90°, как у буквы Т ; в основании - Co, а на шляпке висят две S; между серединкой шляпки (поделенной электронной парой двух S) и основанием (Co) октаэдрический угол 90° и в [октаэдрическом] кристалле (типа NaCl), и в молекуле)! Да и причём тут кристалл (агрегатное состояние) к наименованию химического соединения?!? ?!? (физика?!? (кристаллофизика? кристаллохимия?) геохимия?!?) а если и кристалл, то какой??..
…и даже с помощью кристалла-структуры мы нашли возможность объяснить и структуру (соотношение атомов -валентность-К.Ч.), и топологию молекулы
…выталкивать атомы (гнуть/искажать геометрию-топологию) будут не дипольные моменты, а скорее векторная сумма их (и, может быть не в последнюю очередь, наличие неподелённых (невовлеченных) валентных электронов → Co (II) 3d74s04p0). Вероятнее и скорее всего дипольный момент будет не компенсирован (≠ 0), т.к. молекула замкнутая [трёхугольная] циклическая (?) (как наприм. у этиленоксида и этиленимина, & Ethylene sulfide). А в_общем и целом и впрочем соглашусь… типа соглашусь. Мог бы согласиться с вами, но тогда мы оба будем неправы. --De Riban5 08:04, 17 апреля 2014 (UTC)
угол кстати в кристалле можно объяснить и с точки зрения 180° октаэдрического - …Co—S2—Co—S2—Co—S2—Co—S2—… (типа как в пирите), кристаллы ведь бывают ленточные, цепочечные, лестничные, каркасные... Што касается молекулы и непосредственно валентного угла — то [в воображении] соедините шляпку и основание ножки буквы T, получите треугольную Структурную формулу (типа как у циклопропана, MgO2, Hg2O, пероксида HgO2, персульфида HgS2). эти треугольники своими основаниями (шляпками буквы T, т.е. димерным анионом S22−) направлены во все шесть сторон октаэдра (тобто угол 90°). а непосредственно валентный угол (в треугольнике) будет зависеть от межъядерных расстояний Co—S и S—S и будет ≈60° (+/−)… другое дело, какое отношение угол и длина связи имеют к наименованию соединения (двухвалентных металлов), и причём здесь кристаллы (агрегатное состояние)?!? ?!? --De Riban5 08:08, 17 апреля 2014 (UTC) - «…это кошмар какой-то» - Не в моих правилах давать советы, но я бы на вашем месте не очень-то удивлялся. Мы находимся в RU-wiki и, похоже, тут вообще нечему удивляться?!? Для примера на досуге почитайте ВП:КПМ. Особенно прошу обратите внимание на проталкивание линии зрения номинатора (инициатора) и особо не изумляйтеся (недоумевайте) на предварительные итоги и итог… Может мы не правы, но складывается впечатление что обсуждение не читали (может я и не прав, может чего-то недопонимаю?!?) С ув. --De Riban5 08:04, 18 апреля 2014 (UTC)
- Вы знаете, как «уважаемые люди» подводят итоги в английском разделе? Если Вы хотите сравнить подход там и тут, я могу снабдить Вас ссылками (напишите мне в обсуждение только). Incnis Mrsi 08:16, 18 апреля 2014 (UTC)
- Положим и так (в чём мы сомневаемся), а может вы и правы… Если и сравнить, то не для импорта бредятины, а для - как её уменьшить и недопускать (могет я в чем-то не прав?!? может - а оно мне надо (зачем мне етот гембель)? шо я лучше всех? или хуже?..). Удачи! --De Riban5 11:30, 18 апреля 2014 (UTC)
- Вы знаете, как «уважаемые люди» подводят итоги в английском разделе? Если Вы хотите сравнить подход там и тут, я могу снабдить Вас ссылками (напишите мне в обсуждение только). Incnis Mrsi 08:16, 18 апреля 2014 (UTC)
- (Показана теоретическая возможность/невозможность дисульфида S=Co=S, и возможная практическая (реальная) возможность образования и существования персульфида CoS2 → Co2+[-S—S-]2−; это лишь предположение, более точными фактами мы не располагаем) Исходя из дипольного момента мы получим сведения о полярности связи; согласно последней можем судить о степени ионности химического соединения (насколько оно ионно/ ковалентно; вроде так...). Мы говорим о метрических свойствах (валентных углах... топологии...) одной молекулы хим. соединения CoS2 (пары-тройки атомов), но не кристалла (1010…1050…10100 атомов) (угол, кстати и там, и там [почти и/или =] 90°, как у буквы Т ; в основании - Co, а на шляпке висят две S; между серединкой шляпки (поделенной электронной парой двух S) и основанием (Co) октаэдрический угол 90° и в [октаэдрическом] кристалле (типа NaCl), и в молекуле)! Да и причём тут кристалл (агрегатное состояние) к наименованию химического соединения?!? ?!? (физика?!? (кристаллофизика? кристаллохимия?) геохимия?!?) а если и кристалл, то какой??..
Форма молекулы определяется длинами связей между атомами и углами между связями. В свою очередь, длины связей и углы зависят от строения электронных оболочек атомов и их взаимного влияния друг на друга.
Число ближайших соседей определяется валентностью атома, а их расположение — наиболее выгодной ориентацией химических связей.
Устойчивому состоянию молекулы отвечает такая её геометрическая структура и такое пространственное расположение электронных облаков внешних оболочек атомов, которым отвечает наименьшая потенциальная энергия молекулы.
Формально четырёхвалентны Fe, Co и Ni в сульфидах общей формулы ES2. Однако по существу [де-факто] эти сульфиды являются солями двусернистого водорода (H2S2) и элементы семейства [триады] железа в них двухвалентны. В природе из рассматриваемых сульфидов встречается только FeS2. Чёрный порошок CoS2 образуется при длительном действии на Co избытка расплавленной серы. Тёмно-серый NiS2 может быть получен прокаливанием смеси NiCO3 с серой и K2CO3. Оба эти полисульфида (персульфида), равно как и FeS2, при накаливании отщепляют часть серы и переходят в соответствующие сульфиды [FeS…]. Для пирита реакция по схеме FeS2 + 21 ккал ↔ FeS + S заметно обратима в интервале 550–700°C.
<...>
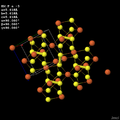
Важнейшим представителем рассматриваемых [персульфидных] соединений является минерал пирит FeS2 (fr:Pyrite), ежегодная мировая добыча которого исчисляется многими миллионами тонн. Структура его кристалла показана на рис. Однотипно кристаллизуются CoS2 и NiS2. Интересно изменяются в этих кристаллах ядерные расстояния E—S и S—S (Å): 2,26 и 2,18 (Fe), 2,32 и 2,12 (Co), 2,40 и 2,07 (Ni).
При почти одинаковых их суммах [4,44…4,45…4,47] связи E—S последовательно удлиняются, а связи S—S укорачиваются (приближаясь к их длине в молекуле H2S2 — 2,05 Å (0,205 nm)).— Некрасов Б.В. Основы общей химии. – 3-е изд., испр. и доп. – М.: Химия, 1973. — Т. II. – стр. 376-377, 364
Рис.-структура полностью соответствует http://skywalker.cochise.edu/wellerr/students/pyrite/project.htm и
-
Пирит
Теперь осталось найти только углы.
Угол можно найти простыми и не очень способами:
измерить транспортиром, линейкой (см. Тригонометрия треугольников), посредством тригонометрических функций (cos – простым[простейшим] калькулятором) и таблиц, вычислить инженерным/«тригонометрическим» калькулятором
(cos, arccos), с помощью функций таблицы MS Office Excel (cos, затем arccos, и перевести [также функциями] значение радианов в градусы (°) – при наличии ПК), и при наличии доступа к Интернету – on-line ([1], [2])
(при тригонометрических вычислениях для облегчения — поскольку мы не знаем угол — центральный (характеристический) угол делится пополам перпендикуляром (медиана-биссектриса) к основанию (–S—S–). Поскольку длина перпендикуляра (медианы) получается дробной (по Пифагору), пользуемся целочисленными значениями, т.е. половиной основания (S—S). Основание как раз и будет шляпкой (S22−), а перпендикуляр [равнобедренного треугольника] — ножкой буквы «T», о которой речь ишла выше):
| Длина связи и угол персульфидов триады железа | Длина E — S | S — S | ∠ S—E—S |
|---|---|---|---|
| FeS2 | 2.26 Å | 2.18 | 58° (57,5°) |
| CoS2 | 2.32 | 2.12 Å | 55° (54,5°) |
| NiS2 | 2.40 Å | 2.07 | 52,5° (51,5°) |
При значении валентного угла характеристического атома ≈60° и/или меньше 60° отдельные связи E—S (одинарные или двойные) не могут существовать, они по-любому замыкаются образуя циклический треугольник, как у BaS2, BaO2, MgO2, Hg2O (Hg1+), Hg2S (Hg1+)… типа как у циклопропана --De Riban5 11:13, 23 мая 2014 (UTC)
Эта статья была переименована по результатам обсуждения от 7 февраля 2014 года. Старое название Дисульфид(2-) кобальта(II) было изменено на новое: Дисульфид кобальта(II). Для повторного выставления статьи на переименование нужны веские основания, иначе такое действие будет нарушать правила (см. п. 8). |
Участник: Tretyak и его война правок[править код]
Считаю, что вот такое неаргументированное уничтожение великих и малых добавлений и поправок скопом не только наносит ущерб Википедии, но и подрывает мотивацию участников. Надеюсь, что (за вычетом самого Tretyak) противоположное мнение не имеет носителей. Incnis Mrsi (вклад) 10:55, 30 мая 2014 (UTC)
- Если для участника Incnis Mrsi фраза «Ложные АИ» не являются аргументом, то об этом модно только сожалеть. --Tretyak 11:01, 30 мая 2014 (UTC)
- Фраза — не аргумент, разумеется. А вот удаление текста, подтверждённого высококачественным источником ТСИВ — это деструктивно. starless 19:55, 30 мая 2014 (UTC)
Там же незначительное содержание Дисульфид кобальта(II). Сейчас текст явно будет вводить читателя в заблуждение, нужно исправлять.WBR, BattlePeasant 13:28, 30 мая 2014 (UTC)- Где «там»? Соблаговолите выразить мысль точнее. Incnis Mrsi (вклад) 15:27, 30 мая 2014 (UTC)
- Хотя, тем не менее, вроде бы добывают, так что реплику отзываю. WBR, BattlePeasant 16:48, 30 мая 2014 (UTC)
- «Ложные АИ» — не совсем верная постановка вопроса. Дисульфид железа FeS2 (Хим. Энциклопедия) — ложный АИ? Или АИ, содержащий ложные сведения (псевдонаучные названия)? Мы уже обращали на это неоднократно внимание. Если под этой формулой встречается такое-то наименование, и/или под этим названием встречается энта формула, — то необходимо и перечислить их (названия) в статье, со ссылками на источники. А какие они источники — ВП:АИ, не-АИ, ложные/неложные (верные/не-очень-верные) — дело десятое… На первом/первоочередном месте - перечислить надо все названия, встречающиеся в литературе. с наилучшими --De Riban5 12:27, 7 июня 2014 (UTC)
- Хотя, тем не менее, вроде бы добывают, так что реплику отзываю. WBR, BattlePeasant 16:48, 30 мая 2014 (UTC)
- Где «там»? Соблаговолите выразить мысль точнее. Incnis Mrsi (вклад) 15:27, 30 мая 2014 (UTC)