Ферредоксин—НАДФ(+) редуктаза
| ferredoxin-NADP+ reductase | |
|---|---|
| Идентификаторы | |
| Шифр КФ | 1.18.1.2 |
| Номер CAS | 9029-33-8 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9029-33-8 |
Ферредоксин-НАДФ+-редуктаза, сокращенно ФНР, фермент из класса оксидоредуктаз, катализирующий реакцию восстановления НАДФ+, используя в качестве донора электронов ферредоксин.
Три необходимых субстрата для этого фермента это восстановленный ферредоксин, НАДФ+ и Н+. Продукты которые образуются в ходе реакции: окисленный ферредоксин и НАДФН. У фермента есть флавиновый кофактор — ФАД.
Фермент принадлежит к семейству оксидоредуктаз, которые используют железо-серные белки в качестве доноров электронов и НАД+ или НАДФ+ в качестве акцепторов электронов.
Участвует в процессе фотосинтеза.
Номенклатура
[править | править код]Систематическое название этого класса ферментов ферредоксин:НАДФ+ оксидоредуктазы. Другие часто использующиеся названия:
- адреноксин редуктаза,
- ферредоксин-НАДФ+ редуктаза,
- ферредоксин-НАДФ+ оксидоредуктаза
Механизм
[править | править код]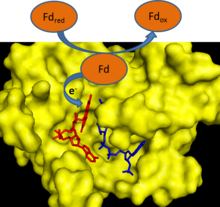
Во время работы электрон-транспортной цепи фотосинтеза происходит перенос электронов от молекулы воды к одноэлектронному белковому переносчику - ферредоксину. Ферредоксин:НАДФ+-редуктаза затем обеспечивает перенос электронов от каждой из двух молекул ферредоксина на одну молекулу двухэлектронного низкомолекулярного переносчика - НАДФ+.[1] ФНР использует ФАД, который может существовать в трёх различных состояниях: полностью окисленном, семихинонном с одним акцептированным электроном и полностью восстановленном состоянии (после акцепции двух электронов).[2]
Механизм катализа ФНР хорошо может быть описан в рамках модели индуцированного катализа.[2] Связывание ферредоксина ферментом ведет к образованию водородной связи между остатком глутамата (Е312) и сериновым остатком (С96) в активном сайте.[3] Остаток глутамата высоко консервативен, поскольку он стабилизирует семихинонную форму ФАД и является донором/акцептором протонов в реакции.[4] Лимитирующей стадией всей реакции являет уход из активного центра первой окисленной молекулы ферредоксина, после одноэлектронного восстановления ФАД.[2] Эта стадия ингибируется высокими концентрациями окисленного ферредоксина и активируется присутствием в среде НАДФ+.[2] Связывание с НАДФ+ снижает сродство фермента к ферредоксину.[5]
Фермент также ускоряет обратную реакцию в ходе которой обраузется восстановленный ферредоксин, который может быть использован в различных биосинтетических путях. У некоторых бактерий и водорослей имеется форма фермента, использующая в качестве одноэлектронного переносчика флаводоксин вместо ферредоксина.
Структура
[править | править код]
Растительная ферредоксин-НАДФ(+)-редуктаза имеет два структурных домена. Первый домен представлен антипараллельным β-цилиндром на N-конце белка с сайтом связывания ФАД.[6] Второй домен на C-конце белка включает несколько α-спираль и β-лист структуру, связывающую НАДФ+.[6][7] Активный центр фермента располагается на стыке между двумя доменами.[8]
Связывание фермента с мембраной тилакоида обеспечивает полипролиновая спираль II типа, образующаяся между двумя мономерами ФНР. Со стороны мембраны в связывании ФНР принимают участие несколько богатых пролином интегральных белков.[9]
По состоянию на конец 2007 года, определены 54 структуры ферментов для этого класса с кодами доступа в PDB.
Функция
[править | править код]Ферредоксин-НАДФ(+)-редуктаза является последним ферментом в цепи переноса электронов в ходе фотосинтеза от фотосистемы I к НАДФН. НАДФН используется в качестве восстановительного эквивалента в реакциях цикла Кальвина. Перенос электрона от ферредоксина к НАДФН происходит только на свету отчасти потому, что активность ФНР ингибируется в темноте.[10] У нефотосинтетических организмов ФНР, в первую очередь, работает в обратном направлении, чтобы обеспечить восстановленным ферредоксином различные метаболические пути. Эти пути включают азотофиксацию, биосинтез терпеноидов, метаболизм стероидов, ответ на окислительный стресс и биогенез железо–серных белков.
ФНР - это водорастворимый белок, который обнаруживается в свободном виде в строме хлоропласта и встроенным в мембрану тилакоида. Это связывание происходит с противоположной стороны от активного центра фермента и, скорее всего, не влияет на структуру активного центра и не имеет значительного влияния на ферментативную активность. Когда он связан с мембраной тилакоида, то существует в виде димера, но когда фермент находится в строме, то в качестве мономера. Скорость связывания ФНР с интегральными мембранными белками на тилакоидной мембране увеличивается в кислой среде, поэтому связывание ФНР с тилакоидной мембраной может быть способом хранения и стабилизации фермента в темноте, когда фотосинтеза не происходит.[11] рН стромы хлоропластов колеблется от слегка кислого в темноте к более щелочному на свету. Таким образом, в темноте больше ФНР будет связываться с тилакоидной мембраной, а на свету больше ФНР будет диссоциировано и в свободном виде находиться в строме.
Эволюция
[править | править код]Ферредоксин-НАДФ(+)-редуктазы присутствуют во многих организмах, включая растения, бактерии, митохондрии эукариот. Однако, эти белки относятся к двум несвязанным семействам и являются примером конвергентной эволюции. ФНР растительного типа включают пластидные ФНР растений и бактериальные ФНР. ФНР глутатион-редуктазного типа встречаются в митохондриях эукариот.
В семействе растительных ФНР селективное эволюционное давление привело к различиям в каталитической эффективности у фотосинтезирующих и нефотосинтезирующих организмов. Перенос электронов с помощью ФНР является лимитирующей стадией в процессе фотосинтеза, поэтому пластидные ФНР в растениях эволюционировали в высокоэффективные. Эти пластидные ФНР в 20-100 раз более активные, чем бактериальные ФНР.[12] Эта высокая каталитическая эффективность переноса электронов от ФАД к НАДФ связана со структурными изменениями в активном центре, которые уменьшают расстояние между N5 в ФАД и С4 в НАДФ(+).[13]
Пластидные ФНР растений также эволюционно приобрели высокую степень субстратной специфичности для НАДФ(+), чем для НАД(+); анализ аминокислотных мутаций показал, что концевой тирозиновый остаток в пластидных ФНР играет ключевую роль в этой субстратной специфичности. В отличие от них, некоторые нефотосинтетические ФНР не связывают НАДФ(+) преимущественно и у них отсутствует этот тирозиновый остаток.
Мишень для терапии протозойных инфекций человека
[править | править код]Фермент рассматривается в качестве возможных мишеней для терапии некоторых распространенных протозойных заболеваний человека, вызванных облигатными внутриклеточными паразитами из типа Апикомплексы (Apicomplexa).
Для Апикомплексов характерно наличие особых органелл - апикопластов. Апикопласты возникли в результате симбиогенеза предка паразита с водорослью. Поэтому в апикопласте содержится ФНР растительного типа, которая используется для восстановления ферредоксина, являющегося важным донором электронов во многих метаболических путях.[14] В то же время у человека отсутствуют белки близкие растительным ФНР, что делает их перспективными мишенями для лекарственной терапи.
К настоящему времени секвенированы гены ФНР из двух основных представителей апикомплексов, поражающих людей: Plasmodium falciparum (возбудитель малярии) и Toxoplasma gondii (возбудитель токсоплазмоза).[15] Ведутся работы по поиску препаратов, подавляющих ФНР этих паразитов.
Ссылки
[править | править код]- ↑ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert. Biochemistry (неопр.). — 6th. — New York: W.H. Freeman[англ.], 2007. — ISBN 0-7167-8724-5.
- ↑ 1 2 3 4 Carrillo, N.; Ceccarelli, EA. Open questions in ferredoxin-NADP+ reductase catalytic mechanism (англ.) // Eur J Biochem[англ.] : journal. — 2003. — May (vol. 270, no. 9). — P. 1900—1915. — doi:10.1046/j.1432-1033.2003.03566.x. — PMID 12709048.
- ↑ Kurisu, G.; Kusunoki, M.; Katoh, E.; Yamazaki, T.; Teshima, K.; Onda, Y.; Kimata-Ariga, Y.; Hase, T. Structure of the electron transfer complex between ferredoxin and ferredoxin-NADP+ reductase (англ.) // Nat Struct Biol : journal. — 2001. — February (vol. 8, no. 2). — P. 117—121. — doi:10.1038/84097. — PMID 11175898.
- ↑ Dumit, VI.; Essigke, T.; Cortez, N.; Ullmann, GM. Mechanistic insights into ferredoxin-NADP(H) reductase catalysis involving the conserved glutamate in the active site (англ.) // J Mol Biol[англ.] : journal. — 2010. — April (vol. 397, no. 3). — P. 814—825. — doi:10.1016/j.jmb.2010.01.063. — PMID 20132825.
- ↑ Medina, M. Structural and mechanistic aspects of flavoproteins: photosynthetic electron transfer from photosystem I to NADP+ (англ.) // FEBS J[англ.] : journal. — 2009. — August (vol. 276, no. 15). — P. 3942—3958. — doi:10.1111/j.1742-4658.2009.07122.x. — PMID 19583765.
- ↑ 1 2 Aliverti, A.; Pandini, V.; Pennati, A.; de Rosa, M.; Zanetti, G. Structural and functional diversity of ferredoxin-NADP+ reductases (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 2008. — June (vol. 474, no. 2). — P. 283—291. — doi:10.1016/j.abb.2008.02.014. — PMID 18307973.
- ↑ Paladini, DH.; Musumeci, MA.; Carrillo, N.; Ceccarelli, EA. Induced fit and equilibrium dynamics for high catalytic efficiency in ferredoxin-NADP(H) reductases (англ.) // Biochemistry : journal. — 2009. — June (vol. 48, no. 24). — P. 5760—5768. — doi:10.1021/bi9004232. — PMID 19435322.
- ↑ Arakaki, AK.; Ceccarelli, EA.; Carrillo, N. Plant-type ferredoxin-NADP+ reductases: a basal structural framework and a multiplicity of functions (англ.) // The FASEB Journal[англ.] : journal. — Federation of American Societies for Experimental Biology[англ.], 1997. — February (vol. 11, no. 2). — P. 133—140. — PMID 9039955.
- ↑ Alte, F.; Stengel, A.; Benz, JP.; Petersen, E.; Soll, J.; Groll, M.; Bölter, B. Ferredoxin:NADPH oxidoreductase is recruited to thylakoids by binding to a polyproline type II helix in a pH-dependent manner (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2010. — November (vol. 107, no. 45). — P. 19260—19265. — doi:10.1073/pnas.1009124107. — PMID 20974920. — PMC 2984204.
- ↑ Talts, E.; Oja, V.; Rämma, H.; Rasulov, B.; Anijalg, A.; Laisk, A. Dark inactivation of ferredoxin-NADP reductase and cyclic electron flow under far-red light in sunflower leaves (англ.) // Photosynth Res : journal. — 2007. — October (vol. 94, no. 1). — P. 109—120. — doi:10.1007/s11120-007-9224-7. — PMID 17665150.
- ↑ Benz, JP.; Lintala, M.; Soll, J.; Mulo, P.; Bölter, B. A new concept for ferredoxin-NADP(H) oxidoreductase binding to plant thylakoids (англ.) // Trends Plant Sci[англ.] : journal. — 2010. — November (vol. 15, no. 11). — P. 608—613. — doi:10.1016/j.tplants.2010.08.008. — PMID 20851663.
- ↑ Orellano, EG.; Calcaterra, NB.; Carrillo, N.; Ceccarelli, EA. Probing the role of the carboxyl-terminal region of ferredoxin-NADP+ reductase by site-directed mutagenesis and deletion analysis (англ.) // J Biol Chem : journal. — 1993. — September (vol. 268, no. 26). — P. 19267—19273. — PMID 8366077.
- ↑ Peregrina, JR.; Sánchez-Azqueta, A.; Herguedas, B.; Martínez-Júlvez, M.; Medina, M. Role of specific residues in coenzyme binding, charge-transfer complex formation, and catalysis in Anabaena ferredoxin NADP+-reductase (англ.) // Biochim Biophys Acta[англ.] : journal. — 2010. — September (vol. 1797, no. 9). — P. 1638—1646. — doi:10.1016/j.bbabio.2010.05.006. — PMID 20471952.
- ↑ Balconi, E.; Pennati, A.; Crobu, D.; Pandini, V.; Cerutti, R.; Zanetti, G.; Aliverti, A. The ferredoxin-NADP+ reductase/ferredoxin electron transfer system of Plasmodium falciparum (англ.) // FEBS J[англ.] : journal. — 2009. — July (vol. 276, no. 14). — P. 3825—3836. — doi:10.1111/j.1742-4658.2009.07100.x. — PMID 19523113.
- ↑ Seeber, F.; Aliverti, A.; Zanetti, G. The plant-type ferredoxin-NADP+ reductase/ferredoxin redox system as a possible drug target against apicomplexan human parasites (англ.) // Curr Pharm Des[англ.] : journal. — 2005. — Vol. 11, no. 24. — P. 3159—3172. — doi:10.2174/1381612054864957. — PMID 16178751.
Дополнительно
[править | править код]- Isolation from adrenal cortex of a nonheme iron protein and a flavoprotein functional as a reduced triphosphopyridine nucleotide-cytochrome P-450 reductase (англ.) // Archives of Biochemistry and Biophysics[англ.] : journal. — Elsevier, 1966. — Vol. 117. — P. 660—673. — doi:10.1016/0003-9861(66)90108-1.
- Crystallization of ferredoxin-TPN reductase and its role in the photosynthetic apparatus of chloroplasts (англ.) // Biochem. Z.[англ.] : journal. — 1963. — Vol. 338. — P. 84—96. — PMID 14087348.