Никелоцен
Перейти к навигации
Перейти к поиску
| Никелоцен | |
|---|---|
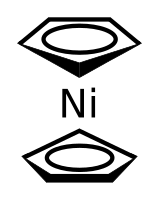 | |
| Общие | |
| Систематическое наименование |
Никелоцен |
| Традиционные названия | Бис(циклопентадиенил)никель |
| Хим. формула | Ni(C5H5)2 |
| Физические свойства | |
| Состояние | тёмно-зелёные кристаллы |
| Молярная масса | 188,88 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 173-174 °C |
| Классификация | |
| Рег. номер CAS | 1271-28-9 |
| PubChem | 62390 |
| Рег. номер EINECS | 215-039-0 |
| SMILES | |
| InChI | |
| RTECS | QR6500000 |
| ChEBI | 30679 |
| ChemSpider | 56178 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Никелоцен — металлоорганическое сэндвичевое комплексное соединение[англ.] никеля с формулой Ni(C5H5)2. Представляет собой тёмно-зелёные кристаллы, не растворимые в воде, не устойчивые на воздухе.
Получение[править | править код]
- Реакция бромида никеля, циклопентадиена и диэтиламина:
Физические свойства[править | править код]
Никелоцен образует тёмно-зелёные парамагнитные кристаллы.
В твёрдом состоянии заметно разлагается на воздухе. Хранят в инертной атмосфере при −30°С.
Не растворяется в воде, растворяется в полярных органических растворителях. Растворы на воздухе очень неустойчивы.
Применение[править | править код]
- Катализатор полимеризации бутадиена.
- Антидетонатор.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Руководство по неорганическому синтезу: В 6-ти т. / Ред. Брауэр Г.. — М.: Мир, 1986. — Т. 6. — 360 с.
- CRC Handbook of Chemistry and Physics. — 89th Edition. — Taylor and Francis Group, LLC, 2008-2009.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |

