Системы секреции III типа
Системы секреции III типа (англ. Type three secretion system, сокр. T3SS), также III тип секреторной системы или инжектосома (т.н. молекулярный шприц) — один из нескольких типов бактериальных систем секреции, является белковым комплексом (иногда рассматривается как органелла), который встречается у некоторых грамотрицательных бактерий[1].
У патогенных бактерий иглоподобная структура используется в качестве сенсорного зонда для обнаружения присутствия клеток эукариотических организмов и выделения белков, которые помогают бактериям инфицировать их. Секретируемые эффекторные белки поступают непосредственно из бактериальной клетки в эукариотическую клетку (клетку-хозяина)[2], где они оказывают ряд эффектов, которые помогают возбудителю выжить и избежать иммунного ответа.
Обзор[править | править код]
Термин система секреции III типа был введён в 1993 году[3]. Эта система секреции отличается по меньшей мере от пяти других систем секреции, обнаруженных у грамотрицательных бактерий. Многие бактерии, ассоциированные с животными и растениями обладают сходными T3SS. Данные T3SSs сходны в результате дивергентной эволюции, и филогенетический анализ поддерживает модель, в которой грамотрицательные бактерии могут передавать мобильную генную кассету T3SS горизонтальным путём другим видам. Наиболее исследованные виды T3SS относятся к видам Shigella (вызывает бактериальную дизентерию), Salmonella (брюшной тиф), Escherichia coli (кишечная микрофлора, некоторые штаммы вызывают пищевое отравление), Vibrio (гастроэнтерит и диарея), Burkholderia (сапы), Yersinia (чума), Chlamydia (хламидиоз, ЗППП), Pseudomonas (поражает людей, животных и растения) и патогенов растений Erwinia, Ralstonia и Xanthomonas, а также растительный симбионт Rhizobium.
T3SS состоит из примерно 30 различных белков, что делает её одной из самых сложных систем секреции. Её структура сходна с бактериальными жгутиками (длинные, жёсткие, внеклеточные структуры, используемые для подвижности). Некоторые из белков, участвующих в T3SS, имеют гомологию аминокислотной последовательности со жгутиковыми белками. Некоторые бактерии, обладающие T3SS, также имеют жгутики и подвижны (например, Salmonella), а у некоторых их нет (например, у Shigella). Технически говоря, система секреции III типа используется как для выведения связанных с инфекцией белков, так и жгутиковых компонентов. Однако термин «система секреции III типа» используется главным образом по отношению к инфекционному аппарату. Жгутик бактерий имеет общего предка с данной секреторной системой[4][5].
T3SS необходимы для патогенности (способности инфицировать) многих бактерий — возбудителей заболеваний. Дефекты в T3SS могут привести такие бактерии к непатогенным. Было высказано предположение, что некоторые неинвазивные штаммы грамотрицательных бактерий потеряли T3SS, потому что такая энергетически невыгодная (дорогая) система не использовалась[6]. Хотя в прошлом традиционные антибиотики были эффективны против данных бактерий, постоянно появляются резистентные к антибиотикам новые штаммы. Понимание того, как работает T3SS, и разработка лекарств, специально предназначенных для данной системы, с конца 1990-х годов стали важной целью многих исследовательских групп по всему миру.
Структура[править | править код]
| Система секреции III типа | |
|---|---|
 Игольчатый комплекс T3SS | |
| Идентификаторы | |
| Символ | T3SS |
| TCDB | 1.B.22 |
| OPM superfamily | 348 |
| OPM protein | 5tcq |
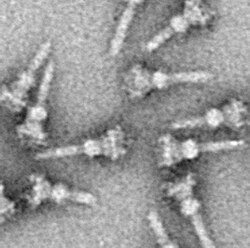
Отличительной чертой T3SS является так называемая игла[7][8](в более общем смысле, игольчатый комплекс (англ. Needle complex, сокр. NC) или аппарат T3SS (англ. T3SS apparatus, сокр. T3SA); также называется инжектосомой, когда АТФаза неактивна ((выключена); см. Ниже). Бактериальные белки, которые должны секретироваться, проходят из бактериальной цитоплазмы через иглу непосредственно в цитоплазму клетки-хозяина. Три мембраны разделяют две цитоплазмы: двойную мембрану (внутреннюю и внешнюю мембраны) грамотрицательной бактерии и эукариотическую мембрану. Игла обеспечивает плавное прохождение через эти высокоселективные и почти непроницаемые мембраны. Одна бактерия может иметь несколько сотен игольчатых комплексов, распределённых по поверхностям её мембраны. Было высказано предположение, что игольчатый комплекс является универсальной особенностью всех T3SS патогенных бактерий[9].
Начало игольчатого комплекса находится в цитоплазме бактерии, он пересекает две мембраны и выступает из клетки. Якорь комплекса, расположенного в мембране является основанием (или базальным телом) T3SS. Внеклеточная часть — игла. Так называемый внутренний стержень соединяет иглу с основанием. Сама игла, хотя и самая большая и довольно заметная часть T3SS, состоит из множества единиц одного белка. Поэтому большинство различных белков T3SS — это те, которые входят в состав основания, и те, которые секретируются в клетку-хозяина. Как упоминалось выше, игольчатый комплекс имеет сходство с жгутиками бактерий. Более конкретно, основание игольного комплекса структурно очень похоже на основания жгутиков; Сама игла аналогична жгутиковому крючку, той структуре, которая соединяет основание с жгутиковой нитью[10][11].
Основание состоит из нескольких круглых колец и является первой структурой, построенной в новом игольчатом комплексе. Как только построение основания завершено, оно служит в качестве молекулярной машины для секреции внешних белков (т.е. иглой). После завершения всего комплекса система переключается на секретирующие белки, которые предназначены для доставки в клетки-хозяева. Предполагается, что игла построена снизу вверх; единицы белка мономеры иглы накапливаются друг на друга, так что единица на кончике иглы добавляется последней. Субъединица иглы является одним из самых маленьких белков T3SS, его размер составляет около 9 кДа. В состав иглы входят 100—150 субъединиц.
Игла T3SS имеет длину около 60—80 нм и ширину внешней части 8 нм. Игла должна иметь минимальную длину, чтобы другие внеклеточные бактериальные структуры (например, адгезины и липополисахаридный слой) не мешали секреции. Отверстие иглы имеет диаметр 3 нм. Большинство уложенных эффекторных белков слишком велики, чтобы транспортироваться через отверстие иглы, поэтому большинство секретируемых белков должно проходить через развёрнутую иглу — это задача, выполняемая АТФазой, расположенной у основания структуры[12].
Белки T3SS[править | править код]
Белки T3SS можно сгруппировать в три категории:
- Структурные белки: воспроизводят основание, внутренний стержень и иглу.
- Эффекторные белки: секретируются в клетку-хозяина и способствуют инфекции/подавляют защиту клеток-хозяев.
- Шапероны: связывают эффекторы в бактериальной цитоплазме, защищают их от агрегации и деградации и направляют их далее в игольчатый комплекс.
Большинство генов T3SS расположены в оперонах. Данные опероны у некоторых видов бактерий располагаются на нуклеоидах и на выделенных плазмидах у других видов. Сальмонеллы, например, имеют хромосомную область, в которой собрано большинство генов T3SS, так называемый островок патогенности сальмонеллы (англ. Salmonella pathogenicity island, сокр. SPI). Shigella, с другой стороны, имеют большую вирулентную плазмиду, на которой находятся все гены T3SS. Многие островки патогенности и плазмиды содержат элементы, которые обеспечивают частую горизонтальную передачу гена островка или плазмиды новому виду.
Эффекторные белки, которые должны секретироваться через иглу, должны распознаваться системой, поскольку они плавают в цитоплазме вместе с тысячами других белков. Рекогниция (распознавание ) осуществляется по сигналу секреции — короткой аминокислотной последовательностью, расположенной в начале (N-терминаль) белка (обычно она включает первые 20 аминокислот), которую способен распознавать игольчатый комплекс. В отличие от других систем секреции, сигнал секреции белков T3SS никогда не отщепляется от белка.
Индукция секреции[править | править код]
Контакт иглы с клеткой-хозяином запускает активацию T3SS[13]; об этом триггерном механизме известно немного (см. Ниже). Секрецию можно также вызывать путём снижения концентрации ионов кальция в питательной среде (для Yersinia и Pseudomonas; добавляют молекулы хелатора, таких как ЭДТА или ЭГТА) и путём добавления ароматического красителя Конго красный в питательную среду (например, для шигелл). Эти и другие методы используются в лабораториях для искусственного стимулирования системы секреции III типа.
Индукция секреции внешними сигналами, отличными от контакта с клетками-хозяевами, также происходят in vivo у инфицированных организмов. Бактерии чувствуют такие сигналы, как температура, pH, осмолярность и концентрация кислорода, и используют их, чтобы «решить», активировать ли их T3SS. Например, сальмонелла может лучше размножаться и проникать в подвздошную кишку, а не в слепую кишку животного. Бактерии могут знать, где они находятся, благодаря различным ионам, присутствующим в этих регионах; подвздошная кишка содержит формиат и ацетат анионы, а в слепой кишке их нет. Бактерии чувствуют эти молекулы, определяют, что они находятся в подвздошной кишке, и активируют их механизм секреции. Молекулы, присутствующие в слепой кишке, такие как пропионат и бутират, оказывают отрицательное влияние на бактерии и ингибируют секрецию. Холестерин, обнаруженный в большинстве мембран эукариотических клеток, способен вызывать секрецию у шигелл.
Перечисленные выше внешние сигналы регулируют секрецию напрямую или с помощью генетического механизма. Известно несколько факторов транскрипции, которые регулируют экспрессию генов T3SS. Некоторые из шаперонов, которые связывают эффекторы T3SS, также действуют как факторы транскрипции. Был предложен механизм обратной связи: когда бактерия не секретирует, её эффекторные белки связываются с шаперонами и плавают в цитоплазме. Когда начинается секреция, шапероны отделяются от эффекторов, а последние секретируются и покидают клетку. Одинокие шапероны затем действуют как факторы транскрипции, связываясь с генами, кодирующими их эффекторы и индуцирующими их транскрипцию и, таким образом, производящими больше эффекторов.
Структуры, подобные инжектосомам типа 3SS, in vivo были предложены в качестве заклёпок бактериальных грамотрицательных наружных и внутренних мембран, которые помогают высвобождению везикул наружных мембран, нацеленных на доставку бактериальных секретов в эукариотические клетки-хозяева или другие клетки-мишени[14].
T3SS-опосредованная инфекция[править | править код]
Эффекторы T3SS входят в комплекс иглы у основания и проходят через иглу вовнутрь клетки-хозяина. Точный способ перехода эффекторов в клетку-хозяина плохо изучен. Ранее было высказано предположение, что сама игла способна прокалывать отверстие в мембране клетки-хозяина; эта теория была опровергнута. Теперь ясно, что некоторые эффекторы, так называемые транслокаторы, секретируются первыми и производят пору или канал (транслокон) в мембране клетки-хозяина, через который могут проникать другие эффекторы. Мутировавшие бактерии, у которых проявляется дефицит транслокаторов, способны секретировать белки, но не способны доставлять их в клетки-хозяева. В общем случае каждый T3SS включает в себя три транслокатора. Некоторые транслокаторы выполняют двойную роль; после того как они участвуют в образовании пор, они перемещаются в клетку и действуют как истинные эффекторы.
T3SS эффекторы манипулируют клетками-хозяевами несколькими способами. Наиболее поразительным эффектом является стимулирование поглощения бактерии клеткой-хозяином. Многие бактерии, обладающие T3SS, должны проникать в клетки-хозяева, чтобы реплицироваться и размножаться. Эффекторы, которые они вводят в клетку-хозяина, побуждают хозяина поглотить бактерию и практически «съесть» её. Чтобы это произошло, бактериальные эффекторы манипулируют механизмом полимеризации актина клетки-хозяина. Актин является компонентом цитоскелета, а также участвует в подвижности и изменениях формы клеток. Благодаря своим эффекторам T3SS бактерия может использовать собственный механизм клетки-хозяина для своей собственной выгоды. Как только бактерия проникла в клетку, она легче способна выделять другие эффекторы и проникать в соседние клетки и тем самым быстро инфицировать всю ткань.
Также было показано, что эффекторы T3SS влияют на клеточный цикл хозяина, и некоторые из них способны индуцировать апоптоз. Одним из наиболее исследованных эффекторов T3SS является IpaB из Shigella flexneri. Он выполняет двойную роль, как в качестве транслокатора, создавая поры в мембране клетки-хозяина, так и в качестве эффектора, оказывая множество негативных воздействий на клетку-хозяина. Было продемонстрировано, что IpaB индуцирует апоптоз в макрофагах — клетках иммунной системы животных — после поглощения ими[15]. Позже было показано, что IpaB достигает этого, взаимодействуя с каспазой 1, основным регуляторным белком в эукариотических клетках[16].
Другим хорошо охарактеризованным классом эффекторов T3SS являются активаторы, подобные активаторам транскрипции (TAL-эффекторы) у Xanthomonas. При введении в клетки растений эти белки могут проникать в ядро растительной клетки, связывая промоторные последовательности и активируют транскрипцию генов растений, которые помогают при бактериальной инфекции[17]. Недавно было продемонстрировано, что распознавание эффекторной ДНК TAL включает в себя простой код[18][19], что значительно улучшило понимание того, как эти белки могут изменять транскрипцию генов в клетках растения-хозяина.
Нерешённые проблемы[править | править код]

С середины девяностых было опубликовано сотни статей о T3SS. Тем не менее, многочисленные проблемы, касающиеся системы, остаются нерешёнными:
- Белки T3SS. Из приблизительно 30 белков T3SS менее 10 в каждом организме были непосредственно обнаружены с использованием биохимических методов. Остальные, возможно, редкие, оказались трудно обнаруживаемыми, и они остаются существующими теоретически (хотя генетические, а не биохимические исследования были проведены на многих генах/белках T3SS). Локализация каждого белка также не совсем известна.
- Длина иглы. Неизвестно, как бактерия «узнает», когда новая игла достигла правильной длины. Существует несколько теорий, в том числе существование «линейного белка», который каким-то образом соединяет кончик и основание иглы. Добавление новых мономеров к кончику иглы должно растягивать линейный белок и тем самым сигнализировать о длине иглы к основанию.
- Энергетика процесса. Сила, которая управляет прохождением белков внутри иглы, до конца не известна. АТФаза, связаная с основанием T3SS и участвует в направлении белков через иглу; но поставляет ли она энергию для транслокации, неясно.
- Сигнал секреции. Как упомянуто выше, существование сигнала секреции в эффекторных белках известно. Данный сигнал позволяет системе отличать белки, переносимые T3SS, от любого другого белка. Его природа, требования и механизм распознавания плохо изучены, но недавно были разработаны методы прогнозирования того, какие бактериальные белки могут транспортироваться системой секреции III типа[21].
- Активация секреции. Бактерия должна знать, когда настало время выделять эффекторы. Ненужная секреция, когда поблизости нет клетки-хозяина, является расточительной для бактерии с точки зрения энергии и ресурсов. Бактерия каким-то образом способна распознавать контакт иглы с клеткой-хозяином. Как это делается, все ещё исследуется, и метод вполне может зависеть от патогена. В некоторых теориях постулируется деликатное конформационное изменение структуры иглы при контакте с клеткой-хозяином; это изменение, возможно, служит сигналом для основания, чтобы начать секрецию. Один из методов распознавания был обнаружен у сальмонелл, который основан на измерении цитозольного pH клетки-хозяина через T3SS, кодируемый островком патогенности 2, для включения секреции эффекторов[22].
- Связывание шаперонов. Неизвестно, когда шапероны связывают свои эффекторы (во время или после трансляции) и как они отделяются от своих эффекторов перед секрецией.
- Эффекторные механизмы. Хотя с начала XXI века было открыто много информации о том, как эффекторы T3SS манипулируют клеткой-хозяином, большинство опосредованных эффектов и путей остаются неизвестными.
- Эволюция. Как уже упоминалось, T3SS тесно связан с бактериальным жгутиком[23]. Существуют три конкурирующие гипотезы[24]: во-первых, что жгутик развился первым, а T3SS выведен из этой структуры, во-вторых, что T3SS развился первым, а жгутик выведен из него, и в-третьих, что две структуры сформировались из общего предка[25]. Был некоторый спор о различных сценариях[4][24], поскольку все они объясняют гомологию белка между двумя структурами, а также их функциональное разнообразие. Тем не менее, недавние филогеномные данные подтверждают гипотезу о том, что T3SS вырабатывается из жгутика процессом, включающим в себя первоначальную потерю генов и затем приобретение генов[26]. Ключевым этапом последнего процесса был набор секретинов в T3SS, событие, которое произошло, по крайней мере, три раза от других мембранно-связанных систем.
Номенклатура белков T3SS[править | править код]
С начала 1990-х новые белки T3SS обнаруживаются в различных бактериальных видах с постоянной скоростью. Аббревиатуры были даны независимо для каждой серии белков в каждом организме, и названия обычно не раскрывают многих функции белка. Позднее было показано, что некоторые белки, обнаруженные независимо в разных бактериях, являются гомологичными; исторические названия, однако, в основном сохранились, что может привести к путанице. Например, белки SicA, IpgC и SycD являются гомологами из Salmonella, Shigella и Yersinia соответственно, но последняя буква («серийный номер») в их названии не показывает на данное явление.
Ниже приводится краткое изложение наиболее распространённых названий белковых серий у нескольких видов, содержащих T3SS. Обратите внимание, что эти названия включают белки, которые формируют механизм T3SS, а также секретируемые эффекторные белки:
- Yersinia
- Yop: Yersinia outer protein (наружный белок иерсиний)
- Ysc: Yersinia secretion (component) (секретируемый компонент иерсиний)
- Ypk: Yersinia protein kinase (протеинкиназа иерсиний)
- Salmonella
- Spa: Surface presentation of antigen (поверхностная презентация антигена)
- Sic: Salmonella invasion chaperone (шаперон инвазии сальмонеллы)
- Sip: Salmonella invasion protein (инвазивный белок сальмонеллы)
- Prg: PhoP-repressed gene (ген фосфопротеиновой репресии)
- Inv: Invasion (инвазия, заражение)
- Org: Oxygen-regulated gene (ген, регулируемый кислородом, оксиген-регулируемый)
- Ssp: Salmonella-secreted protein (белок, секретируемый сальмонеллой)
- Iag: Invasion-associated gene (ген, ассоциированный с инвазией)
- Shigella
- Ipg: Invasion plasmid gene (ген инвазивной плазмиды)
- Ipa: Invasion plasmid antigen (антиген инвазивной плазмиды)
- Mxi: Membrane expression of Ipa (мембранная экспрессия гена инвазивной плазмиды)
- Spa: Surface presentation of antigen (поверхностная презентация антигена)
- Osp: Outer Shigella protein (наружный белок шигеллы)
- Escherichia
- Tir: Translocated intimin receptor (транслоцированный рецептор интимина)
- Sep: Secretion of E. coli proteins (секреция белков E.coli.)
- Esc: Escherichia secretion (component) (секретируемый компонент эшерихии)
- Esp: Escherichia secretion protein (секретируемый белок эшерихии)
- Ces: Chaperone of E. coli secretion (секретируемый шаперон эшерихии)
- Pseudomonas
- Hrp: Hypersensitive response and pathogenicity (гиперчувствительный ответ и патогенность)
- Hrc: Hypersensitive response conserved (or Hrp conserved) (сохранённый гиперчувствительный ответ (или сохранённый Hrp))
- Rhizobium
- Nop: Nodulation protein (белок нодуляции)
- Rhc: Rhizobium conserved
- В некоторых других видах
- Vir: Virulence (вирулентность)
После данных аббревиатур идёт буква или цифра. Буквами обычно обозначается «серийный номер», либо хронологический порядок обнаружения, либо физический порядок появления гена в опероне. Числа, более редкий случай, обозначают молекулярную массу белка в кДа. Примеры: IpaA, IpaB, IpaC; MxiH, MxiG, MxiM; Spa9, Spa47.
Несколько ключевых элементов появляются во всех T3SS: мономер иглы, внутренний стержень иглы, кольцевые белки, два транслокатора, белок кончика иглы, линейный белок (который, как считается, определяет длину иглы; см. Выше) и АТФаза, которая поставляет энергию для секреции. В следующей таблице приведены некоторые из этих ключевых белков в четырёх T3SS-содержащих бактериях:
| ↓ Функции / Род → | Shigella | Salmonella | Yersinia | Escherichia |
|---|---|---|---|---|
| Игольчатый мономер | MxiH | PrgI | YscF | EscF |
| Внутренний стержень | MxiI | PrgJ | YscI | EscI |
| Белок кончика иглы | IpaD | SipD | LcrV | EspA |
| Транслокатор | IpaB | SipB | YopB | EspD |
| Транслокатор | IpaC | SipC | YopD | EspB |
| Шаперон двух транслокаторов | IpgC | SicA | SycD | CesD |
| АТФаза | Spa47 | InvC | YscN | SepB (EscN) |
| Линейный белок | Spa32 | InvJ | YscP | Orf16 |
| Выключатель | Spa40 | SpaS | YscU | EscU |
| Привратник | MxiC | InvE | YopN (TyeA) | SepL |
Методы, используемые в исследовании T3SS[править | править код]
Выделение игольчатых комплексов T3SS[править | править код]
Выделение крупных, хрупких, гидрофобных мембранных структур из клеток представляло собой проблему на протяжении многих лет. Однако к концу 1990-х годов было разработано несколько подходов для выделения игольчатых комплексов (NC) T3SS. В 1998 году первые NC были выделены из Salmonella Typhimurium[27].
Изолированные бактерии выращивают в большом объёме жидкой питательной среды, пока они не достигнут лог-фазы. Затем они центрифугируются; супернатант (среду) декантируют, а осадок (бактерии) ресуспендируют в буфере для лизиса, обычно содержащий лизоцим и иногда детергенты, такие как LDAO или Triton X-100. Такой буфер разрушает клеточную стенку. После нескольких циклов лизиса и промывания открытые бактерии подвергаются серии ультрацентрифугирования. Данный подход увеличивает количество крупных макромолекулярных структур и отбрасывает мелкие клеточные компоненты. Дополнительно, конечный лизат подвергают дальнейшей очистке при помощи градиента плотности CsCl.
Дополнительный подход для дальнейшей очистки использует аффинную хроматографию. Рекомбинантные белки T3SS, которые несут белковую метку (например, гистидиновую метку), получают путём молекулярного клонирования и затем вводят (трансформируют) в исследуемые бактерии. После первоначального выделения NC, как описано выше, лизат пропускают через колонку, покрытую частицами с высокой аффиностью к метке (в случае гистидиновых меток: ионы никеля). Меченый белок сохраняется в колонке, а вместе с ней и весь игольчатый комплекс. Высокие степени чистоты могут быть достигнуты с помощью таких методов. Такая чистота необходима для многих деликатных анализов, которые были использованы для характеристик NC.
Эффекторы III типа были известны с начала 1990-х годов, но способ их доставки в клетки-хозяева был полной загадкой. Гомология между многими жгутиковыми белками и белками T3SS заставила исследователей заподозрить существование внешней структуры T3SS, похожей на жгутики. Выявление и последующее выделение структуры иглы позволило исследователям:
- детально охарактеризовать трёхмерную структуру NC и сделать из этого выводы о механизме секреции (например, узкая ширина иглы требует раскрытия укладки эффекторов перед секрецией),
- анализировать белковые компоненты NC, подвергая изолированные иглы протеомному анализу (см. ниже),
- обозначить роли различных компонентов NC, это путём выбивания генов T3SS, выделения NC из мутантных бактерий и изучения изменений, вызванных мутациями.
Микроскопия, кристаллография и твёрдотельная ЯМР спектроскопия[править | править код]
Как и для почти всех белков, визуализация T3SS NC возможна только с помощью электронной микроскопии. Первые изображения NC (1998) показывают структуры игл, выступающие из клеточной стенки живых бактерий и плоские, двумерные изолированные NC[27]. В 2001 году изображения NC Shigella flexneri были подвергнуты цифровому анализу и усреднены для получения первой полу-3D структуры NC[7]. В 2003 году была получена спиральная структура NC из Shigella flexneri с разрешением 16 ангстрем методом дифракции рентгеновских лучей в волокнах[28], а год спустя была опубликована 17-ангстремная трёхмерная структура NC Salmonella Typhimurium[29]. Последние достижения и подходы позволили получить 3D-изображения NC с высоким разрешением[30][31], они ещё больше проясняют сложную структуру NC.
За последние годы были кристаллизованы многочисленные белки T3SS. К ним относятся структурные белки NC, эффекторы и шапероны. Первой структурой мономера игольчатого комплекса стала ЯМР структура BsaL из «Burkholderia pseudomallei», а затем кристаллическая структура MixH из Shigella flexneri, которые были изучены в 2006 году[32][33].
В 2012 году сочетание рекомбинантного производства игольчатых комплексов дикого типа, твёрдотельной ЯМР спектроскопии, электронной микроскопии[34] и моделирования биополимеров Rosetta выявило супрамолекулярные границы раздела и, в конечном итоге, полную атомную структуру иглы T3SS Salmonella Typhimurium[35]. Было показано, что субъединицы PrgI, состоящие из 80 аминокислотных остатков образуют правосторонний спиральный узел с примерно 11 субъединицами, приходящимся на два оборота спирали, аналогично жгутику Salmonella Typhimurium. Модель также выявила расширенный аминоконцевой домен, который расположен на поверхности иглы, в то время как высококонсервативный карбокси-конец направлен в просвет[35].
Протеомика[править | править код]
Несколько методов были использованы для того, чтобы идентифицировать массив белков, составляющие T3SS. Изолированные игольчатые комплексы могут быть разделены с помощью гель-электрофорезом (SDS-PAGE). Полосы, которые появляются после окрашивания, могут быть индивидуально вырезаны из геля и проанализированы с использованием секвенирования белка и масс-спектрометрии. Структурные компоненты NC могут быть отделены друг от друга (например, игольчатая часть от базовой части), и путём анализа этих фракций можно определить белки, участвующие в каждой из них. Альтернативно, изолированные игольчатые комплексы могут быть непосредственно проанализированы с помощью масс-спектрометрии, без предварительного электрофореза, чтобы получить полную картину NC-протеом.
Ингибиторы T3SS[править | править код]
Было обнаружено несколько соединений, ингибирующих T3SS у грамотрицательных бактерий, включая гуадиномин, который естественным образом продуцируется видами Streptomyces[36]. Были разработаны моноклональные антитела, которые ингибируют и T3SS[37]. Ауродокс, антибиотик, способный ингибировать трансляцию белков T3SS, он способен предотвращать воздействия эффекторов T3SS in vitro и на моделях животных[38][39].
Литература[править | править код]
- Instant insight outlining the chemistry of the injectisome from the Royal Society of Chemistry
- Host-Pathogen Interaction in Pseudomonas syringae pv. tomato and tomato plant leading to bacterial speck disease.
Примечания[править | править код]
- ↑ Шаблон:TCDB2
- ↑ A. Blocker, N. Jouihri u. a.: Structure and composition of the Shigella flexneri "needle complex", a part of its type III secreton. In: Molecular microbiology. Band 39, Nummer 3, Februar 2001, S. 652–663, ISSN 0950-382X, PMID 11169106.
- ↑ Salmond G. P., Reeves P. J. Membrane traffic wardens and protein secretion in Gram-negative bacteria (англ.) // Trends in Biochemical Sciences : journal. — Cell Press, 1993. — Vol. 18, no. 1. — P. 7—12. — doi:10.1016/0968-0004(93)90080-7. — PMID 8438237.
- ↑ 1 2 Gophna U., Ron E. Z., Graur D. Bacterial type III secretion systems are ancient and evolved by multiple horizontal-transfer events (англ.) // Gene : journal. — Elsevier, 2003. — July (vol. 312). — P. 151—163. — doi:10.1016/S0378-1119(03)00612-7. — PMID 12909351.
- ↑ Nguyen L., Paulsen I. T., Tchieu J., Hueck C. J., Saier M. H. Phylogenetic analyses of the constituents of Type III protein secretion systems (англ.) // Journal of Molecular Microbiology and Biotechnology : journal. — 2000. — April (vol. 2, no. 2). — P. 125—144. — PMID 10939240.
- ↑ Gong H., Vu G. P., Bai Y., Yang E., Liu F., Lu S. Differential expression of Salmonella type III secretion system factors InvJ, PrgJ, SipC, SipD, SopA and SopB in cultures and in mice (англ.) // Microbiology : journal. — 2010. — January (vol. 156, no. Pt 1). — P. 116—127. — doi:10.1099/mic.0.032318-0. — PMID 19762438. — PMC 2889428.
- ↑ 1 2 Blocker A., Jouihri N., Larquet E., Gounon P., Ebel F., Parsot C., Sansonetti P., Allaoui A. Structure and composition of the Shigella flexneri 'needle complex', a part of its type III secreton (англ.) // Microbiology : journal. — Microbiology Society, 2001. — Vol. 39, no. 3. — P. 652—663. — doi:10.1046/j.1365-2958.2001.02200.x. — PMID 11169106.
- ↑ Galan J. E., Wolf-Watz H. Protein delivery into eukaryotic cells by type III secretion machines (англ.) // Nature : journal. — 2006. — Vol. 444, no. 7119. — P. 567—573. — doi:10.1038/nature05272. — . — PMID 17136086.
- ↑ Pallen M. J.; Bailey C. M.; Beatson S. A. Evolutionary links between Flih/Yscl-like proteins from bacterial type iii secretion systems and second-stalk components of the FoF1 and vacuolar ATPases (англ.) // Protein Science : journal. — 2006. — Vol. 15, no. 4. — P. 935—940. — doi:10.1110/ps.051958806. — PMID 16522800. — PMC 2242474.
- ↑ Aizawa S. Bacterial flagella and type iii secretion systems (англ.) // FEMS Microbiology Letters : journal. — 2001. — Vol. 202, no. 2. — P. 157—164. — doi:10.1111/j.1574-6968.2001.tb10797.x. — PMID 11520608.
- ↑ Doolittle W. F.; Zhaxybayeva, Olga. Evolution: Reducible complexity - the case for bacterial flagella (англ.) // Current Biology : journal. — Cell Press, 2007. — Vol. 17, no. 13. — P. R510—512. — doi:10.1016/j.cub.2007.05.003. — PMID 17610831.
- ↑ Akeda Y., Galán J. E. Chaperone release and unfolding of substrates in type III secretion (англ.) // Nature : journal. — 2005. — October (vol. 437, no. 7060). — P. 911—915. — doi:10.1038/nature03992. — . — PMID 16208377.
- ↑ Kimbrough T. G.; Miller S. I. Contribution of Salmonella typhimurium type iii secretion components to needle complex formation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2000. — Vol. 97, no. 20. — P. 11008—11013. — doi:10.1073/pnas.200209497. — . — PMID 10984518. — PMC 27139.
- ↑ YashRoy R.C. Eucaryotic cell intoxication by gram-negative pathogens: A novel bacterial outermembrane-bound nanovesicular exocytosis model for Type III secretion system (англ.) // Toxicology International : journal. — 2003. — Vol. 10, no. 1. — P. 1—9.
- ↑ Zychlinsky A., Kenny B., Menard R., Prevost M. C., Holland I. B., Sansonetti P. J. IpaB mediates macrophage apoptosis induced by Shigella flexneri (англ.) // Microbiology : journal. — Microbiology Society, 1994. — Vol. 11, no. 4. — P. 619—627. — doi:10.1111/j.1365-2958.1994.tb00341.x. — PMID 8196540.
- ↑ Hilbi H., Moss J. E., Hersh D., Chen Y., Arondel J., Banerjee S., Flavell R. A., Yuan J., Sansonetti P. J., Zychlinsky A. Shigella-induced Apoptosis Is Dependent on Caspase-1 Which Binds to IpaB (англ.) // J Biol Chem : journal. — 1998. — Vol. 273, no. 49. — P. 32895—32900. — doi:10.1074/jbc.273.49.32895. — PMID 9830039.
- ↑ Boch, J.; Bonas, U. XanthomonasAvrBs3 Family-Type III Effectors: Discovery and Function (англ.) // Annual Review of Phytopathology : journal. — 2010. — Vol. 48. — P. 419—436. — doi:10.1146/annurev-phyto-080508-081936. — PMID 19400638.
- ↑ Moscou, M. J.; Bogdanove, A. J. A Simple Cipher Governs DNA Recognition by TAL Effectors (англ.) // Science : journal. — 2009. — Vol. 326, no. 5959. — P. 1501. — doi:10.1126/science.1178817. — . — PMID 19933106.
- ↑ Boch J., Scholze H., Schornack S., etal. Breaking the code of DNA binding specificity of TAL-type III effectors (англ.) // Science : journal. — 2009. — December (vol. 326, no. 5959). — P. 1509—1512. — doi:10.1126/science.1178811. — . — PMID 19933107.
- ↑ Schraidt, O.; Lefebre, M. D.; Brunner, M. J.; Schmied, W. H.; Schmidt, A.; Radics, J.; Mechtler, K.; Galán, J. E.; Marlovits, T. C. Topology and Organization of the Salmonella typhimurium Type III Secretion Needle Complex Components (англ.) // PLoS Pathogens : journal / Stebbins, C. Erec. — 2010. — Vol. 6, no. 4. — P. e1000824. — doi:10.1371/journal.ppat.1000824. — PMID 20368966. — PMC 2848554.
- ↑ Grynberg M., Godzik A. The signal for signaling, found (англ.) // PLoS Pathog. : journal / Stebbins, C. Erec. — 2009. — April (vol. 5, no. 4). — P. e1000398. — doi:10.1371/journal.ppat.1000398. — PMID 19390616. — PMC 2668190.
- ↑ Yu X. J., etal. pH sensing by intracellular Salmonella induces effector translocation (англ.) // Science : journal. — 2010. — May (vol. 328, no. 5981). — P. 1040—1043. — doi:10.1126/science.1189000. — . — PMID 20395475. — PMC 6485629.
- ↑ Medini D., Covacci A., Donati C. Protein homology network families reveal step-wise diversification of Type III and Type IV secretion systems (англ.) // PLoS Comput. Biol. : journal. — 2006. — December (vol. 2, no. 12). — P. e173. — doi:10.1371/journal.pcbi.0020173. — . — PMID 17140285. — PMC 1676029.
- ↑ 1 2 Saier, M. Evolution of bacterial type III protein secretion systems (англ.) // Trends in Microbiology : journal. — Cell Press, 2004. — Vol. 12, no. 3. — P. 113—115. — doi:10.1016/j.tim.2004.01.003. — PMID 15001186.
- ↑ McCann H. C., Guttman D. S. Evolution of the type III secretion system and its effectors in plant-microbe interactions (англ.) // New Phytol. : journal. — 2008. — Vol. 177, no. 1. — P. 33—47. — doi:10.1111/j.1469-8137.2007.02293.x. — PMID 18078471.
- ↑ Abby, Sophie S.; Rocha, Eduardo P. C. The non-flagellar type III secretion system evolved from the bacterial flagellum and diversified into host-cell adapted systems (англ.) // PLOS Genetics : journal. — 2012. — 1 September (vol. 8, no. 9). — P. e1002983. — ISSN 1553-7404. — doi:10.1371/journal.pgen.1002983. — PMID 23028376. — PMC 3459982.
- ↑ 1 2 Kubori T., Matsushima Y., Nakamura D., Uralil J., Lara-Tejero M., Sukhan A., Galán J. E., Aizawa S. I. Supramolecular structure of the Salmonella typhimurium type III protein secretion system (англ.) // Science : journal. — 1998. — April (vol. 280, no. 5363). — P. 602—605. — doi:10.1126/science.280.5363.602. — . — PMID 9554854.
- ↑ Cordes F. S., Komoriya K., Larquet E., Yang S., Egelman E. H., Blocker A., Lea S. M. Helical structure of the needle of the type III secretion system of Shigella flexneri (англ.) // J Biol Chem : journal. — 2003. — Vol. 278, no. 19. — P. 17103—17107. — doi:10.1074/jbc.M300091200. — PMID 12571230.
- ↑ Marlovits T. C., Kubori T., Sukhan A., Thomas D. R., Galán J. E., Unger V. M. Structural insights into the assembly of the type III secretion needle complex (англ.) // Science : journal. — 2004. — Vol. 306, no. 5698. — P. 1040—1042. — doi:10.1126/science.1102610. — . — PMID 15528446. — PMC 1459965.
- ↑ Sani M., Allaoui A., Fusetti F., Oostergetel G. T., Keegstra W., Boekema E. J. Structural organization of the needle complex of the type III secretion apparatus of Shigella flexneri (англ.) // Micron : journal. — 2007. — Vol. 38, no. 3. — P. 291—301. — doi:10.1016/j.micron.2006.04.007. — PMID 16920362. Архивировано 18 октября 2019 года.
- ↑ Hodgkinson J. L., Horsley A., Stabat D., Simon M., Johnson S., da Fonseca P. C., Morris E. P., Wall J. S., Lea S. M., Blocker A. J. Three-dimensional reconstruction of the Shigella T3SS transmembrane regions reveals 12-fold symmetry and novel features throughout (англ.) // Nat Struct Mol Biol : journal. — 2009. — Vol. 16, no. 5. — P. 477—485. — doi:10.1038/nsmb.1599. — PMID 19396171. — PMC 2681179.
- ↑ Zhang, L; Wang, Y; Picking, WL; Picking, WD; De Guzman, R. N. Solution structure of monomeric BsaL, the type III secretion needle protein of Burkholderia pseudomallei. (англ.) // Journal of Molecular Biology : journal. — 2006. — 2 June (vol. 359, no. 2). — P. 322—330. — doi:10.1016/j.jmb.2006.03.028. — PMID 16631790.
- ↑ Deane J. E., Roversi P., Cordes F. S., Johnson S., Kenjale R., Daniell S., Booy F., Picking W. D., Picking W. L., Blocker A. J., Lea S. M. Molecular model of a type III secretion system needle: Implications for host-cell sensing (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2006. — Vol. 103, no. 33. — P. 12529—12533. — doi:10.1073/pnas.0602689103. — . — PMID 16888041. — PMC 1567912.
- ↑ Galkin VE; Schmied WH; Schraidt O; Marlovits TC and Egelman. The structure of the Salmonella typhimurium type III secretion system needle shows divergence from the flagellar system (англ.) // J Mol Biol : journal. — 2010. — Vol. 396, no. 5. — P. 1392—1397. — doi:10.1016/j.jmb.2010.01.001. — PMID 20060835. — PMC 2823972.
- ↑ 1 2 Loquet A., Sgourakis N. G., Gupta R., Giller K., Riedel D., Goosmann C., Griesinger C., Kolbe M., Baker D., Becker S., Lange A. Atomic model of the type III secretion system needle (англ.) // Nature : journal. — 2012. — Vol. 486, no. 7402. — P. 276—279. — doi:10.1038/nature11079. — . — PMID 22699623. — PMC 3598588.
- ↑ Holmes, T. C.; May, A. E.; Zaleta-Rivera, K.; Ruby, J. G.; Skewes-Cox, P.; Fischbach, M. A.; Derisi, J. L.; Iwatsuki, M.; Ōmura, S.; Khosla, C. Molecular Insights into the Biosynthesis of Guadinomine: A Type III Secretion System Inhibitor (англ.) // Journal of the American Chemical Society : journal. — 2012. — Vol. 134, no. 42. — P. 17797—17806. — doi:10.1021/ja308622d. — PMID 23030602. — PMC 3483642.
- ↑ Theuretzbacher U, Piddock LJ (July 2019). "Non-traditional Antibacterial Therapeutic Options and Challenges". Cell Host & Microbe. 26 (1): 61—72. doi:10.1016/j.chom.2019.06.004. PMID 31295426.
- ↑ Pylkkö T, Ilina P, Tammela P (May 2021). "Development and validation of a high-content screening assay for inhibitors of enteropathogenic E. coli adhesion". Journal of Microbiological Methods. 184: 106201. doi:10.1016/j.mimet.2021.106201. PMID 33713725.
- ↑ Kimura K, Iwatsuki M, Nagai T, Matsumoto A, Takahashi Y, Shiomi K, et al. (February 2011). "A small-molecule inhibitor of the bacterial type III secretion system protects against in vivo infection with Citrobacter rodentium". The Journal of Antibiotics. 64 (2): 197—203. doi:10.1038/ja.2010.155. PMID 21139624.