1,4-Нафтохинон
1,4-Нафтохинон
| |
|---|---|
Общие
| |
| Систематическое наименование | нафталин-1,4-дион
|
| Хим. формула | C₁₀H₆O₂ |
| Рац. формула | C10H6O2 |
Физические свойства
| |
| Молярная масса | 158,153 г/моль |
| Плотность | 1,42 г/см³ |
Термические свойства
| |
| Т. плав. | 128 ℃ |
| Т. субл. | <100 ℃ |
| Т. всп. | 142 ℃ |
Химические свойства
| |
| Растворимость в воде | 0,35 г/100 мл |
Классификация
| |
| Номер CAS | 130-15-4 |
| PubChem | 8530 |
| ChemSpider | 8215 |
| Номер EINECS | 204-977-6 |
| ChEBI | 27418 |
C1=CC=C2C(=O)C=CC(=O)C2=C1
| |
InChI=1S/C10H6O2/c11-9-5-6-10(12)8-4-2-1-3-7(8)9/h1-6H
| |
Безопасность
| |
| ПДК | 0,1 мг/м3 |
| ЛД50 | 190 мг/кг (крысы, перорально) |
| R-фразы | R24/25, R26, R36/37/38, R43, R50 |
| S-фразы | S26, S28, S36/37, S45, S61 |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
1,4-Нафтохинон — производное нафталина, хинон.
Физические свойства[править | править код]
Жёлтые триклинные кристаллы с резким запахом похожим на запах бензохинона. Плохо растворим в воде, слегка растворим в петролейном эфире, хорошо растворим в полярных органических растворителях. В щелочной среде даёт красно-коричневое окрашивание. Молекула планарна.
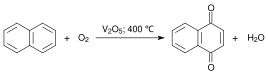
Получение[править | править код]
Газофазное окисление нафталина с использованием оксида ванадия в качестве катализатора[1]. При этом основным продуктом реакции является фталевый ангидрид.
Окисление нафталина оксидом хрома (VI) в уксусной кислоте[2].
Химические свойства[править | править код]
1,4-нафтохинон ведёт себя как сильный диенофил в реакции Дильса — Альдера. Так он реагирует с 1,3-бутадиеном. Реакцию проводят либо с избытком сжиженного 1,3-бутадиена при комнатной температуре в течение 45 дней, либо в присутствии одного эквивалента хлорида олова (IV) в качестве катализатора при −50 °С.
1,4-нафтохинон ведёт себя как окислитель, востанавливаясь до 1,4-гидрохинона. Даёт оксим. Ведёт себя как лиганд, благодаря наличию электрофильной связи (C=C).[3]
В уксусной кислоте, при катализе I2, присоединяет хлор или бром, образуя 2,3-дигалоген-1,4-нафтохинон. В щелочном растворе окисляется H2O2 до 2-гидрокси-1,4-нафтохинона.
Применение[править | править код]
Используется для синтеза антрахинона, по реакции с 1,3-бутадиеном и последующим окислением, и различных красителей, в том числе через нитрование до 5-нитро-1,4-нафтохинона. Ингибитор коррозии. Используется в качестве катализатора при производстве синтетического каучука и полиакрилатов.[4]
См. также[править | править код]
Примечания[править | править код]
- ↑ Чекалин М. А., Пассет Б. В., Иоффе Б. А. Технология красителей и промежуточных продуктов: Учебное пособие для техникумов. — 2-е изд, перераб. — Л.: Химия, 1980. — С. 210.
- ↑ З. Гауптман, Ю. Грефе, Х. Ремане. Органическая химия / Пер. с нем. П. Б. Терентьева, С. С. Чуранова, под ред. В. М. Потапова. — М.: Химия, 1979. — С. 278.
- ↑ Kündig, E. P.; Lomberget, T.; Bragg, R.; Poulard, C.; Bernardinelli, G. Desymmetrization of a meso-Diol Complex Derived from [Cr(CO)3(η6-5,8-Naphthoquinone)]: Use of New Diamine Acylation Catalysts (англ.) // Chemical Communications : journal. — 2004. — Vol. 2004, no. 13. — P. 1548—1549. — doi:10.1039/b404006f.
- ↑ И.Л. Кнунянц. Химическая энциклопедия. — М.: Большая российская энциклопедия, 1992. — Т. 3. — С. 198-199.