FANTOM: различия между версиями
| [отпатрулированная версия] | [непроверенная версия] |
Eva Tern (обсуждение | вклад) Нет описания правки Метка: визуальный редактор отключён |
|||
| Строка 21: | Строка 21: | ||
==== Трегалозный метод синтеза полноразмерных кДНК ==== |
==== Трегалозный метод синтеза полноразмерных кДНК ==== |
||
Раньше одной из самых больших трудностей получения полноразмерных [[Комплементарная ДНК|кДНК]] являлась неэффективность работы [[Ревертаза|ревертазы]] при синтезе второй цепи. Было показано, что добавление [[Трегалоза|трегалозы]] значительно увеличивает термостабильность и активность [[Ферменты|фермента]]<ref>{{Статья|автор = |заглавие = Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA|издание = Proc Natl Acad Sci U S A|тип = |год = 1998|номер = 95|страницы = |issn = |doi = 10.1073/pnas.95.2.520}}</ref>. Это открытие позволило проводить [[Обратная транскриптаза|ревертазные]] реакции при 60 °C вместо 42°С, как раньше. При температуре 60 °C [[вторичная структура]] [[Рибонуклеиновая кислота|РНК]] из образца подплавляется и участок на 5'-конце [[Матричная РНК|мРНК]] становится доступным для [[Транскрипция (биология)|транскрипции]]. |
Раньше одной из самых больших трудностей получения полноразмерных [[Комплементарная ДНК|кДНК]] являлась неэффективность работы [[Ревертаза|ревертазы]] при синтезе второй цепи. Было показано, что добавление [[Трегалоза|трегалозы]] значительно увеличивает термостабильность и активность [[Ферменты|фермента]]<ref>{{Статья|автор = |заглавие = Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA|издание = Proc Natl Acad Sci U S A|тип = |год = 1998|номер = 95|страницы = |issn = |doi = 10.1073/pnas.95.2.520}}</ref>. Это открытие позволило проводить [[Обратная транскриптаза|ревертазные]] реакции при 60 °C вместо 42°С, как раньше. При температуре 60 °C [[вторичная структура]] [[Рибонуклеиновая кислота|РНК]] из образца подплавляется и участок на 5'-конце [[Матричная РНК|мРНК]] становится доступным для [[Транскрипция (биология)|транскрипции]]<ref>{{Статья|ссылка=https://www.pnas.org/content/95/2/520|автор=Piero Carninci, Yoko Nishiyama, Arthur Westover, Masayoshi Itoh, Sumiharu Nagaoka|заглавие=Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA|год=1998-01-20|язык=en|издание=Proceedings of the National Academy of Sciences|том=95|выпуск=2|страницы=520–524|issn=0027-8424, 1091-6490|doi=10.1073/pnas.95.2.520}}</ref>. |
||
==== Метод биотинилированной кэп-ловушки для отсеивания неполноразмерных кДНК ==== |
==== Метод биотинилированной кэп-ловушки для отсеивания неполноразмерных кДНК ==== |
||
| Строка 33: | Строка 33: | ||
=== FANTOM2 === |
=== FANTOM2 === |
||
После первого съезда [[консорциум]]а FANTOM, группа из RIKEN продолжила создание [[Мышиные|мышиных]] полноразмерных [[Комплементарная ДНК|кДНК]]. В ходе второй фазы были определены последовательности и созданы функциональные аннотации для этого набора из 60,770 полноразмерных [[кДНК]] [[Мышиные|мыши]]. Это стало первым всемирным проектом по стандартизации полноразмерных [[кДНК]] [[Млекопитающие|млекопитающих]]. |
После первого съезда [[консорциум]]а FANTOM, группа из RIKEN продолжила создание [[Мышиные|мышиных]] полноразмерных [[Комплементарная ДНК|кДНК]]. В ходе второй фазы были определены последовательности и созданы функциональные аннотации для этого набора из 60,770 полноразмерных [[кДНК]] [[Мышиные|мыши]]. Это стало первым всемирным проектом по стандартизации полноразмерных [[кДНК]] [[Млекопитающие|млекопитающих]]<ref>{{Cite web|url=https://fantom.gsc.riken.jp/2/fantom2/doc/history.html|title=FANTOM|publisher=fantom.gsc.riken.jp|accessdate=2020-05-11}}</ref>. |
||
Проект ''FANTOM2''<ref>{{cite web |url=https://fantom.gsc.riken.jp/2/|title=FANTOM2}}</ref> состоял из трёх частей: |
Проект ''FANTOM2''<ref>{{cite web |url=https://fantom.gsc.riken.jp/2/|title=FANTOM2}}</ref> состоял из трёх частей: |
||
| Строка 49: | Строка 49: | ||
=== FANTOM3 === |
=== FANTOM3 === |
||
Аналогично двум другим этапам были проведены встречи до начала работы (Tanabata Meeting: 04.07 — 08.07.2004, RIKEN, GSC, Japan) и после окончания работы проекта (Harvest Meeting: 10.09 — 15.09.2004, RIKEN, Japan). |
Аналогично двум другим этапам были проведены встречи до начала работы (Tanabata Meeting: 04.07 — 08.07.2004, RIKEN, GSC, Japan) и после окончания работы проекта (Harvest Meeting: 10.09 — 15.09.2004, RIKEN, Japan)<ref>{{Cite web|url=http://fantom3.gsc.riken.jp/history.html|title=FANTOM3::History|publisher=fantom3.gsc.riken.jp|accessdate=2020-05-11}}</ref>. |
||
В FANTOM3<ref>{{Cite web|url=http://fantom3.gsc.riken.jp|title=FANTOM3}}</ref> для получения данных, которые раскрывают динамическое регулирование [[транскриптом]]а, была изменена стратегия аннотации<ref>{{Cite web|url=https://fantom.gsc.riken.jp/3/doc/annotation.html|title=Стратегия аннотации FANTOM3}}</ref>. В частности, были подготовлены новые датасеты для: |
В FANTOM3<ref>{{Cite web|url=http://fantom3.gsc.riken.jp|title=FANTOM3}}</ref> для получения данных, которые раскрывают динамическое регулирование [[транскриптом]]а, была изменена стратегия аннотации<ref>{{Cite web|url=https://fantom.gsc.riken.jp/3/doc/annotation.html|title=Стратегия аннотации FANTOM3}}</ref>. В частности, были подготовлены новые датасеты для: |
||
| Строка 64: | Строка 64: | ||
==== Технология CAGE ==== |
==== Технология CAGE ==== |
||
Технология ''[[Кэп-анализ экспрессии генов|CAGE]]'' позволяет проводить высокопроизводительный анализ [[Экспрессия генов|экспрессии генов]], получать профили транскрипционных сайтов |
Технология ''[[Кэп-анализ экспрессии генов|CAGE]]'' позволяет проводить высокопроизводительный анализ [[Экспрессия генов|экспрессии генов]], получать профили транскрипционных сайтов<ref>{{Cite web|url=https://fantom.gsc.riken.jp/3/history.html|title=FANTOM3::History|publisher=fantom.gsc.riken.jp|accessdate=2020-04-09}}</ref>. |
||
Применение новой технологии ''[[Кэп-анализ экспрессии генов (CAGE)|CAGE]]'' показало, что более чем 63 % генома (а не как раньше считалось ~1,5 % белок-кодирующих экзонов) транскрибируется с образованием [[Рибонуклеиновая кислота|РНК]]. Также было обнаружено более 23,000 [[Некодирующие РНК|некодирующих РНК]] (''non-coding RNAs, ncRNAs'') и что >73 % [[Транскрипт (биология)|транскриптов]] способны к смысловой и антисмысловой [[Транскрипция (биология)|транскрипции]]. |
Применение новой технологии ''[[Кэп-анализ экспрессии генов (CAGE)|CAGE]]'' показало, что более чем 63 % генома (а не как раньше считалось ~1,5 % белок-кодирующих экзонов) транскрибируется с образованием [[Рибонуклеиновая кислота|РНК]]. Также было обнаружено более 23,000 [[Некодирующие РНК|некодирующих РНК]] (''non-coding RNAs, ncRNAs'') и что >73 % [[Транскрипт (биология)|транскриптов]] способны к смысловой и антисмысловой [[Транскрипция (биология)|транскрипции]]. Также был начат анализ [[Комплементарная ДНК|кДНК]] и профилей [[Экспрессия генов|экспрессии генов]] человека<ref>{{Статья|автор = |заглавие = Antisense transcription in the mammalian transcriptome|издание = Science|тип = |год = 2005|номер = 309|страницы = |issn = |doi = 10.1126/science.1112009}}</ref><ref>{{Статья|автор = |заглавие = The transcriptional landscape of the mammalian genome|издание = Science|тип = |год = 2005|номер = 309|страницы = |issn = |doi = 10.1126/science.1112014}}</ref>. |
||
Публикации по работе данного этапа можно найти в специальном выпуске журнала ''Science «RNA special issue»''<ref>{{Статья|автор = |заглавие = The transcriptional landscape of the mammalian genome|издание = Science|тип = |год = 2005|номер = 309|страницы = |issn = |doi = 10.1126/science.1112014}}</ref><ref>{{Статья|автор = |заглавие = Antisense transcription in the mammalian transcriptome|издание = Science|тип = |год = 2005|номер = 309|страницы = |issn = |doi = 10.1126/science.1112009}}</ref> |
|||
Также был начат анализ [[Комплементарная ДНК|кДНК]] и профилей [[Экспрессия генов|экспрессии генов]] человека. |
|||
=== FANTOM4 === |
=== FANTOM4 === |
||
Для работы четвёртой фазы проекта динамические паттерны [[Экспрессия генов|экспрессии генов]] [[Матричная РНК|мРНК]], [[микроРНК]] и активности [[промотор]]ов были измерены для дифференцирующихся клеток [[Острый миелоидный лейкоз|миелоидной лейкемии]] человека — клеточной линии [[:en:THP-1 cell line|THP-1]]. |
Для работы четвёртой фазы проекта динамические паттерны [[Экспрессия генов|экспрессии генов]] [[Матричная РНК|мРНК]], [[микроРНК]] и активности [[промотор]]ов были измерены для дифференцирующихся клеток [[Острый миелоидный лейкоз|миелоидной лейкемии]] человека — клеточной линии [[:en:THP-1 cell line|THP-1]]<ref>{{Статья|ссылка=https://doi.org/10.1186/gb-2010-11-s1-o11|автор=Harukazu Suzuki, Piero Carninci, Carsten Daub, Jun Kawai, Yoshihide Hayashizaki|заглавие=Beyond the FANTOM4|год=2010-10-11|издание=Genome Biology|том=11|выпуск=1|страницы=O11|issn=1474-760X|doi=10.1186/gb-2010-11-s1-o11}}</ref>. |
||
Во время работы этого этапа для мониторинга динамики использования точек инициации транскрипции ([[wikiversity:Transcription start sites|TSS]]) в ходе клеточной дифференциации использовалась технология deepCAGE<ref>{{Cite web|url=http://fantom.gsc.riken.jp/protocols/deep.html|title=deepCAGE}}</ref>. Для построения модели транскрипционной регуляторной сети были использованы предсказанные сайты связывания [[Факторы транскрипции|транскрипционных факторов]] и данные об уровнях [[Экспрессия генов|экспресии]] [[промотор]]ов<ref>{{Статья|автор = |заглавие = The transcriptional network that controls growth arrest and differentiation in a human myeloid leukemia cell line|издание = Nature Genetics|тип = |год = 2009|номер = 41|страницы = |issn = |doi = 10.1038/ng.375}}</ref>. Благодаря этому стало возможным предсказывать регуляторные границы (EDGES) между [[Факторы транскрипции|транскрипционным фактором]] и целевым [[промотор]]ом, делать выводы о регуляции [[Транскрипция (биология)|транскрипции]] с исследуемого [[промотор]]а определённым [[Факторы транскрипции|транскрипционным фактором]]. На основе этих данных была разработана EDGE EXPRESS DB<ref>{{Cite web|url=http://fantom.gsc.riken.jp/4/edgeexpress/about/|title=EDGE EXPRESS DB}}</ref>, в которой можно найти регуляционные сети одного или нескольких интересующих [[ген]]ов. |
Во время работы этого этапа для мониторинга динамики использования точек инициации транскрипции ([[wikiversity:Transcription start sites|TSS]]) в ходе клеточной дифференциации использовалась технология deepCAGE<ref>{{Cite web|url=http://fantom.gsc.riken.jp/protocols/deep.html|title=deepCAGE}}</ref>. Для построения модели транскрипционной регуляторной сети были использованы предсказанные сайты связывания [[Факторы транскрипции|транскрипционных факторов]] и данные об уровнях [[Экспрессия генов|экспресии]] [[промотор]]ов<ref>{{Статья|автор = |заглавие = The transcriptional network that controls growth arrest and differentiation in a human myeloid leukemia cell line|издание = Nature Genetics|тип = |год = 2009|номер = 41|страницы = |issn = |doi = 10.1038/ng.375}}</ref>. Благодаря этому стало возможным предсказывать регуляторные границы (EDGES) между [[Факторы транскрипции|транскрипционным фактором]] и целевым [[промотор]]ом, делать выводы о регуляции [[Транскрипция (биология)|транскрипции]] с исследуемого [[промотор]]а определённым [[Факторы транскрипции|транскрипционным фактором]]. На основе этих данных была разработана EDGE EXPRESS DB<ref>{{Cite web|url=http://fantom.gsc.riken.jp/4/edgeexpress/about/|title=EDGE EXPRESS DB}}</ref>, в которой можно найти регуляционные сети одного или нескольких интересующих [[ген]]ов. |
||
Версия от 11:07, 11 мая 2020
FANTOM (англ. FANTOM — Functional Annotation of the Mammalian Genome, русс. ФАНТОМ — Функциональная Аннотация геномов Млекопитающих) — международный исследовательский консорциум, основанный доктором Хаяшизаки[1] и его коллегами в 2000 году с целью функционального аннотирования полноразмерных кДНК, которые были собраны в ходе проекта Mouse Encyclopedia[2] в научном центре RIKEN. С тех пор FANTOM стал самостоятельным и развитым проектом, который затрагивает разные сферы анализа траскриптомов. Цель проекта — прийти от понимания «элементов» — транскриптов до понимания «системы» — транскрипционной регуляторной сети.[3]
Этапы работы проекта: история и публикации
FANTOM1

The RIKEN Mouse Gene Encyclopaedia Project[1] — проект, методы которого позволяют определить полный потенциал кодирующего генома мыши. В ходе данного проекта была получена коллекция последовательностей полноразмерных кДНК с последующим картированием соответствующих генов на геноме мыши. Следствием этого проекта стало основание ассоциации FANTOM с целью аннотирования первых 21,076 кДНК. Эта коллекция кДНК стала одной из крупнейших для какого-либо организма на тот момент. Анализ этих кДНК расширил уже существующие семейства генов и определил новые [4].
В ходе первого этапа работы консорциума была разработана эффективная система функциональной аннотации генов, основанная на разработанных de novo правилах и методах. Основные результаты были опубликованы в журнале Nature в 2001 году[5].
Технология получения полноразмерных кДНК
Общий вид последовательных стадий можно представить следующим образом[6]:
- Экстракция РНК из клеток
- Синтез полноразмерных кДНК
- Селекция полноразмерных кДНК
- Нормировка
- Клонирование
- Секвенирование
- Компьютерный анализ
Трегалозный метод синтеза полноразмерных кДНК
Раньше одной из самых больших трудностей получения полноразмерных кДНК являлась неэффективность работы ревертазы при синтезе второй цепи. Было показано, что добавление трегалозы значительно увеличивает термостабильность и активность фермента[7]. Это открытие позволило проводить ревертазные реакции при 60 °C вместо 42°С, как раньше. При температуре 60 °C вторичная структура РНК из образца подплавляется и участок на 5'-конце мРНК становится доступным для транскрипции[8].
Метод биотинилированной кэп-ловушки для отсеивания неполноразмерных кДНК
Метод разработан для селекции только полноразмерных кДНК. Сначала кэп, который есть на 5'-конце всех эукариотических мРНК биотинилируется. Затем происходит обратная транскрипция, и оцРНК подвергается деградации. Если траскрипция кДНК прервалась, то после расщепления одноцепочечных участков биотин на их 5'-конце будет отсутствовать. Оставшиеся полноразмерные кДНК с биотинилированным кэпом «вылавливаются» стрептавидиновыми бусинами. Затем в щелочной среде цепи ДНК элюируются и производится достраивание второй цепи ДНК[9][10].
Вектор для клонирования
Проблема того, что короткие мРНК более вероятно будут иметь больше клонов, чем более длинные, была решена разработкой нового вектора, подходящего для клонирования кДНК размером 6 кб ~ 20 кб, — λFlcIII-L. Этот вектор был усовершенствован (фоновое лигирование снижено практически до нуля) и назван λFlcIV. Именно он использовался для клонирования[11].
Нормировка
Так как 50 ~ 60 % всей РНК клетки соответствуют генам «домашнего хозяйства», то для оценки относительно низкого уровня РНК необходимо нормализовать библиотеки частоты встречаемости конкретных кДНК[12].
FANTOM2
После первого съезда консорциума FANTOM, группа из RIKEN продолжила создание мышиных полноразмерных кДНК. В ходе второй фазы были определены последовательности и созданы функциональные аннотации для этого набора из 60,770 полноразмерных кДНК мыши. Это стало первым всемирным проектом по стандартизации полноразмерных кДНК млекопитающих[13].
Проект FANTOM2[14] состоял из трёх частей:
«Typhoon» собрание (коллективное обсуждение развития новых концепций аннотирования)
Собрание было проведено 15-19 октября 2001 года. Обсуждались стратегии и правила аннотации для более эффективного аннотирования с использованием информации о профилях экспрессии, картирования и данных о белок-белковых взаимодействиях, а также традиционного выравнивания последовательностей. Также обсуждалась организация MATRICS — онлайн аннотация последовательностей RIKEN (Mouse Annotation Teleconference for RIKEN cDNA sequences). В качестве тестовой выборки для встречи «Typhoon» FANTOM2 были подготовлены и проанализированы 46,000 последовательностей[15].
MATRICS (Mouse Annotation Teleconference for RIken CDNA Sequences)
MATRICS (Mouse Annotation Teleconference for RIken CDNA Sequences) — телеконференция, в ходе которой кураторы аннотировали последовательности кДНК из RIKEN через интернет, используя систему защищённых серверов и систему FANTOM. Система FANTOM предумастривает использование большого количества онлайн ресурсов[16] .
«Cherry Blossom» собрание
После MATRICS была проведена встреча (29.04 — 04.05.2002) для доклада и обсуждения результатов функциональных аннотаций и биологически интересных находок.[17]
По результатам была опубликована статья в журнале Nature в 2002 году[18].
FANTOM3
Аналогично двум другим этапам были проведены встречи до начала работы (Tanabata Meeting: 04.07 — 08.07.2004, RIKEN, GSC, Japan) и после окончания работы проекта (Harvest Meeting: 10.09 — 15.09.2004, RIKEN, Japan)[19].
В FANTOM3[20] для получения данных, которые раскрывают динамическое регулирование транскриптома, была изменена стратегия аннотации[21]. В частности, были подготовлены новые датасеты для:
- Идентификации новых полноразмерных кДНК для 103,000 клонов
- Детерминирования и аннотирования транскриптов, транскрипционных единиц, анализа их сложности и экспрессии
- Экспериментальной идентификации стартовых позиций инициации транскрипции и её терминации, а также вычисления непомерной сложности человеческого транскриптома
- Выявления регионов промоторов
Таким образом, помимо подготовления новых данных для более функционального анализа транскриптома, идентификации и аннотирования новых и низкоуровневых мРНК, конечной целью FANTOM3 было функционально аннотировать сложность транскриптома, идентифицировать стартовые сайты инициации транскрипции, сайты терминации транскрипции, а также промоторы. Ещё одним аспектом понимания сложности транскриптома было осмысление некодирущих РНК, которые составляют до половины транскриптома. В новвовведения входили также технологии CAGE, GIS (Gene Identification Signature) и GSC (Genome Signature Cloning)[22].
MATRICS-RELOADED
103,000 полноразмерных кДНК были аннотированы в ходе телеконференции MATRICS-RELOADED, аналогичной MATRICS FANTOM2. В телемосте участвовало свыше 100 учёных со всего мира. Функциональные аннотации полноразмерных кДНК можно найти на сервере FANTOM3[23].
Технология CAGE
Технология CAGE позволяет проводить высокопроизводительный анализ экспрессии генов, получать профили транскрипционных сайтов[24].
Применение новой технологии CAGE показало, что более чем 63 % генома (а не как раньше считалось ~1,5 % белок-кодирующих экзонов) транскрибируется с образованием РНК. Также было обнаружено более 23,000 некодирующих РНК (non-coding RNAs, ncRNAs) и что >73 % транскриптов способны к смысловой и антисмысловой транскрипции. Также был начат анализ кДНК и профилей экспрессии генов человека[25][26].
FANTOM4
Для работы четвёртой фазы проекта динамические паттерны экспрессии генов мРНК, микроРНК и активности промоторов были измерены для дифференцирующихся клеток миелоидной лейкемии человека — клеточной линии THP-1[27].
Во время работы этого этапа для мониторинга динамики использования точек инициации транскрипции (TSS) в ходе клеточной дифференциации использовалась технология deepCAGE[28]. Для построения модели транскрипционной регуляторной сети были использованы предсказанные сайты связывания транскрипционных факторов и данные об уровнях экспресии промоторов[29]. Благодаря этому стало возможным предсказывать регуляторные границы (EDGES) между транскрипционным фактором и целевым промотором, делать выводы о регуляции транскрипции с исследуемого промотора определённым транскрипционным фактором. На основе этих данных была разработана EDGE EXPRESS DB[30], в которой можно найти регуляционные сети одного или нескольких интересующих генов.
Также были созданы геномные браузеры[31] для графического отображения в геноме мыши или человека важных мест, таких как промоторы, экзоны, места ацетилирования His3 (H3K9ac) и сайты связывания транскрипционных факторов.
FANTOM5
Введение
Эта стадия проекта, полностью основанная на опыте предыдущих стадий, продолжается по настоящее время с целью поиска общих правил клеточной дифференциации. Главной целью является систематическое исследование наборов генов, используемых при кодировании большинства типов клеток. Создаётся карта основных промоторов человека и относительная модель транскрипционной сети регуляции каждого клеточного состояния. Для этого используется deepCAGE[32] секвенирование РНК, выделенных из всех основных органов человека и более 200 раковых клеточных линий.
Фаза 1
Были получены карты для наборов транскриптов, транскрипционных факторов, промоторов и энхансеров, активных в большинстве первичных клеток млекопитающих и части раковых клеточных линий[33][34].
Примерно 30 публикаций этой фазы проекта описывают такие разные результаты, как первичные клетки, семейства генов, полногеномные исследования и новые биоинформатические инструменты.
Фаза 2
Сравнительный анализ уровней РНК в разных типах клеток показал, что когда клетка дифференцируется, первичная активация этого процесса случается в энхансерных участках ДНК[35].
Результаты
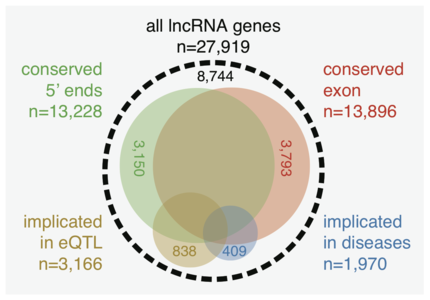
Существуют серьёзные споры о том, являются ли тысячи длинных некодирующих РНК, транскрибируемые с наших геномов, функциональными или просто побочными продуктами шумового транскрипционного механизма. Учёные из консорциума FANTOM5 под руководством RIKEN использовали технологию, известную CAGE, для создания атласа длинных некодирующих РНК человека с точными 5'-концами и суммировали их паттерны экспрессии по основным типам клеток. В публикации[36] , они пересекли этот атлас экспрессии с другими генетическими и геномными наборами данных и предположили, что многие из этих длинных некодирующих РНК могут быть функциональными.
CAGE в большой коллекции первичных типов клеток показал, что многие промоторы млекопитающих представляют собой составные объекты, состоящие из множества близко расположенных точек инициаций транскрипций (TSS), с независимыми профилями экспрессии, специфичными для типа клеток. Атлас экспрессии, ориентированный на промотор FANTOM5[37], обеспечивает профили экспрессии для большинства кодирующих и некодирующих транскриптов в геномах человека и мыши[38].
С помощью FANTOM5[39] был получен транскриптом свежеизолированных тучных клеток кожи человека. Тучные клетки уникальны в гематопоэтической линии и только отдалённо связаны с базофилами. Было показано, что тучные клетки экспрессируют BMP-рецепторы, и что BMP могут способствовать выживанию и восстановлению после стимуляции тучных клеток человека[40].
-
Атлас длинных некодирующих РНК человека
-
Атлас экспрессии промоторов млекопитающих
-
Переоценка транскриптома тучных клеток человека методом deepCAGE
Доступность данных
Интерактивные базы данных (interactive viewer, data exporter) и все файлы за время работы всех стадий проекта находятся в свободном доступе в общей FANTOM database[41].
Все полноразмерные кДНК клоны доступны в Dnaform, Invitrogen, RZPD и Gene Service.
Примечания
- ↑ 1 2 Yoshihide Hayashizaki.
- ↑ The Mouse Encyclopedia Project. Omics Science Center. Дата обращения: 9 апреля 2020. Архивировано 17 сентября 2016 года.
- ↑ FANTOM. web.archive.org (2 ноября 2018). Дата обращения: 9 апреля 2020.
- ↑ J. Kawai, A. Shinagawa, K. Shibata, M. Yoshino, M. Itoh. Functional annotation of a full-length mouse cDNA collection (англ.) // Nature. — 2001-02. — Vol. 409, iss. 6821. — P. 685–690. — ISSN 1476-4687. — doi:10.1038/35055500.
- ↑ Functional annotation of a full-length mouse cDNA collection // Nature. — 2001. — № 409. — doi:10.1038/35055500.
- ↑ Nan Chen, Wei-Min Wang, Huan-Ling Wang. An efficient full-length cDNA amplification strategy based on bioinformatics technology and multiplexed PCR methods (англ.) // Scientific Reports. — 2016-01-13. — Vol. 6, iss. 1. — P. 1–9. — ISSN 2045-2322. — doi:10.1038/srep19420.
- ↑ Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA // Proc Natl Acad Sci U S A. — 1998. — № 95. — doi:10.1073/pnas.95.2.520.
- ↑ Piero Carninci, Yoko Nishiyama, Arthur Westover, Masayoshi Itoh, Sumiharu Nagaoka. Thermostabilization and thermoactivation of thermolabile enzymes by trehalose and its application for the synthesis of full length cDNA (англ.) // Proceedings of the National Academy of Sciences. — 1998-01-20. — Vol. 95, iss. 2. — P. 520–524. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.95.2.520.
- ↑ High efficiency selection of full-length cDNA by improved biotinylated cap trapper // DNA Res. — 1997. — № 4. — doi:10.1093/dnares/4.1.61.
- ↑ High-efficiency full-length cDNA cloning by biotinylated CAP trapper // Genomics. — 1996. — № 37. — doi:10.1006/geno.1996.0567.
- ↑ Balanced-size and long-size cloning of full-length, cap-trapped cDNAs into vectors of the novel lambda-FLC family allows enhanced gene discovery rate and functional analysis // Genomics. — 2001. — № 77. — doi:10.1006/geno.2001.6601.
- ↑ Normalization and subtraction of cap-trapper-selected cDNAs to prepare full-length cDNA libraries for rapid discovery of new genes // Genome Res. — 2000. — № 10. — doi:10.1006/geno.2001.6601.
- ↑ FANTOM. fantom.gsc.riken.jp. Дата обращения: 11 мая 2020.
- ↑ FANTOM2.
- ↑ Takeya Kasukawa, Masaaki Furuno, Itoshi Nikaido, Hidemasa Bono, David A. Hume. Development and Evaluation of an Automated Annotation Pipeline and cDNA Annotation System // Genome Research. — 2003-6. — Т. 13, вып. 6b. — С. 1542–1551. — ISSN 1088-9051. — doi:10.1101/gr.992803.
- ↑ Online resources for MATRICS FANTOM2.
- ↑ FANTOM. web.archive.org (21 ноября 2018). Дата обращения: 9 апреля 2020.
- ↑ Analysis of the mouse transcriptome based on functional annotation of 60,770 full-length cDNAs // Nature. — 2002. — № 420.
- ↑ FANTOM3::History. fantom3.gsc.riken.jp. Дата обращения: 11 мая 2020.
- ↑ FANTOM3.
- ↑ Стратегия аннотации FANTOM3.
- ↑ Norihiro Maeda, Takeya Kasukawa, Rieko Oyama, Julian Gough, Martin Frith. Transcript Annotation in FANTOM3: Mouse Gene Catalog Based on Physical cDNAs (англ.) // PLOS Genetics. — 2006-04-28. — Vol. 2, iss. 4. — P. e62. — ISSN 1553-7404. — doi:10.1371/journal.pgen.0020062.
- ↑ Сервер FANTOM3.
- ↑ FANTOM3::History. fantom.gsc.riken.jp. Дата обращения: 9 апреля 2020.
- ↑ Antisense transcription in the mammalian transcriptome // Science. — 2005. — № 309. — doi:10.1126/science.1112009.
- ↑ The transcriptional landscape of the mammalian genome // Science. — 2005. — № 309. — doi:10.1126/science.1112014.
- ↑ Harukazu Suzuki, Piero Carninci, Carsten Daub, Jun Kawai, Yoshihide Hayashizaki. Beyond the FANTOM4 // Genome Biology. — 2010-10-11. — Т. 11, вып. 1. — С. O11. — ISSN 1474-760X. — doi:10.1186/gb-2010-11-s1-o11.
- ↑ deepCAGE.
- ↑ The transcriptional network that controls growth arrest and differentiation in a human myeloid leukemia cell line // Nature Genetics. — 2009. — № 41. — doi:10.1038/ng.375.
- ↑ EDGE EXPRESS DB.
- ↑ геномные браузеры.
- ↑ deepCAGE.
- ↑ A promoter level mammalian expression atlas // Nature. — 2014. — № 507. — doi:10.1038/nature13182.
- ↑ An atlas of active enhancers across human cell types and tissues. // Nature. — 2014. — № 507. — doi:10.1038/nature12787.
- ↑ Transcribed enhancers lead waves of coordinated transcription in transitioning mammalian cells // Science. — 2015. — № 347. — doi:10.1126/science.1259418.
- ↑ Chung-Chau Hon, Jordan A. Ramilowski, Jayson Harshbarger, Nicolas Bertin, Owen J. L. Rackham. An atlas of human long non-coding RNAs with accurate 5′ ends (англ.) // Nature. — 2017-03. — Vol. 543, iss. 7644. — P. 199–204. — ISSN 1476-4687. — doi:10.1038/nature21374.
- ↑ FANTOM5.
- ↑ Alistair R. R. Forrest, Hideya Kawaji, Michael Rehli, J. Kenneth Baillie, Michiel J. L. de Hoon. A promoter-level mammalian expression atlas (англ.) // Nature. — 2014-03. — Vol. 507, iss. 7493. — P. 462–470. — ISSN 1476-4687. — doi:10.1038/nature13182.
- ↑ FANTOM5.
- ↑ Efthymios Motakis, Sven Guhl, Yuri Ishizu, Masayoshi Itoh, Hideya Kawaji. Redefinition of the human mast cell transcriptome by deep-CAGE sequencing (англ.) // Blood. — 2014-04-24. — Vol. 123, iss. 17. — P. e58–e67. — ISSN 0006-4971. — doi:10.1182/blood-2013-02-483792.
- ↑ FANTOM database.
Ссылки
- FANTOM. Functional Annotation of the Mammalian Genome (англ.). RIKEN. — Сайт проекта ФАНТОМ. Дата обращения: 14 апреля 2020.
- The Mouse Encyclopedia Project (англ.).
- CAGE homepage at the RIKEN Omics Science Center. (англ.)
- Protocols. Detailed descriptions on protocols used in FANTOM (англ.). RIKEN. — Подробное описание протоколов, использованных в проекте. Дата обращения: 14 апреля 2020.
- RIKEN Omics Science Center (англ.).
Статья является кандидатом в добротные статьи с 14 апреля 2020. |