Стаи и косяки рыб: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Нет описания правки |
Нет описания правки |
||
| Строка 80: | Строка 80: | ||
[[Файл:Beautiful sardine.jpg|мини|Сардины, сбившиеся в клубок в окружении хищников]] |
[[Файл:Beautiful sardine.jpg|мини|Сардины, сбившиеся в клубок в окружении хищников]] |
||
Стайные кормовые рыбы постоянно подвергаются нападениям со стороны хищников. Примером могут служить атаки, которые происходят во время [[Ход сардин|хода сардин]], когда миллионы серебристых рыб плывут вдоль южного побережья Африки. С точки зрения [[Биомасса|биомассы]], сардина может соперничать с [[Гну|большой гну]] в [[Восточная Африка|Восточной Африке]]<ref>{{Cite news|title=Marine scientists scratch heads over sardines {{!}} IOL|url=http://www.iol.co.za/news/south-africa/marine-scientists-scratch-heads-over-sardines-220684|accessdate=2016-10-25}}</ref>. Продолжительность жизни сардин невелика, всего 2—3 года. Взрослые двухлетние сардины весной и летом массово нерестятся на на банке [[Агульяс (банка)|Агульяс]], выпуская в воду тонны икры. Затем они отправляются в субтропические воды Индийского океана. Самые крупные косяки достигают 7 км в длину, 1,5 км в ширину и 30 м в глубину. За сардинами следует огромное количество [[Акулы|акул]], [[Дельфиновые|дельфинов]], [[Тунцы (род)|тунцов]], [[Парусник (рыба)|парусников]], [[Капский морской котик|капских морских котиков]] и даже [[Косатка (млекопитающее)|косаток]]. В случае опасности сардины и другие кормовые рыбы сбиваются вместе, образуя массивные подвижные клубки, диаметр которых может достигать 10—20 м. Подобная агрегация редко сохраняется дольше 10 минут. <ref>{{Cite web|url=http://www.vliz.be/projects/marineworldheritage/sites/3.2_Sardine%20Run.php?item=The%20Indian%20Ocean|title=Marine World Heritage - Sardine Run|publisher=www.vliz.be|accessdate=2016-10-25}}</ref>. |
Стайные кормовые рыбы постоянно подвергаются нападениям со стороны хищников. Примером могут служить атаки, которые происходят во время [[Ход сардин|хода сардин]], когда миллионы серебристых рыб плывут вдоль южного побережья Африки. С точки зрения [[Биомасса|биомассы]], сардина может соперничать с [[Гну|большой гну]] в [[Восточная Африка|Восточной Африке]]<ref>{{Cite news|title=Marine scientists scratch heads over sardines {{!}} IOL|url=http://www.iol.co.za/news/south-africa/marine-scientists-scratch-heads-over-sardines-220684|accessdate=2016-10-25}}</ref>. Продолжительность жизни сардин невелика, всего 2—3 года. Взрослые двухлетние сардины весной и летом массово нерестятся на на банке [[Агульяс (банка)|Агульяс]], выпуская в воду тонны икры. Затем они отправляются в субтропические воды Индийского океана. Самые крупные косяки достигают 7 км в длину, 1,5 км в ширину и 30 м в глубину. За сардинами следует огромное количество [[Акулы|акул]], [[Дельфиновые|дельфинов]], [[Тунцы (род)|тунцов]], [[Парусник (рыба)|парусников]], [[Капский морской котик|капских морских котиков]] и даже [[Косатка (млекопитающее)|косаток]]. В случае опасности сардины и другие кормовые рыбы сбиваются вместе, образуя массивные подвижные клубки, диаметр которых может достигать 10—20 м. Подобная агрегация редко сохраняется дольше 10 минут. <ref>{{Cite web|url=http://www.vliz.be/projects/marineworldheritage/sites/3.2_Sardine%20Run.php?item=The%20Indian%20Ocean|title=Marine World Heritage - Sardine Run|publisher=www.vliz.be|accessdate=2016-10-25}}</ref>. |
||
Развитие стайного поведения, вероятно, связано с улучшением восприятия, которое позволяет избежать [[Каннибализм (зоология)|каннибализма]]<ref name=":2" />. |
|||
== Адаптация со стороны хищников == |
|||
У хищников выработались различные приёмы противодействия, подрывающие защитные свойства стайного поведения и манёвров кормовой рыбы. [[Парусник (рыба)|Парусник]] поднимает свой парус, становится крупнее и таким образом способен нанести больший урон стае рыб или кальмаров. [[Меч-рыба]] на высокой скорости врезается в косяк и своим мечом убивает или глушит жертвы. Затем она возвращается, чтобы подобрать «улов». Лисьи акулы, иногда собираясь попарно или группой, своим длинным хлыстообразным хвостом сбивают косяк плотнее и глушат рыбу<ref>{{Cite web|url=http://www.flmnh.ufl.edu/fish/discover/species-profiles/alopias-pelagicus|title=''Alopias pelagicus''|author=|work=|date=|publisher=Florida Museum of Natural History|accessdate=2016-10-26}}</ref><ref>{{Статья|автор=Simon P. Oliver, John R. Turner, Klemens Gann, Medel Silvosa, Tim D'Urban Jackson|заглавие=Thresher Sharks Use Tail-Slaps as a Hunting Strategy|ссылка=http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0067380|язык=|издание=PLOS ONE|тип=|год=2013-07-10|месяц=|число=|том=8|выпуск=|номер=|страницы=|pages=e67380|volume=7|issn=1932-6203|doi=10.1371/journal.pone.0067380}}</ref>. Короткопёрые серые акулы проносятся сквозь косяк вертикально, закручиваясь вокруг своей оси, хватая рыбу раскрытой пастью. Иногда в финальной части атаки они полностью выскакивают из воды. |
|||
== См. также == |
== См. также == |
||
Версия от 07:47, 26 октября 2016
Эту страницу в данный момент активно редактирует участник Subst:L. |
[[Категория:Википедия:Ошибка выражения: неожидаемый оператор <, редактируемые прямо сейчас]]

В биологии, любые группы рыб, которые держатся вместе по социальным причинам, представляют собой стаю[1]. Как правило, это рыбы одного вида, большинство из которых находится в одинаковой фазе жизненного цикла, активно контактируют друг с другом и в любой момент могут проявить биологически полезную для членов группы организованную деятельность[2]. Примерно четверть всех существующих видов рыб, в основном мелкие пелагические рыбы, такие как сельди и анчоусы, проводят всю свою жизнь в стаях. Около половины видов живут стаями часть жизни, обычно до наступления половой зрелости, например, карповые и жерехи[3].
Подобное временное объединение взаимосвязанных по своему поведению рыб имеет разнообразное приспособительное значение. Это и защита от хищников (хищника легче обнаружить, кроме того, находясь в массе сородичей, меньше шансов быть пойманным), эффективный поиск пищи, больший успех в поиске партнёра для размножения, совершение миграций и зимовка.
Рыбы образуют стаи по нескольким параметрам. Как правило, они предпочитают более крупные косяки, состоящие из особей своего вида, либо похожих на себя по размеру и внешнему виду, здоровых рыб, и родственников.

Согласно эффекту «странности» любой член стаи, который выделяется своим внешним видом, станет преимущественной мишенью для хищников. Этот факт объясняет почему рыбы предпочитают стаи похожих на себя особей. Эффект «странности», таким образом, обусловливает гомогенность стай.
Обзор

Скопление рыбы — это общий термин для любой группы рыб, собравшейся в каком-либо месте. Скопления рыб бывают структурированными или неструктурированными. Неструктурированные скопления могут состоять из особей смешанных видов и размеров, собравшихся случайно у локальных ресурсов, например, корма или гнездовья.
Если агрегация происходит интерактивным, социальным путём, её можно назвать стаей[1]. Хотя стайные рыбы могут плавать и кормиться независимо друг от друга, тем не менее, они всё-же осведомлены о других членах группы, о чём свидетельствует их приспособительное поведение, например, движение поблизости. Стайные группы могут быть образованы рыбами разных размеров и видов.
Стая бывает организована довольно жёстко, когда рыбы плавают синхронно с одинаковой скоростью и в одном направлении[1][4]. Подобные косяки обычно образованы рыбами одного вида и возраста/размера, двигающимися на некотором расстоянии друг от друга. Они способны производить сложные манёвры, так будто обладают собственным разумом[5].
Тонкости формирования стаи изучены далеко не полностью, особенно аспекты движения и энергетики питания. Для объяснения стайного поведения выдвинуто множество гипотез, в том числе лучшая ориентация, синхронизация охоты, запутывание хищника и снижение риска быть схваченным. Стайный образ жизни имеет и свои недостатки, например, накопление выделений дыхательной системы и истощение кислорода и пищевых ресурсов[1].

У рыб стайность бывает облигатной или факультативной[6]. Облигатные стайные рыбы, такие как тунец, сельдь и килька, всю жизнь проводят в группе и начинают беспокоиться, будучи отделёнными от неё. Факультативные стайные рыбы, например, атлантическая треска, сайда и некоторые виды ставрид, собираются в стаи лишь на время, иногда для репродуктивных целей[7].
Скопление рыб может превратиться в слаженную и организованную стаю, а затем в течение нескольких секунд снова стать аморфным. Такие трансформации вызваны переходом между разными видами деятельности: от кормления к отдыху, миграции или бегству от хищника[5].
Аморфные скопления более уязвимы для нападения хищника. Форма стаи зависит от вида рыб и того, чем они занимаются в текущий момент. Косяки мигрирующих рыб выстраиваются длинными тонкими линиями, приобретают квадратную, овальную или амёбовидную форму. Быстро движущиеся стаи, как правило, имеют форму клина, а нагульные косяки обычно становятся круговыми[5].
Кормовые рыбы — это мелкие рыбы, на которых охотятся крупные хищники — рыбы, морские птицы и млекопитающие. Типичные океанические кормовые рыбы представляют собой небольших планктонофагов, подобных сельдям, анчоусам и менхэденам. Кормовые рыбы компенсируют свой малый размер, формируя косяки. Иногда они кормятся, синхронно двигаясь в определённом порядке с открытыми ртами, что позволяет им эффективно фильтровать планктон[8]. Иногда огромные косяки кормовых рыб двигаются вдоль береговой линии и переплывают через открытый океан.
Большинство кормовых рыб являются пелагическими, они формируют свои стаи в открытой воде, а не на дне или около дна (донные рыбы). Кормовые рыбы недолговечны, в основном их перемещения незаметны для человека. Внимание хищников сосредоточено на косяках, они знают их численность и местонахождение, и зачастую сами собираются в стаи и совершают длительные миграции, чтобы поддерживать с ними связь[9].

Сельди — одни из наиболее впечатляющих стайных рыб. Они образуют многочисленные скопления. Самые крупные косяки формируются во время миграций путём слияния нескольких мелких стай. «Цепочки», образованные многочисленными стаями, тянутся на сотки километров во время миграции кефали в Каспийском море. По оценкам стаи сельди в Северной Атлантике могут занимать до 4,8 кубических километров при плотности 0,5—1,0 рыбы на кубический метр, что в сумме составляет около трёх миллиардов особей в одном косяке[10]. Эти стаи двигаются вдоль побережья и пересекают открытый океан. Молоки нерестящихся тихоокеанских сельдей иногда окрашивают приибрежные воды Южного Сахалина в белый цвет
. В целом косяки сельди чётко организованы, что позволяет им поддерживать относительно постоянную крейсерскую скорость. У сельдевых отличный слух, их косяки мгновенно реагируют на появление хищника. Сельди держатся на определённом расстоянии от хищника, например, косатки, образуя вакуоль, которая с высоты птичьего полёте выглядит как бублик[12].
Многих виды крупных хищников также образуют стаи, в том числе мигрирующие рыбы, такие как тунцы и некоторые океанские акулы.
Стайный образ жизни обычно описывается как компромисс между преимуществом жизни в группе в плане большей защищённости от хищников и усиленной конкуренцией в добывании пищи[13]. Некоторые авторы утверждает, что совокупные преимущества стайности представляют для рыб мощные селективные стимулы, заставляющие их присоединиться к косякам[14]. Есть мнение, что формирование стай является классическим примером эмерджентности, то есть наличия свойств, принадлежащих стае, а не отдельным рыбам. Эмерджентные свойства обеспечивают членам стаи эволюционное преимущество[15].
Социальное взаимодействие
Социальную функцию стайного образа жизни, особенно у рыб, можно рассматривать в нескольких аспектах их поведения. Например, эксперименты показали, что отдельные рыбы, будучи изолированными из стаи, начинают интенсивнее дышать. Этот эффект был приписан к воздействию стресса, оказалось, что пребывание в среде сородичей действует успокаивающее и даёт мощную социальную мотивацию, чтобы оставаться в группе[16]. Сельди, например, начинают очень волноваться, если их изолировать от сородичей.[17] Из-за адаптации к стайному образу жизни, их редко содержат в аквариумах. Даже в самых лучших искусственных условиях они становятся болезненными и вялыми по сравнению с полными энергии собратьями в диких косяках. В ходе наблюдений за сельдью в искусственных условиях было установлено, что чем многочисленнее группа, тем быстрее рыбы начинают питаться и лучше себя чувствуют. Сельди, содержащиеся изолированно или попарно, не питались и погибали через 2—15 суток[18].
Преимущества в добывании корма

Было сделано предположение, что стайный образ жизни у рыб повышает эффективность добывания корма. Подобное явление было обнаружено при изучении нагульного поведения стайных карповых[19]. В этом исследовании было измерено время, которое потребовалось группам пескарей и золотых рыбок, чтобы найти корм. При разной численности рыб в группе было установлено статистически значимое уменьшение времени, необходимое для поиска пищи большими группами. Структура стай также помогает эффективнее охотиться хищным рыбам. Анализ на основании данных, полученных с помощью аэрофотосъемки, показал, что стая обыкновенных тунцов имеет форму параболы, этот факт наводит на мысль о коллективной охоте у этого вида[20].
Причиной этому множество глаз, ищущих еду. Рыбы в косяках «делятся» информацией, контролируя поведение друг друга с близкого расстояния. Кормовое поведение одной рыбы быстро стимулирует активный поиск пищи у других[1].
В океане благодатную почву для кормления рыбам обеспечивают апвеллинги. Общая циркуляция в океане представляет собой крупномасштабные океанские течения, вызванные силой Кориолиса. Ветровые поверхностные течения взаимодействуют с этими круговоротами и с подводными образованиями рельефа, такими как подводные горы, банки, и край континентального шельфа, производя восходящие течения и апвеллинги[21]. Они переносят питательные вещества, благодаря которым процветает планктон. Привлечённый обильным кормом планктон становится кормом для рыб. В свою очередь, кормовые рыбы являются добычей крупных хищников. Большинство апвеллингов наблюдаются в прибрежных водах, многие из них поддерживают наиболее богатые мировые рыбные ресурсы. Апвеллинг отмечается у побережья Перу, Чили, в Аравийском море, в западных водах Южной Африки, у восточных берегов Новой Зеландии и побережья Калифорнии.
Веслоногие рачки, главный компонент зоопланктона, составляют основу рациона кормовых рыб. Эти мелкие ракообразные обитают как в океане, так и в пресной воде. Их длина обычно не превышает 1—2 мм, удлинённое тело имеет форму капли. Веслоногие очень осторожны и вёртки. Расставив длинные усики, они способны ощутить изменение давления воды, вызванное приближением хищника и мгновенно отскочить на несколько сантиметров. При высокой концентрации рачков стаи сельдей кормятся, проплывая сквозь их скопление с распахнутыми ртами и полностью раскрытыми жаберными крышками.
-
С помощью длинных усиков веслоногие рачки улавливают изменение давления воды]]
-
Сельди кормятся рачками, рыскрыв рот
-
Веслоногие рачки составляют основу рациона многих пелагических кормовых рыб, например, сельдей
-
Схема показывает, как сельди синхронно охотятся на такую подвижную добычу, как веслоногие
Рыбы плывут рядом друг с другом на расстоянии, равном длине прыжка рачков, как показано на анимации вверху вправа. Рачок чувствует давление воды от приближающейся рыбы и совершает скачок, длина которого всегда примерно одинакова. Неутомимо рачок может прыгнуть до 80 раз. После прыжка ему требуется 60 миллисекунд, чтобы вновь расправить антенны. Эта задержка может стать для него губительной, поскольку сельди движутся непрерывным потоком и в конце концов поймают его. Единичная неполовозрелая сельдь не в состоянии поймать крупного веслоногого рачка[8].
Преимущества в размножении
Стайное поведение может предоставлять рыбам преимущества в размножении. В стае легче найти потенциального партнёра, для этого требуется меньше энергии. Для рыб, совершающих длительные миграции на нерестилища, лучше ориентируются в стае, получая информацию об окружающей среде от всех её членов[5].
Кормовые рыбы зачастую совершают миграции между местами нагула, нереста и природными питомниками. Как правило, у конкретной популяции эти три места образуют треугольник. Например, популяция сельди нереститься у южного побережья Норвегии, нагуливается в водах Исландии, а молодь подрастает на севере Норвегии. Подобное географическое разделение может играть существенную роль, поскольку во время нагула кормовые рыбы не различают собственную молодь.
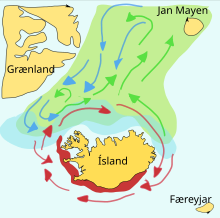
Мойва — кормовая рыба семейства корюшковых, которая обитает в Атлантическом и Северном ледовитом океане. Летом она нагуливается на плотных скоплениях планктона у края ледяного шельфа. Крупные особи также питаются крилем. Весной и летом большими стаями мойва мигрирует между местами нагула и нереста (Исландия, Гренландия и Ян-Майен). На их миграции оказывают влияние океанические течения. Весной и осенью половозрелые особи движутся к северу на нагул вокруг Исландии. В обратном направлении они плывут в сентябре—ноябре. Миграция на нерест начитается в декабре-январе[22][23]. Схема справа показывает основные нерестилища и направление движения личинок. Зелёным цветом отмечена мойва, следующая на нагул, синим показано обратное направление, а красным цветом отмечены нерестящиеся рыбы.
Влияние на гидродинамику
Существует теория, согласно которой стайные рыбы способны экономить энергию на движении в группе, подобно велогонщикам в пелотоне. Считается, что гуси, совершающие перелёты в стае, образующая букву V пользуется тем же преимуществом, двигаясь в восходящем потоке вихря, создаваемого крыльями птиц, летящих впереди[24][25].
Представляется обоснованным думать, что регулярный интервал и примерно одинаковый размер рыб, составляющих стаю, приведёт к повышению гидродинамической эффективности[13]. Однако лабораторные эксперименты не подтвердили эту гипотезу[1], хотя вохможно существование подобного феномена в дикой природе. Было сделано предположение, что рыбы, занимающие положение лидеров в стае, постоянно меняются, поскольку оно даёт преимущества в кормлении, тогда как остальные члены группы выигрывают в гидродинамике[14].
Избегание хищников
Когда стайная рыба отбивается от косяка, она легко становится добычей хищника[5]. Стайный образ жизни предполагает несколько способов избежать опасности. Во-первых, это поведение, сбивающее хищника с толку[26]. В погоне за стаей дневной хищник как бы дезориентируется многочисленными мелькающими рыбками, его погоня становится менее целенаправленной, броски учащаются, растёт число промахов. Дезориентацию увеличивают специфические манёвры стаи, например, при броске ближайшие к хищнику рыбы рассыпаются веером вперёд и в стороны, и проплыв немного вперёд заворачивают обратно к хвосту хищника против направления его атаки. Иногда стая разделяется надвое и снова соединяется позади хищника, совершив манёвр в виде буквы Ф. Подобное поведение наблюдается при погоне лобанов и морских налимов за обыкновенными атеринами, европейскими сарганами и европейскими анчоусами. Описанный маневр был зафиксирован в искусственных условиях при наблюдении за молодью щуки и мальками карповых рыб. Подо[27]бное явление объясняется, вероятно, тем, что движение многочисленных потенциальных жертв «перегружает» зрительные каналы хищника. Это предположение было подтверждено как экспериментально[28][29], так и с помощью компьютерного моделирования[30][31]. Стайные рыбы имеют одинаковый размер и серебристую окраску, поэтому хищнику трудно выделить один объекты из массы мелькающих рыб, а затем схватить добычу, прежде чем она скроется в круговороте сородичей[5].
Во-вторых, боковая линия и электросенсорная система хищников не получают точных сигналов от скопления рыб[32]. Движения плавников одной рыбы выступают в качестве точечного источника сигнала в форме волны, по который хищник мог бы локализовать её. Поскольку поля множества перекрывают друг друга, сигналы перемешиваются, вероятно, формируя волну давления, воспринимаемую боковой линией, как исходящую от крупного животного[32][33]. Боковая линия играет важную роль в финальной фазе атаки хищника[34]. Восприимчивые к электричеству животные способны локализовать источник поля с помощью пространственным неравномерностей. Отдельные сигналы можно получить при условии, что испускающие их особи должны быть удалены друг от друга на расстоение равное примерно пяти ширинам своего тела. Если объекты расположенны слишком скученно, чтобы быть распознанными, она образуют размытую картину[35]. На основании этого можно сделать предположение, что стайное поведение может запутать электросенсорную систему хищника[32].
Третьим эффектом противодействия хищникам, которым могут обладать скопления животных, является гипотеза «множества глаз». Эта теория гласит, что по мере увеличения размера группы, задача сканирования окружающей среды на предмет обнаружения опасности может быть распределена среди множества особей. Кроме того, что это массовое сотрудничество вероятно обеспечивает повышение бдительности, оно также увеличивает время индивидуального кормления[36][37].
Четвёртым гипотетическим эффектом противодействия хищникам посредством образования скоплений является эффект «растворения в толпе», который схож с эффектом запутывания хищника[1]. Конкретный хищник может съесть только небольшую часть крупной стаи по сравнению с немногочисленной агрегацией[38]. Было сделано предположение, что животные ищут в группе индивидуальное спасение и прячутся за спинами сородичей[39]. В другой формулировке теория рассматривалась как комбинация обнаружения и вероятности атаки[40]. В части теории, касающейся обнаружения, было высказано предположение, что потенциальная добыча может получить преимущество от жизни в группе, так как вероятность встретиться с хищником у каждой конкретной группы меньше, чем у единичной особи. В части, касающейся атаки, говорилось, что атакующий хищник с меньшей вероятностью съесть определённую рыбу, в присутствии большого количества рыб вокруг. В целом предполагалось, что рыба получает большее преимущество, если она находится в большей из двух групп, при условии, что вероятность обнаружения и атаки не не увеличивается непропорционально с размером группы[41].

Стайные кормовые рыбы постоянно подвергаются нападениям со стороны хищников. Примером могут служить атаки, которые происходят во время хода сардин, когда миллионы серебристых рыб плывут вдоль южного побережья Африки. С точки зрения биомассы, сардина может соперничать с большой гну в Восточной Африке[42]. Продолжительность жизни сардин невелика, всего 2—3 года. Взрослые двухлетние сардины весной и летом массово нерестятся на на банке Агульяс, выпуская в воду тонны икры. Затем они отправляются в субтропические воды Индийского океана. Самые крупные косяки достигают 7 км в длину, 1,5 км в ширину и 30 м в глубину. За сардинами следует огромное количество акул, дельфинов, тунцов, парусников, капских морских котиков и даже косаток. В случае опасности сардины и другие кормовые рыбы сбиваются вместе, образуя массивные подвижные клубки, диаметр которых может достигать 10—20 м. Подобная агрегация редко сохраняется дольше 10 минут. [43].
Развитие стайного поведения, вероятно, связано с улучшением восприятия, которое позволяет избежать каннибализма[32].
Адаптация со стороны хищников
У хищников выработались различные приёмы противодействия, подрывающие защитные свойства стайного поведения и манёвров кормовой рыбы. Парусник поднимает свой парус, становится крупнее и таким образом способен нанести больший урон стае рыб или кальмаров. Меч-рыба на высокой скорости врезается в косяк и своим мечом убивает или глушит жертвы. Затем она возвращается, чтобы подобрать «улов». Лисьи акулы, иногда собираясь попарно или группой, своим длинным хлыстообразным хвостом сбивают косяк плотнее и глушат рыбу[44][45]. Короткопёрые серые акулы проносятся сквозь косяк вертикально, закручиваясь вокруг своей оси, хватая рыбу раскрытой пастью. Иногда в финальной части атаки они полностью выскакивают из воды.
См. также
Примечания
- ↑ 1 2 3 4 5 6 7 Pitcher, T. J. and Parrish, J. K. Chp 12: Functions of shoaling behaviour in teleosts // Behaviour of Teleost Fishes. — Springer, 1993. — С. 365. — ISBN 978-0-412-42930-9.
- ↑ Мантейфель Б. П. «Экология поведения животных», 1980, pp. 62—63.
- ↑ Evelyn Shaw. Schooling Fishes: The school, a truly egalitarian form of organization in which all members of the group are alike in influence, offers substantial benefits to its participants // American Scientist. — 1978-01-01. — Т. 66, № 2. — P. 166–175.
- ↑ Helfman G., Collette B., & Facey D. The Diversity of Fishes. — Blackwell Publishing, 1997. — P. 375. — ISBN 0-86542-256-7.
- ↑ 1 2 3 4 5 6 Moyle, P. B. and Cech, J. J. Fishes, An Introduction to Ichthyology (5th ed.). — Benjamin Cummings, 2004. — ISBN 978-0-13-100847-2.
- ↑ Breder, C. M., Jr. On the survival value of fish schools // Zoologica. — 1967. — № 52. — P. 25—40.
- ↑ Brian L. Partridge, Tony Pitcher, J. Michael Cullen, John Wilson. The three-dimensional structure of fish schools (англ.) // Behavioral Ecology and Sociobiology. — Vol. 6. — Vol. 4. — P. 277—288. — ISSN 0340-5443. — doi:10.1007/BF00292770.
- ↑ 1 2 Kils, U. The ecoSCOPE and dynIMAGE: Microscale tools for in situ studies of predator-prey interactions // Arch Hydrobiol Beih. — 1992. — № 36. — P. 83—96.
- ↑ S. Guénette, G. Melvin, A. Bundy. A review of the ecological role of forage fish and management strategies. Canadian Technical Report of Fisheries and Aquatic Sciences 3065 (2014).
- ↑ Радаков Д. В. Стайность рыб как экологическое явление. — М.: Наука, 1972. — 174 с.
- ↑ Мантейфель Б. П. «Экология поведения животных», 1980, p. 77.
- ↑ Leif Nøttestad, Bjørn Erik Axelsen. Herring schooling manoeuvres in response to killer whale attacks // Canadian Journal of Zoology. — 1999-12-01. — Т. 77. — Vol. 10. — P. 1540–1546. — ISSN 0008-4301. — doi:10.1139/z99-124.
- ↑ 1 2 D. J. Hoare, J. Krause, N. Peuhkuri, J.-G. J. Godin. Body size and shoaling in fish (англ.) // Journal of Fish Biology. — 2000-12-01. — Vol. 57, iss. 6. — P. 1351–1366. — ISSN 1095-8649. — doi:10.1111/j.1095-8649.2000.tb02217.x.
- ↑ 1 2 Janet T. Landa. Bioeconomics of schooling fishes: selfish fish, quasi-free riders, and other fishy tales (англ.) // Environmental Biology of Fishes. — Vol. 53. — Vol. 4. — P. 353–364. — ISSN 0378-1909. — doi:10.1023/A:1007414603324.
- ↑ Julia K. Parrish, Steven V. Viscido, Daniel Grünbaum. Self-Organized Fish Schools: An Examination of Emergent Properties // The Biological Bulletin. — 2002-06-01. — Т. 202. — Vol. 3. — P. 296–305. — ISSN 0006-3185. — doi:10.2307/1543482.
- ↑ Mark V. Abrahams, Patrick W. Colgan. Risk of predation, hydrodynamic efficiency and their influence on school structure (англ.) // Environmental Biology of Fishes. — Vol. 13. — Vol. 3. — P. 195–202. — ISSN 0378-1909. — doi:10.1007/BF00000931.
- ↑ Partridge, B.; Pitcher, T.; Cullen, M.; Wilson, J. (1980).
- ↑ Мантейфель Б. П. «Экология поведения животных», 1980, p. 79.
- ↑ T. J. Pitcher, A. E. Magurran, I. J. Winfield. Fish in larger shoals find food faster (англ.) // Behavioral Ecology and Sociobiology. — Vol. 10. — Vol. 2. — P. 149–151. — ISSN 0340-5443. — doi:10.1007/BF00300175.
- ↑ Brian L. Partridge, Jonas Johansson, John Kalish. The structure of schools of giant bluefin tuna in Cape Cod Bay (англ.) // Environmental Biology of Fishes. — Vol. 9. — Vol. 3—4. — P. 253–262. — ISSN 0378-1909. — doi:10.1007/BF00692374.
- ↑ Ocean Motion : Definition : Wind Driven Surface Currents - Upwelling and Downwelling. oceanmotion.org. Дата обращения: 21 октября 2016.
- ↑ Barbaro, Alethea B. T., Einarsson, Baldvin, Birnir, Bjorn, Sigurðsson, Sven Þ., Valdimarsson, Héðinn. Modeling and Simulations of the Spawning Migration of Pelagic Fish // Center for Complex and Nonlinear Science. — 2008-09-06.
- ↑ Harald Gjøsæter. The population biology and exploitation of capelin (Mallotus villosus) in the Barents sea // Sarsia. — 1998-12-30. — Т. 83. — Vol. 6. — P. 453–496. — ISSN 0036-4827. — doi:10.1080/00364827.1998.10420445.
- ↑ Frank E. Fish. Kinematics of ducklings swimming in formation: Consequences of position (англ.) // Journal of Experimental Zoology. — 1995-09-01. — Vol. 273. — Vol. 1. — P. 1—11. — ISSN 1097-010X. — doi:10.1002/jez.1402730102.
- ↑ R. McNeill Alexander. Hitching a lift hydrodynamically - in swimming, flying and cycling // Journal of Biology. — 2004-01-01. — Т. 3. — P. 7. — ISSN 1475-4924. — doi:10.1186/jbiol5.
- ↑ Manfred Milinski, Rolf Heller. Influence of a predator on the optimal foraging behaviour of sticklebacks (Gasterosteus aculeatus L.) (англ.) // Nature. — 1978-10-19. — Vol. 275. — Vol. 5681. — P. 642–644. — doi:10.1038/275642a0.
- ↑ Мантейфель Б. П. «Экология поведения животных», 1980, p. 68.
- ↑ Jonathan M. Jeschke, Ralph Tollrian. Prey swarming: which predators become confused and why? // Animal Behaviour. — 2007-09-01. — Т. 74. — Vol. 3. — P. 387–393. — doi:10.1016/j.anbehav.2006.08.020.
- ↑ C. C. Ioannou, C. R. Tosh, L. Neville, J. Krause. The confusion effect—from neural networks to reduced predation risk (англ.) // Behavioral Ecology. — 2008-01-01. — Vol. 19. — Vol. 1. — P. 126–130. — ISSN 1045-2249. — doi:10.1093/beheco/arm109.
- ↑ David C. Krakauer. Groups confuse predators by exploiting perceptual bottlenecks: a connectionist model of the confusion effect (англ.) // Behavioral Ecology and Sociobiology. — Vol. 36. — Vol. 6. — P. 421–429. — ISSN 0340-5443. — doi:10.1007/BF00177338.
- ↑ Randal S. Olson, Arend Hintze, Fred C. Dyer, David B. Knoester, Christoph Adami. Predator confusion is sufficient to evolve swarming behaviour (англ.) // Journal of The Royal Society Interface. — 2013-08-06. — Vol. 10. — Vol. 85. — ISSN 1742-5689. — doi:10.1098/rsif.2013.0305.
- ↑ 1 2 3 4 Matz Larsson. Possible functions of the octavolateralis system in fish schooling (англ.) // Fish and Fisheries. — 2009-09-01. — Vol. 10, iss. 3. — P. 344–353. — ISSN 1467-2979. — doi:10.1111/j.1467-2979.2009.00330.x.
- ↑ Мантейфель Б. П. «Экология поведения животных», 1980, p. 71.
- ↑ J. G. New, L. Alborg Fewkes, A. N. Khan. Strike feeding behavior in the muskellunge, Esox masquinongy: contributions of the lateral line and visual sensory systems // The Journal of Experimental Biology. — 2001-03-01. — Т. 204. — Vol. 6. — P. 1207–1221. — ISSN 0022-0949.
- ↑ David Babineau, John E. Lewis, André Longtin. Spatial Acuity and Prey Detection in Weakly Electric Fish // PLOS Comput Biol. — 2007-03-02. — Т. 3. — Vol. 3. — P. e38. — ISSN 1553-7358. — doi:10.1371/journal.pcbi.0030038.
- ↑ G. Roberts. Why individual vigilance declines as group size increases // Animal Behaviour. — 1996-05-01. — Т. 51. — Vol. 5. — P. 1077–1086. — doi:10.1006/anbe.1996.0109.
- ↑ Steven L. Lima, Peter A. Bednekoff. Back to the basics of antipredatory vigilance: can nonvigilant animals detect attack? // Animal Behaviour. — 1999-09-01. — Т. 58. — Vol. 3. — P. 537–543. — doi:10.1006/anbe.1999.1182.
- ↑ Douglass H. Morse. Feeding Behavior and Predator Avoidance in Heterospecific Groups // BioScience. — 1977-01-01. — Т. 27. — Vol. 5. — P. 332–339. — doi:10.2307/1297632.
- ↑ W. D. Hamilton. Geometry for the selfish herd // Journal of Theoretical Biology. — 1971-05-01. — Т. 31. — Vol. 2. — P. 295–311. — ISSN 0022-5193.
- ↑ George F. Turner, Tony J. Pitcher. Attack Abatement: A Model for Group Protection by Combined Avoidance and Dilution // The American Naturalist. — 1986-08-01. — Т. 128. — Vol. 2. — P. 228–240. — ISSN 0003-0147. — doi:10.1086/284556.
- ↑ J. Krause, G. D. Ruxton, D. Rubenstein. Is there always an influence of shoal size on predator hunting success? (англ.) // Journal of Fish Biology. — 1998-03-01. — Vol. 52. — Vol. 3. — P. 494–501. — ISSN 1095-8649. — doi:10.1111/j.1095-8649.1998.tb02012.x.
- ↑ "Marine scientists scratch heads over sardines | IOL". Дата обращения: 25 октября 2016.
- ↑ Marine World Heritage - Sardine Run. www.vliz.be. Дата обращения: 25 октября 2016.
- ↑ Alopias pelagicus. Florida Museum of Natural History. Дата обращения: 26 октября 2016.
- ↑ Simon P. Oliver, John R. Turner, Klemens Gann, Medel Silvosa, Tim D'Urban Jackson. Thresher Sharks Use Tail-Slaps as a Hunting Strategy // PLOS ONE. — 2013-07-10. — Т. 8. — Vol. 7. — P. e67380. — ISSN 1932-6203. — doi:10.1371/journal.pone.0067380.
Литература
- Мантейфель Б. П. Экология поведения животных. — Рипол Классик, 1980. — 219 с.
![С помощью длинных усиков веслоногие рачки улавливают изменение давления воды]]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/28/Copepodkils.jpg/200px-Copepodkils.jpg)


