Изобарный процесс
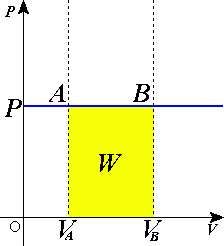

Изобари́ческий или изоба́рный проце́сс (др.-греч. ἴσος «одинаковый» + βάρος «тяжесть») — термодинамический изопроцесс, происходящий в физической системе при постоянном внешнем давлении[1].
Согласно закону Гей-Люссака, в идеальном газе при изобарном процессе отношение объёма к температуре постоянно: .
Если использовать уравнение Клапейрона — Менделеева, то работа, совершаемая газом при расширении или сжатии газа, равна
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии:
Теплоёмкость
[править | править код]Молярная теплоёмкость при постоянном давлении обозначается как В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной R:
- для одноатомных газов , то есть около 20,8 Дж/(моль·К);
- для двухатомных газов , то есть около 29,1 Дж/(моль·К);
- для многоатомных газов , то есть около 33,2 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Изменение энтропии
[править | править код]Изменение энтропии при квазистатическом изобарном процессе равно В случае, если изобарный процесс происходит в идеальном газе, то следовательно, изменение энтропии можно выразить как Если пренебречь зависимостью от температуры (это предположение справедливо, например, для идеального одноатомного газа, но в общем случае не выполняется), то
См. также
[править | править код]Примечания
[править | править код]- ↑ Изобарный процесс : [арх. 3 января 2023] // Излучение плазмы — Исламский фронт спасения. — М. : Большая российская энциклопедия, 2008. — С. 18. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 11). — ISBN 978-5-85270-342-2.
Литература
[править | править код]- Сивухин Д. В. Общий курс физики. — М., 2008. — Т. II. Термодинамика и молекулярная физика.
- Изобарный процесс // Казахстан. Национальная энциклопедия. — Алматы: Қазақ энциклопедиясы, 2005. — Т. II. — ISBN 9965-9746-3-2. (CC BY-SA 3.0)















