Префеновая кислота
| Префеновая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
цис-1-(2-карбокси-2-оксоэтил)-4-гидроксициклогекса-2,5-диен-1-карбоновая кислота |
| Хим. формула | C10H10O6 |
| Физические свойства | |
| Молярная масса | 226,18 г/моль |
| Классификация | |
| Рег. номер CAS | 126-49-8 |
| PubChem | 1028 |
| SMILES | |
| InChI | |
| ChEBI | 16666 и 84387 |
| ChemSpider | 16735981 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Префе́новая кислота (сокр. англ. PPA), по анионным формам называемая также префена́т, — органическая двухосновная кислота, образуется из хоризмата, является предшественником в биосинтезе фенилаланина, тирозина, фенилпропаноидов и других соединений. Шестичленный карбоцикл префената легко подвержен ароматизации в одну стадию. Фенильная группа фенилпирувата, фенилаланина происходит из префената, отсюда и название этого соединения. Название (prephenic acid, prephenate) предложил Бернард Дэвис — американский микробиолог, обнаруживший метаболическую роль шикимовой кислоты и ставший наиболее крупной фигурой в ранних исследованиях шикиматного пути (многие важнейшие метаболиты, в том числе и префеновая кислота, были открыты в его лаборатории)[1].
Стереохимия и изомеры
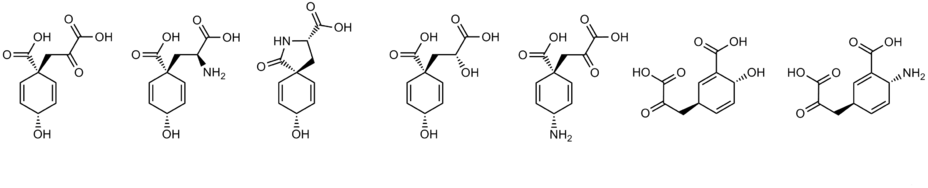
[править | править код]Молекула (в наиболее симметричных конформациях) имеет плоскость симметрии (которая проходит через 6 из 10 атомов углерода), то есть, симметрична при операции отражения (ахиральна), но, тем не менее, по причине различия заместителей при двух тетраэдрических атомах углерода цикла возможно 2 диастереомера (цис-изомер и транс-изомер). Природная префеновая кислота является цис-изомером (старшие группы — четвертичный карбоксил в положении 1 и гидроксильная группа в положении 4 — ориентированы по одну сторону от «плоскости» цикла, нумерация — в соответствии с систематическим названием). Эпимер (транс-изомер), названный эпипрефеновой кислотой, был синтезирован,[2][3] как оказалось, некоторые его химические свойства существенно отличаются[3]. Префеновая, эпипрефеновая, изопрефеновая, хоризмовая, 4-эпихоризмовая, изохоризмовая и псевдохоризмовая кислоты изомерны.
Физические свойства
[править | править код]Молекула ахиральна, поэтому префеновая кислота оптической активностью не обладает[4].[5] В свободном виде не получена, выделяют в форме солей. Соли префеновой кислоты (префенаты) — кристаллические вещества. Соли бария малорастворимы в воде, что используется для осаждения префената из раствора с целью его выделения[4].
Спектральные свойства
[править | править код]1H-ЯМР (D2O, 250 MГц), δ (ppm): 3,12 (2H, s), 4,50 (1H, tt, J1 = 3,1, J2 = 1,4 Гц), 5,92 (2H, dd J1 = 10,4, J2 = 3,1 Гц), 6,01 (2H, d, J1= 10,4, J2 = 1,4 Гц)[3]. Протоны —OH и —CH2—CO— групп префената (натрия) быстро обмениваются с D2O[3].
13C-ЯМР (D2O, 75 MГц), δ (ppm): 203, 178, 173, 132 (для двух идентичных атомов углерода), 127 (для двух идентичных атомов углерода), 65, 49, 48.
- δ — химический сдвиг, H — интеграл (общее число протонов), J — константа расщепления, s — синглет, d — дублет, dd — дублет дублетов, t — триплет.
Химические свойства
[править | править код]Префеновая «кислота» стабильна только в дианионной форме[2]. Склонна к спонтанной и каталитической ароматизации[6]. Период полусуществования (полураспада) в водном растворе при комнатной температуре — 130 ч при рН = 7,0, 13 ч при рН = 6,0, и 1,0 мин в 1 Н HCl[4].
Кислото- и щёлочелабильность
[править | править код]В кислой среде (даже в слабокислой при pH = 6) [4] при комнатной температуре (и при нагревании) префеновая кислота почти количественно ароматизуется в фенилпировиноградную кислоту (фенилпируват) в результате реакции дегидратационного декарбоксилирования (сопряжённое элиминирование)[4].[3] В щелочной среде при нагревании префеновая кислота декарбоксилируется, ароматизуясь в пара-гидроксифенилмолочную кислоту (пара-гидроксифениллактат, здесь сто́ит обратить внимание на структурную близость этого соединения пара-гидроксифенилпирувату)[3].[5]

Эпимер префеновой кислоты (эпипрефеновая кислота) имеет несколько отличные химические свойства: в щелочной среде он практически не ароматизуется, а в кислой, аналогично префеновой кислоте, легко переходит в фенилпировиноградную кислоту с почти количественным выходом[3]. Скорость кислотной ароматизации эпипрефеновой кислоты всё же существенно ниже, чем скорость ароматизации префеновой кислоты в тех же условиях (а также ниже, чем скорости ароматизации лишённых кетоновой функциональности дезоксопрефеновой и эпидезоксопрефеновой кислот, полученных синтетически), что связывают с возможностью вовлечения гидроксильной группы эпипрефеновой кислоты в образование внутримолекулярного полукеталя (в случае префеновой кислоты образование внутримолекулярного полукеталя затруднено из-за транс-расположения реагирующих групп)[7].
Только после обнаружения префената, установления его структуры и основны́х свойств, стало известно, что циклогексадиенолы подобного типа кислотолабильны и чрезвычайно склонны к ароматизации[6].[5] Реакция ароматизации префената в фенилпируват стала первой детально интерпретированной реакцией ароматизации в биохимии[1].
Механизм кислотной ароматизации
[править | править код]Упомянутое дегидратационное декарбоксилирование (сопряжённое элиминирование), катализируемое кислотой, протекает двуступенчато (протонирование гидроксильной группы вызывает её элиминирование — происходит обратимая дегидратация с образованием резонансно стабилизированного карбкатиона (арениевого иона), затем происходит декарбоксилирование, сопровождаемое нейтрализацией зарядов и формированием конечного продукта — фенилпирувата),[7] в отличие от ферментативной (префенатдегидратазной) реакции, которая происходит согласованно (уходящие группы отщепляются синхронно, в одну стадию)[8].
Механизм щелочной ароматизации
[править | править код]Для щелочной ароматизации предложено не менее 5 альтернативных формальных механизмов (на схеме обозначены: a, b, c, d, e). Эпимер префената (эпипрефенат) в щелочной среде не ароматизуется (подкисление водно-щелочного раствора эпипрефената, даже после его нагревания или длительного выстаивания, приводит к почти количественному выходу фенилпирувата — продукта кислотной ароматизации). Этому факту, а также другим экспериментальным результатам удовлетворяют не все 5 предложенных формальных механизмов, лишь 2 механизма (d и e) соответствуют наблюдаемым фактам. Оба возможных механизма щелочной ароматизации префената включают гидридный сдвиг C4-водорода, который в конечном продукте (пара-гидроксифениллактате) оказывается при том тетраэдрическом атоме углерода, при котором находится гидроксильная группа. В случае одного из этих двух механизмов (e) — гидрид переносится непосредственно к указанному карбонильному атому углерода (восстанавливая его) в результате 1,6-гидридного сдвига. В случае другого механизма (d) — гидрид переносится в результате 1,7-гидридного сдвига на карбоксильную группу, восстанавливая её до альдегидной (гемдиол), затем следует перегруппировка Канниццаро, что сопровождается 1,2-гидридным сдвигом. Для эпипрефеновой кислоты 1,6- и 1,7-гидридый сдвиги затруднены из-за транс-расположения переносимого гидрида и акцепторной группы — этим и объясняется относительно высокая стабильность эпипрефената в щелочной среде[9].

Другие химические свойства
[править | править код]Префеновая кислота гидрируется водородом в присутствии платинового катализатора (присоединяет 3—4 молярных эквивалента водорода). Борогидрид натрия (NaBH4) восстанавливает префеновую кислоту по карбонилу, продукт восстановления (префениллактат) способен декарбоксилироваться, ароматизуясь при этом, или присоединять 2 молярных эквивалента Br2[4]. Гидрирование над палладий-барий сульфатом приводит к восстановлению обеих двойных связей в цикле[5].
Биохимия
[править | править код]Синтезируется из хоризмата в результате [3,3]-сигматропной перегруппировки, преимущественно ферментативной. Предшественник фенилаланина, тирозина и множества других соединений (в основном ароматических, бо́льшую часть из которых выделяют в большу́ю группу так называемых фенилпропаноидов)[10].
Для образования аминокислот фенилаланина и тирозина из префената нужны стадии ароматизации и переаминирования. При (ферментативной) ароматизации префената образуются арилпировиноградные кислоты (фенилпируват, пара-гидроксифенилпируват), реакции переаминирования которых дают соответствующие аминокислоты. В случае, когда переаминирование предшествует ароматизации, тогда в качестве общего промежуточного соединения и непосредственного предшественника аминокислот фенилаланина и тирозина образуется аминокислота арогенат (арогеновая кислота). На нижеприведённой схеме обратимость биохимических превращений отмечена в соответствии с KEGG Pathway Архивная копия от 29 апреля 2011 на Wayback Machine. По другим источникам обратимыми являются лишь реакции переаминирования, в то время как реакции ароматизации сопровождаются значительным понижением свободной энергии и для всех практических целей могут рассматриваться как необратимые. Реакция конверсии хоризмата в префенат для всех практических целей также может считаться необратимой по термодинамическим причинам[11].

Для префената, кроме указанной функции предшественника важнейших ароматических соединений, была обнаружена дополнительная функция донора карбоксильной группы в одной из описанных карбокситрансферазных реакций грамотрицательных бактерий. В этой реакции карбоксильная группа переносится с префената на метильную группу S-аденозил-l-метионина (SAM), что приводит к образованию карбокси-S-аденозил-l-метионина (Cx-SAM), сам же префенат при этом ароматизуется в фенилпируват. У грамотрицательных бактерий Cx-SAM участвует в консервативных посттранскрипционных модификациях тРНК. Cx-SAM является донором карбоксиметильной группы при модификации уридина в 5-оксиацетилуридин (5-карбоксиметоксиуридин, cmo5U, V), который присутствует в колебательной позиции антикодоновой петли определённых тРНК[12].
Кроме этого, из префената у некоторых организмов образуются неароматические вторичные метаболиты.
Другие известные природные циклогексадиенолы
[править | править код]В природе открыты и другие циклогексадиенолы, аналогичные префенату. Их синтез происходит шикиматным путём (некоторые образуются модификацией самого́ префената), все они легко ароматизуются и выступают предшественниками в биосинтезе различных метаболитов (в основном ароматических, в меньшей мере алициклических). Кроме префената известны следующие природные циклогексадиенолы, а также им подобные циклогексадиенамины:
- l-арогеновая кислота (арогенат, претирозин) — образуется в результате переаминирования префената, непосредственный предшественник фенилаланина и тирозина у многих организмов (в том числе у цианобактерий и высших растений). Фенилаланин является продуктом кислотной ароматизации арогената[10].
- спиро-арогеновая кислота (спиро-арогенат, пиропретирозин, лактамное производное арогената) — найдена в культуре мутантного штамма Neurospora crassa,[10][13][14] однако до этого это соединение уже было синтезировано и спектрально охарактеризовано[15].[13] Образуется из арогената, предположительно ферментативно, причём арогенат in vitro при определённых условиях (7,5 < pH < 12,0, 100 °C) неферментативно превращается в спиро-арогенат, при более высоких значениях pH наблюдается обратное превращение[10]. В умеренно кислой среде спиро-арогенат ароматизуется в фенилаланин, при кипячении в щелочной среде (pH > 12, 100 °C) гидролизуется, превращаясь в арогенат[13].[10]
- d-префенилмолочная кислота (d-префениллактат, восстановленное по карбонилу производное префената) — найдена в культуре мутантного штамма Neurospora crassa. Кислотолабильность выше, чем у префената. Продукт кислотной ароматизации — d-фенилмолочная кислота (d-фениллактат)[14].[10]
- 4-амино-4-дезоксипрефеновая кислота (4-амино-4-дезоксипрефенат) — образуется в результате [3,3]-сигматропной перегруппировки образуемого из хоризмата 4-амино-4-дезоксихоризмата, предшественник непротеиногенной аминокислоты пара-аминофенилаланин (метаболические производные этого соединения — некоторые известные антибиотики, в том числе хлорамфеникол)[16].
- изопрефеновая кислота (изопрефенат) — образуется в результате [3,3]-сигматропной перегруппировки изохоризмата, предшественник некоторых вторичных метаболитов растений и микроорганизмов (непротеиногенные ароматические аминокислоты определённого типа и другие соединения). Под влиянием кислоты изопрефенат ароматизуется в мета-карбоксифенилпируват[17].
кислота
кислота
кислота
кислота
4-дезоксипрефеновая
кислота
кислота
Известно также, что 2,5-циклогексадиенольные структуры возникают и в некоторых метаболических процессах, не имеющих прямого отношения к шикиматному пути. Образование таких структурных фрагментов играет важную роль в биосинтезе ряда алкалоидов. Структуру такого типа содержит в своём составе, например, салютаридинол — промежуточное соединение в биосинтезе морфина[1].
Открытие, изучение и синтез
[править | править код]Префеновая кислота была впервые описана весной—летом 1953 [1] (публикация — май 1954) [4] года при изучении стадии ароматизации процесса биосинтеза фенилаланина (была впервые выявлена у мутанта Escherichia coli — выделена из культурального фильтрата специально отобранного штамма, у которого были нарушены поздние этапы биосинтеза фенилаланина). Исследователи, открывшие префенат, опираясь на его химические свойства, ИК спектры и УФ спектры поглощения, верно вывели структуру соединения, но без учёта стереохимии[4]. Дальнейший прогресс в изучении шикиматного пути, открытие [18] и описание структуры [19] непосредственного предшественника префената — хоризмата — позволили приписать префеновой кислоте стереохимическую конфигурацию, но всё же эта конфигурация в течение ещё довольно долгого времени не была надёжно подтверждена корректными методами. В 1977,[2] а затем в 1979 [3] годах Сэмюэль Данишефский[англ.] и сотрудники сообщили о проведённом ими первом успешном полном синтезе префената натрия и об окончательном подтверждении конфигурации префеновой кислоты. В основе синтеза Данишефского лежит реакция Дильса — Альдера. Полученное вещество по спектральным и химическим свойствам было идентичным коммерческим образцам (Sigma Chemicals) префената биогенного происхождения, что являлось подтверждением успешного синтеза[3].
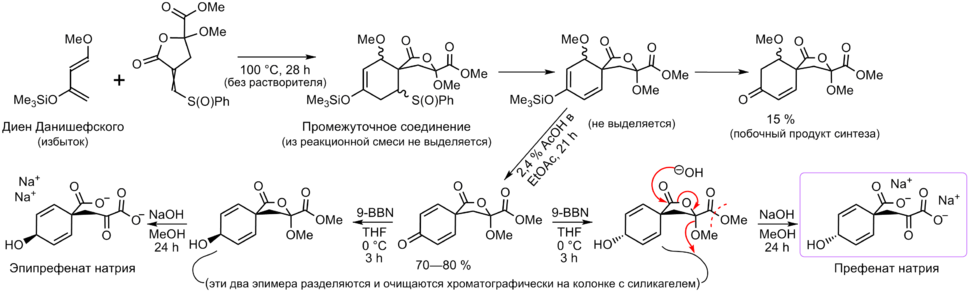
Хотя предложенный метод химического синтеза префеновой кислоты не способен конкурировать с её биотехнологическим производством, он может быть полезен для синтеза структурных аналогов и производных префеновой кислоты,[20] а также для получения изотопно-меченого префената[2]. Аналогичным методом в 1981 году группой Данишефского была синтезирована арогеновая кислота (а также, как промежуточное соединение этого синтеза, была получена спиро-арогеновая кислота, которая на то время ещё не была известна и лишь позже была выделена [13] как метаболит)[15]. К настоящему времени получены с целью изучения различные структурные аналоги префеновой кислоты, например, бензологи (структурные производные 9,10-дигидроантрацена)[9].
Производство и форма выпуска
[править | править код]В диацидной форме нестабильна,[2] в кристаллическом виде получают в форме солей. Выпускается в форме бариевой соли (префенат бария)[3]. Производят при помощи специальных штаммов Neurospora crassa, Escherichia coli, Bacillus subtilis, Salmonella Typhimurium; возможно как прямое выделение из культуральных фильтратов, так и получение метаболического предшественника (хоризмата) с последующей его химической или ферментативной изомеризацией[20].
Применение
[править | править код]Находит применение в исследовательской практике.
Примечания
[править | править код]- ↑ 1 2 3 4 Ulrich Weiss, Heinz G. Floss, Roy A. Jensen, Nikolaus Amrhein, Paul A. Bartlett, Tsune Kosuge and Margaret Sanger, Edwin Haslam, Andrew Pelter, Eckhard Leistner, Harold W. Moore and J. Olle Karlsson, Stewart A. Brown, Davis L. Dreyer, General Editor: Eric E. Conn. The Shikimic Acid Pathway (англ.) // Recent Advances in Phytochemistry : Научный журнал. — 1986. — Vol. 20. — P. 1—347. — doi:10.1007/978-1-4684-8056-6_2. Архивировано 8 июня 2018 года.
- ↑ 1 2 3 4 5 Samuel Danishefsky, Masahiro Hirama. Total synthesis of disodium prephenate (англ.) // Journal of the American Chemical Society : Научный журнал. — 1977. — Vol. 99, no. 23. — P. 7740—7741. — doi:10.1021/ja00465a072. — PMID 915167.
- ↑ 1 2 3 4 5 6 7 8 9 10 Samuel Danishefsky, Masahiro Hirama, Nancy Fritsch, Jon Clardy. Synthesis of disodium prephenate and disodium epiprephenate. Stereochemistry of prephenic acid and an observation on the base-catalyzed rearrangement of prephenic acid to p-hydroxyphenyllactic acid (англ.) // Journal of the American Chemical Society : Научный журнал. — 1979. — Vol. 101, no. 23. — P. 7013—7018. — doi:10.1021/ja00517a039. Архивировано 29 марта 2019 года.
- ↑ 1 2 3 4 5 6 7 8 U. Weiss, C. Gilvarg, E. S. Mingioli, B. D. Davis. Aromatic biosynthesis XI. The aromatization step in the synthesis of phenylalanine (англ.) // Science : Научный журнал. — 1954. — Vol. 119. — P. 774—775. — doi:10.1126/science.119.3100.774. — PMID 13168367.
- ↑ 1 2 3 4 Prof. Dr. H. Plieninger. Prephenic Acid: Properties and the Present Status of its Synthesis (англ.) // Angewandte Chemie International Edition in English : Научный журнал. — 1962. — Vol. 1, no. 7. — P. 367—372. — doi:10.1002/anie.196203671.
- ↑ 1 2 Hans Plieninger and Gunda Keilich. Die Dienol-Benzol-Umlagerung (нем.) // Chemische Berichte : Научный журнал. — 1958. — Bd. 91, Nr. 9. — S. 1891—1897. — doi:10.1002/cber.19580910916.
- ↑ 1 2 Jeffrey D. Hermes, Peter A. Tipton, Matthew A. Fbher, M. H. O’Leary, J. F. Morrison, and W. W. Cleland. Mechanisms of Enzymatic and Acid-Catalyzed Decarboxylations of Prephenate (англ.) // Biochemistry : Научный журнал. — 1984. — Vol. 23, no. 25. — P. 6263—6275. — doi:10.1021/bi00320a057. — PMID 6395898.
- ↑ Jeremy Van Vleet, Andreas Kleeb, Peter Kast, Donald Hilvert, W.W. Cleland. 13C isotope effect on the reaction catalyzed by prephenate dehydratase (англ.) // Biochimica et Biophysica Acta : Научный журнал. — 2010. — Vol. 1804, no. 4. — P. 752—754. — doi:10.1016/j.bbapap.2009.11.018. — PMID 19948253.
- ↑ 1 2 Jinghua Yu. The synthesis of model compounds for the rearrangement of prephenic acid (англ.) // Master’s Theses. — 1998. Архивировано 28 января 2015 года.
- ↑ 1 2 3 4 5 6 Ronald Bentley. The shikimate pathway — a metabolic tree with many branches (англ.) // Critical Reviews in Biochemistry and Molecular Biology : Научный журнал. — 1990. — Vol. 25, no. 5. — P. 307—384. — doi:10.3109/10409239009090615. — PMID 2279393.
- ↑ Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk, Robert N. Goldberg. Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions (англ.) // Journal of Physical Chemistry B : Научный журнал. — 1997. — Vol. 101, no. 50. — P. 10976—10982. — doi:10.1021/jp972501l. (недоступная ссылка)
- ↑ Jungwook Kim, Hui Xiao, Jeffrey B. Bonanno, Chakrapani Kalyanaraman, Shoshana Brown, Xiangying Tang, Nawar F. Al-Obaidi, Yury Patskovsky, Patricia C. Babbitt, Matthew P. Jacobson, Young-Sam Lee & Steven C. Almo. Structure-guided discovery of the metabolite carboxy-SAM that modulates tRNA function (англ.) // Nature : Научный журнал. — 2013. — Vol. 498, no. 7452. — P. 123—126. — doi:10.1038/nature12180. — PMID 23676670.
- ↑ 1 2 3 4 Lolita O. Zamir, Robert Tiberio, Elyse Jung, and Roy A. Jensen. Isolation and Structure Determination of a Novel Spiro-γ-lactam, Spiro-arogenate (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1983. — Vol. 258, no. 10. — P. 6486—6491. — PMID 6222044. Архивировано 24 марта 2020 года.
- ↑ 1 2 Lolita O. Zamir, Elyse Jung, and Roy A. Jensen. Co-accumulation of prephenate, l-arogenate, and spiro-arogenate in a mutant of Neurospora (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1983. — Vol. 258, no. 10. — P. 6492—6496. — PMID 6222045. Архивировано 25 марта 2020 года.
- ↑ 1 2 Samuel Danishefsky, Joel Morris, Lane A. Clizbe. Total synthesis of pretyrosine (arogenate) (англ.) // Journal of the American Chemical Society : Научный журнал. — 1981. — Vol. 103, no. 6. — P. 1602—1604. — doi:10.1021/ja00396a070. Архивировано 14 февраля 2023 года.
- ↑ J. He, N. Magarvey, M. Piraee and L. C. Vining. The gene cluster for chloramphenicol biosynthesis in Streptomyces venezuelae ISP5230 includes novel shikimate pathway homologues and a monomodular non-ribosomal peptide synthetase gene (англ.) // Microbiology : Научный журнал. — 2001. — Vol. 147, no. Pt 10. — P. 2817—2829. — doi:10.1099/00221287-147-10-2817. — PMID 11577160.
- ↑ Lolita O. Zamir, Anastasia Nikolakakis, Carol A. Bonner, Roy A. Jensen. Evidence for enzymatic formation of isoprephenate from isochorismate (англ.) // Bioorganic & Medicinal Chemistry Letters : Научный журнал. — 1993. — Vol. 3, no. 7. — P. 1441—1446. Архивировано 24 сентября 2015 года.
- ↑ Margaret I. Gibson, Frank Gibson. A new intermediate in aromatic biosynthesis (англ.) // Biochimica et Biophysica Acta : Научный журнал. — 1962. — Vol. 19, no. 65. — P. 160—163. — doi:10.1016/0006-3002(62)90166-X. — PMID 13947735.
- ↑ F. Gibson and L. M. Jackman. Structure of chorismic acid, a new intermediate in aromatic biosynthesis (англ.) // Nature : Научный журнал. — 1963. — Vol. 198. — P. 388—389. — doi:10.1038/198388a0. — PMID 13947720.
- ↑ 1 2 Tiner-Harding T., Glover G. I., Campbell P. A novel method for purification of prephenic acid. (англ.) // Preparative biochemistry : Научный журнал. — 1979. — Vol. 9, no. 1. — P. 33—41. — doi:10.1080/00327487908061670. — PMID 155813.
Литература
[править | править код]- Бартон Д., Оллис У. Д., Хаслам Э. (ред.). Общая органическая химия = Comprehensive organic chemistry / Перевод с английского под ред. Н. К. Кочеткова. — М.: «Химия», 1986. — Т. 11 (Липиды, углеводы, макромолекулы, биосинтез). — С. 685—724. — 736 с.
- Мецлер Д. Биохимия. Химические реакции в живой клетке = Biochemistry. The chemical reactions of living cells / Перевод с английского под ред. акад. А. Е. Браунштейна, д-ра хим. наук Л. М. Гинодмана, д-ра хим. наук Е. С. Северина. — М.: «Мир», 1980. — Т. 3. — 488 с. — 25 000 экз.

