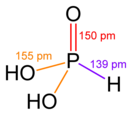
Фосфористая кислота
| Фосфористая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
фосфоновая кислота | ||
| Традиционные названия | ортофосфористая кислота, фосфористая кислота | ||
| Хим. формула | H2(PHO3) | ||
| Физические свойства | |||
| Состояние | твердое | ||
| Молярная масса | 82.00 г/моль | ||
| Плотность | 1.65 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 70,1 °C | ||
| • кипения | 200 °C[1] | ||
| • разложения | са 100 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 2.0, 6.7 | ||
| Растворимость | |||
| • в воде | са 80 (20оС) | ||
| Классификация | |||
| Рег. номер CAS | [13598-36-2] | ||
| PubChem | 407 | ||
| Рег. номер EINECS | 237-066-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | SZ6400000 | ||
| ChEBI | 44976 | ||
| Номер ООН | 2834 | ||
| ChemSpider | 10449259 | ||
| Безопасность | |||
| ЛД50 | 100 мг/кг | ||
| Токсичность | ПДК 0,4 мг/м³ | ||
| Краткие характер. опасности (H) |
H290, H302, H314 |
||
| Меры предостор. (P) |
P280, P305+P351+P338, P310 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фо́сфористая кислотá (фосфóновая кислотá, óртофо́сфористая кислотá; H3PO3, H2(HPO3)) — в водных растворах двухосновная кислота средней силы.
Фосфористая кислота сильно раздражает кожу и слизистые оболочки. Вещество относится ко второму классу опасности.
Свойства[править | править код]
Безводная фосфористая кислота — бесцветные гигроскопичные кристаллы. Несмотря на то, что кислота содержит три атома водорода — она двухосновная.
Фосфористая кислота является кислотой средней силы и диссоциирует по двум ступеням:
Константы диссоциации фосфористой кислоты при 18 °C: K1 = 5,1⋅10−2 K2 = 1,8⋅10−7.
При нагревании до 250 °C безводная фосфористая кислота разлагается на фосфорную кислоту и фосфин, а водные её растворы — на фосфорную кислоту и водород.
Фосфористая кислота легко окисляется галогенами, оксидами азота и пр. до фосфорной кислоты, кислородом окисляется до фосфорноватой кислоты:
Соли фосфористой кислоты называются фосфитами или (по рекомендации ИЮПАК) фосфонатами. Большинство фосфитов малорастворимы в воде. Известны одно- и двузамещённые фосфиты.
Фосфористая кислота и её соли являются сильными восстановителями. Однако активные металлы в кислом растворе восстанавливают H3РО3 до РH3.
История изучения[править | править код]
Проблема выяснения структурной формулы фосфористой кислоты и доказательства её двухосновного характера долгое время вызывала серьёзные споры в профессиональной среде вплоть до конца XIX века. В частности, в 1866 г. русский химик Н. А. Меншуткин в своей диссертации «О водороде фосфористой кислоты, не способном к металлическому замещению при обыкновенных условиях для кислот» пришёл к неверному выводу о трёхгидроксильной структуре кислоты и отстаивал свою точку зрения.[2]
Противоречия были окончательно разрешены только к 1905 году, когда А. Е. Арбузов защитил при Казанском университете магистерскую диссертацию «О строении фосфористой кислоты и её производных». В этой работе диссертант впервые получил в чистом виде эфиры фосфористой кислоты, открыл явление их каталитической изомеризации в эфиры алкилфосфиновых кислот и нашел специальную реакцию для соединений трёхвалентного фосфора ― образование комплексных соединений с галоидными солями закиси меди. Исследование А. Е. Арбузова было удостоено Русским физико-химическим обществом премии им. Зинина и Воскресенского.[2]
Кроме выяснения структуры фосфористой кислоты, диссертация А. Е. Арбузова фактически открыла путь для искусственного синтеза принципиально новой ветви органических соединений. Применённая в качественном анализе фосфористой кислоты так называемая реакция Арбузова не только дала ключ к пониманию структуры органических соединений фосфора, но и подтвердила незыблемость положений теории органических связей А. М. Бутлерова. Решение теоретической проблемы строения неорганической кислоты, в конечном счёте дало принципиальный ключ к пониманию структуры и дальнейшему лабораторному и промышленному синтезу соединений фосфора. В XX веке реакция Арбузова оказалась положена в основание широчайшей ветви мирового синтеза ФОС ― фосфорорганических соединений.[3]
Эфиры фосфористой кислоты[править | править код]
При взаимодействии спиртов с чистым PCl3 получаются моно-, ди- и триэфиры фосфористой кислоты с общей формулой P(OR)3, легко образующие комплексы с переходными металлами и другими акцепторами. Они также легко окисляются до соответствующих фосфатов:
При взаимодействии эфиров с алкилгалогенидами образуются алкилфосфонаты:
Получение[править | править код]
Получают фосфористую кислоту растворением P4O6 (P2O3) в холодной воде, гидролизом PCl3 или взаимодействием фосфитов с серной или соляной кислотами:
Применение[править | править код]
Фосфористую кислоту и её соли применяют как восстановители, а также широчайшим образом — в синтезе фосфорорганических соединений, путь для которого открыло исследование 1904-1905 года, получившее впоследствии название «реакции Арбузова». Говоря химическим языком, эта реакция заключается в алкилировании триалкилфосфитов алкилгалогенидами с образованием диалкилфосфонатов, — иными словами, в превращении средних эфиров фосфористой кислоты в эфиры алкилфосфиновых кислот под действием галоидных алкилов.[3]
Безопасность[править | править код]
Ортофосфористая кислота сильно раздражает кожу и слизистые оболочки. ПДК в воздухе - 0,4 мг/м³.
Вещество относится ко второму классу опасности по ГОСТ 12.1.007-76.
Примечания[править | править код]
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 4—77. — ISBN 978-1-4987-5428-6
- ↑ 1 2 А. Е. Арбузов, Краткий очерк развития органической химии в России (монография). — М.-Л: 1948 г.
- ↑ 1 2 Борис Горзев. «Реакция Арбузова» (редакционная колонка). — М.: «Химия и жизнь», № 8, 1967 год
Источники[править | править код]
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия, 1994
В статье не хватает ссылок на источники (см. рекомендации по поиску). |