Антителозависимое усиление инфекции: различия между версиями
| [непроверенная версия] | [непроверенная версия] |
| Строка 68: | Строка 68: | ||
==== Быстрый гуморальный ответ на S-белок может вредить больным ==== |
==== Быстрый гуморальный ответ на S-белок может вредить больным ==== |
||
В пользу того, что антитела к S-белку могут вредить пациентам, вызывая ADE, говорят и следующие наблюдения. Сравнительный анализ специфического [[Гуморальная регуляция|гуморального]] ответа показал, что у пациентов, умерших от SARS-CoV-1 инфекции, специфические нейтрализующие антитела к S-белку вырабатывались значительно быстрее, чем у выздоровевших людей<ref name=":11">{{Статья|ссылка=http://dx.doi.org/10.1002/jmv.20499|автор=Linqi Zhang, Fengwen Zhang, Wenjie Yu, Tian He, Jian Yu|заглавие=Antibody responses against SARS coronavirus are correlated with disease outcome of infected individuals|год=2005|издание=Journal of Medical Virology|том=78|выпуск=1|страницы=1—8|issn=0146-6615, 1096-9071|doi=10.1002/jmv.20499}}</ref>. В результате сравнительного анализа специфического гуморального ответа шести больных SARS было выявлено, что на 15-й день заболевания у пациентов, впоследствии умерших, титр антител к S-белку был значимо выше, чем у тех, кто впоследствии выздоровел. При этом хотя титр нейтрализующих антител в течение заболевания у пациентов, в последствии умерших, рос быстрее, по сравнению с титром, у впоследствии выздоровевших пациентов, он также быстрее падал. В то же время, у пациентов, которые впоследствии выздоровели, титр антител увеличивался медленнее, но вырастал до более высокого уровня и дольше держался на этом уровне. Такая динамика изменения титров антител была характерна как для IgM, так и IgG антител<ref name=":11" />. Можно предположить, что у пациентов, в последствии умерших, развилось антителозависмоу усиление вирусной инфекции в тяжелой форме и быстрая выработка антител к S-белку способствовала этому. Возможно, замедленный рост титра способствовал выработке антител с более высокой константной связывания, соостветствующей более прочным комплексам антиген-антитело. Похожие результаты были получены и при измерении количества [[IgG]] антител к S-белку вируса SARS-CoV-2, обнаруженных в [[Сыворотка крови|сыворотке]] 29 госпитализированных пациентов в интервале от 10 до 15 дня после появления симптомов. Было показано, что титр антител линейно [[Корреляция|коррелировал]] с тяжестью заболевания, чем выше был титр, тем тяжелее протекала болезнь<ref name=":9">{{Cite web|url=http://dx.doi.org/10.1101/2020.03.30.20047365|title=Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications|author=Fan Wu, Aojie Wang, Mei Liu, Qimin Wang, Jun Chen, Shuai Xia|date=2020-04-06|publisher=dx.doi.org|accessdate=2020-04-30}}</ref>. У пожилых пациентов титр антител антител в интервале от 10 до 15 дня после появления симптомов был выше чем у молодых. Кроме того, была обнаружена положительная и значимая корреляция между количеством антител в крови и концентрацией маркера воспаления [[C-реактивный белок|цитореактивного белка C]]<ref name=":9" />. В то же время, была выявлена значимая негативная корреляция между титром антител и числом лимфоцитов<ref name=":9" />. Такая иммунопатология так же может быть результатом антителозависимого усиления инфекции. |
В пользу того, что антитела к S-белку могут вредить пациентам, вызывая ADE, говорят и следующие наблюдения. Сравнительный анализ специфического [[Гуморальная регуляция|гуморального]] ответа показал, что у пациентов, умерших от SARS-CoV-1 инфекции, специфические нейтрализующие антитела к S-белку вырабатывались значительно быстрее, чем у выздоровевших людей<ref name=":11">{{Статья|ссылка=http://dx.doi.org/10.1002/jmv.20499|автор=Linqi Zhang, Fengwen Zhang, Wenjie Yu, Tian He, Jian Yu|заглавие=Antibody responses against SARS coronavirus are correlated with disease outcome of infected individuals|год=2005|издание=Journal of Medical Virology|том=78|выпуск=1|страницы=1—8|issn=0146-6615, 1096-9071|doi=10.1002/jmv.20499}}</ref>. В результате сравнительного анализа специфического гуморального ответа шести больных SARS было выявлено, что на 15-й день заболевания у пациентов, впоследствии умерших, титр антител к S-белку был значимо выше, чем у тех, кто впоследствии выздоровел. При этом хотя титр нейтрализующих антител в течение заболевания у пациентов, в последствии умерших, рос быстрее, по сравнению с титром, у впоследствии выздоровевших пациентов, он также быстрее падал. В то же время, у пациентов, которые впоследствии выздоровели, титр антител увеличивался медленнее, но вырастал до более высокого уровня и дольше держался на этом уровне. Такая динамика изменения титров антител была характерна как для IgM, так и IgG антител<ref name=":11" />. Можно предположить, что у пациентов, в последствии умерших, развилось антителозависмоу усиление вирусной инфекции в тяжелой форме и быстрая выработка антител к S-белку способствовала этому. Возможно, замедленный рост титра способствовал выработке антител с более высокой константной связывания, соостветствующей более прочным комплексам антиген-антитело. Похожие результаты были получены и при измерении количества [[IgG]] антител к S-белку вируса SARS-CoV-2, обнаруженных в [[Сыворотка крови|сыворотке]] 29 госпитализированных пациентов в интервале от 10 до 15 дня после появления симптомов. Было показано, что титр антител линейно [[Корреляция|коррелировал]] с тяжестью заболевания, чем выше был титр, тем тяжелее протекала болезнь<ref name=":9">{{Cite web|url=http://dx.doi.org/10.1101/2020.03.30.20047365|title=Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications|author=Fan Wu, Aojie Wang, Mei Liu, Qimin Wang, Jun Chen, Shuai Xia|date=2020-04-06|publisher=dx.doi.org|accessdate=2020-04-30}}</ref>. У пожилых пациентов титр антител антител в интервале от 10 до 15 дня после появления симптомов был выше чем у молодых. Кроме того, была обнаружена положительная и значимая корреляция между количеством антител в крови и концентрацией маркера воспаления [[C-реактивный белок|цитореактивного белка C]]<ref name=":9" />. В то же время, была выявлена значимая негативная корреляция между титром антител и числом лимфоцитов<ref name=":9" />. Такая иммунопатология так же может быть результатом антителозависимого усиления инфекции. Более раннее появление антител IgG у пациентов с тяжело протекающей болезнью по сравнению с теми, у которых она протекала легко наблюдалось и на выборке 285 человек <ref>{{Статья|ссылка=https://www.nature.com/articles/s41591-020-0897-1|автор=Quan-Xin Long, Bai-Zhong Liu, Hai-Jun Deng, Gui-Cheng Wu, Kun Deng|заглавие=Antibody responses to SARS-CoV-2 in patients with COVID-19|год=2020-06|язык=en|издание=Nature Medicine|том=26|выпуск=6|страницы=845–848|issn=1546-170X|doi=10.1038/s41591-020-0897-1}}</ref>. |
||
==== Изменчивость S-белка может обеспечивать антигенное разнообразие, провоцирующее ADE ==== |
==== Изменчивость S-белка может обеспечивать антигенное разнообразие, провоцирующее ADE ==== |
||
Версия от 02:29, 14 августа 2020
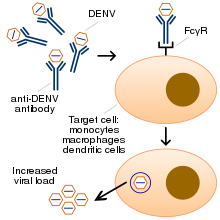
Антителозависимое усиление инфекции (antibody-dependent enhancement, ADE) — явление, при котором связывание вируса с не полностью нейтрализующими антителами вызывает его проникновение в иммунные клетки инфицируемого организма и вирусную репликацию[1][2]. ADE может проявляться в процессе развития первичной или вторичной вирусной инфекции, а также после вакцинации при взаимодействии вирусного патогена с иммунной системой инфицируемого организма[1][2].
История
Феномен впервые описан R. A. Hawkes в 1964 году, который обнаружил повышение продукции различных флавивирусов в клетках куриного эмбриона, впервые экспонированных к вирусам, находящимся в среде с низким содержанием специфических антител[3]. Впоследствии он привёл доказательства, что увеличение «выхода» вируса в подобных экспериментах вызвано образованием комплекса «вирус-антитело»[4].
Тем не менее, в конце 1960-х и начале 1970-х годов уже другими исследователями обнаружена роль ADE в патогенезе тяжёлых форм геморрагической лихорадки, вызванной вирусом лихорадки Денге. Было установлено, что наличие антител в сыворотке крови выздоровевшего, оставшихся после легко перенесённых случаев лихорадки Денге, приводит к тяжёлому течению болезни, если произошло повторное заражение, но вирусом лихорадки Денге другого серотипа[5][6].
Эта проблема приводит к тому, что создать безопасную вакцину против вируса лихорадки Денге крайне сложно.[7] Компания Санофи Пастер (Франция) попыталась это сделать и создала вакцину, которая содержала антигены ко всем четырём серотипам вируса лихорадки Денге. Вакцина этой компании получила название Денгваксия (Dengvaxia).[8] Серьёзным недостатком Денгваксии является то, что она действует точно так же, как естественная первичная инфекция, и резко увеличивает риск развития тяжёлой вторичной инфекции, которая связана с более тяжёлой формой лихорадки Денге. Причина этого явления, по мнению авторов обзора литературы,[8] связана с явлением антителозависимого усиления инфекции.
Так, в рамках клинического исследования была проведена вакцинация более 10 000 детей в возрасте 2-14 лет в пяти странах Азиатско-Тихоокеанского региона. Анализ данных, который провели специалисты из компании Санофи Пастер, показал, что вакцинирование детей, которым было меньше чем 9 лет, приводило к их частому тяжёлому заболеванию и госпитализации по причине лихорадки Денге. Причём частота этой госпитализации в два раз превышала частоту госпитализации детей из контрольной группы, в которой дети не были вакцинированы.[8] В другой статье[9] данные объяснялись тем, что чем младше ребенок, тем менее вероятно, что он уже сталкивался с инфекцией Денге и тем более вероятно, что вакцина сделала его столкновение с инфекцией гораздо более опасным по-сравнению с невакцинированным ребенком.
В научном журнале «New England Journal of Medicine» сообщается, что департамент здравоохранения Филиппин начал программу массовой вакцинации Денгваксией в апреле 2016 года, которая включила приблизительно 830 тысяч детей, но приостановил программу в конце 2017 года. Остановка программы вакцинации произошла, когда Санофи Пастер обнародовала результаты вакцинации. Оказалось, что вакцина в какой-то степени защищала детей старшего возраста, но часто вредила здоровью детей младшего возраста, у которых не было иммунитета к вирусу лихорадки Денге.[10] Согласно рекомендациям ВОЗ существует повышенный риск госпитализации и развития тяжёлой формы лихорадки Денге у серонегативных лиц, начиная примерно через 30 месяцев после получения первой дозы вакцины.[1]Серонегативными называются люди не имеющие антител на определенный инфекционный агент. История получила широкую международную огласку как «Dengvaxia controversy» (также «Dengvaxia issue» или «Dengvaxia mess»)[11][12][13].
В настоящее время вакцина Денгваксия, согласно информации Центра по предотвращению инфекционных заболеваний США (CDC), рекомендуется к применению только людям, серопозитивным по отношению к вирусу лихорадки Денге, то есть людям, которые уже сталкивались с соответствующим вирусом и выработали антитела.[14] Считается, что у этих людей вакцина предотвратит заболевание при встрече с новой инфекцией или ослабит тяжесть его течения. Однако поиски безопасной и эффективной вакцины против вируса Денге продолжаются и, не исключено, что они увенчаются успехом.[15][16]
«Список вирусов человека и животных, которые могут вызывать ADE, довольно длинный и включает вирусы гриппа А, вирусы Коксаки, респираторно-синцитиальный вирус, вирус Эбола и др.»[17][18][19].
С начала 2020 года, когда в мире стала стремительно распространяться эпидемия COVID-19[20], вызванная коронавирусом SARS-CoV-2, с 11 марта 2020 года охарактеризованная Всемирной организацией здравоохранения (ВОЗ) как пандемия COVID-19[21][22], интерес к феномену антителозависимого усиления инфекции (ADE) многократно возрос. Это связано, в первую очередь, с заявленным началом разработки различными ведущими научными центрами вакцины против нового коронавируса, где одним из важнейших факторов, определяющих её безопасность, является отсутствие феномена ADE[23]. В России в 2012 году было издано «Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты)». В разделе «Феномен антителозависимого усиления инфекции при доклиническом изучении иммунобиологических лекарственных препаратов» приведён алгоритм исследования феномена ADE в клеточной культуре и в экспериментах с животными. Обсуждение проблемы антителозависимого усиления инфекции при разработке вакцин против SARS-CoV-2 и терапии моноклональными антителами подробно изложено в опубликованной работе в журнале Nature [24].
Квази-виды и антителозависимое усиление инфекции
Вирусы способные вызывать ADE обладают некоторыми общими чертами, такими как способность реплицирования в макрофагах и некоторых других иммунных клетках, способность к персистрированию и антигенное разнообразие[1]. Как может достигаться это антигенное разнообразие? При заражении нового хозяина происходит инфицирование не одним вариантом вируса, а целой популяцией генетически близкородственных вариантов, возникающих в результате мутаций в ходе репликации вируса в организме предыдущих хозяев[25]. Такая популяция получила название квази-вида. Концепция квази-видов по отношению к вирусным вариантам очень важна, поскольку она помогает понять, что для ускользания от иммунитета нового вирусного хозяина, вирусу вовсе не обязательно приобретать новые мутации, он может воспользоваться уже существующими, которые произошли при репликации у предыдущих хозяев. Некоторые варианты вирусных квази-видов могут быть нейтрализованы антителами нового хозяина, а другие варианты вируса, с худшей аффинностью к антителам, после неполноценной нейтрализации могут проникнуть в имунные клетки и вызвать ADE. Кроме мутаций вирусные варианты квазивидов могут различаться гликозилированием аминокислотных остатков в антигенных детерминантах, а также их конформациями.
Антителозависимое усиление инфекции у коронавирусов
Феномен антителозависимое усиление инфекции описан для вирусов с геномом, несущим (+) цепь РНК, включая коронавирусов[26][27][28][29][30]. ADE у коронавирусов вызывают антитела к шиповидному (S) белку. Не исключено, что этому способствует антигенная изменчивость S-белка за счет некоторых мутаций, разных вариантов гликозилирования и/или смены конформаций. Антитела, выработанные на вакцинный вариант вируса с одними антигенными детерминантами S-белка, могут утратить свойство нейтрализовать вирус при инфекции вирусами с видоизмененным белком. Такие антитела могут по-прежнему связываться с вирусом, но при этом иметь меньшую аффинность и образовывать менее стабильные комплексы по сравнению с комплексами, которые они образуют с «вакцинной» формой вируса. В результате комплекс антитело-вирус может выступать в качестве «троянского коня», помогая вирусу проникнуть в моноциты, макрофаги (а также другие иммунные клетки хозяина), запуская в этих клетках инфекционный процесс.
Антителозависимое усиление инфекции у альфа-коронавирусов
Вирус инфекционного перитонита кошек (Feline infectious peritonitis (FIP) или (FIPV))[31][32] представляет собой альфа-коронавирус, которым часто заражаются как домашние, так и дикие кошки[33]. У многих животных заболевание проходит бессимптомно или вызывает слабое кишечное расстройство. Однако вакцинация против FIPV усугубляет тяжесть заболевания и часто приводит к летальному исходу[34]. Это явление объясняют ADE, поскольку показано, что in vitro инфицирование макрофагов вирусом FIPV может быть инициировано моноклональными антителами, нацеленными на шиповидный S-белок[35][36]. Интересно, что в основном ADE вызывали антитела подкласса IgG2а, способные нейтрализовать вирус, в то время как протестированные антитела подкласса IgG1 не вызывали такого эффета[36]. Эффект ADE также объясняет, почему у половины кошек после экспериментального заражения FIPV развивается перитонит в случае, если их предварительно пассивно иммунизировали антивирусными антителами[37]. В некоторых странах производится вирусная вакцина против FIPV, основанная на аттенуированном вирусе и применяемая в форме капель для носа. Однако использование этой вакцины, как с точки зрения безопасности, так и эффективности, остаётся спорным вопросом[34][38].
Антителозависимое усиление инфекции у бета-коронавирусов
Некоторые бета-коронавирусы способны провоцировать антителозависимое усиление инфекции. Это явление для вирусов SARS-CoV-1 и MERS-CoV, вызывающих соответственно тяжёлый острый респираторный синдром (SARS) и ближневосточный респираторный синдром (MERS), описано во множестве опубликованных работ[39][40][41][42][43].Так антитела к S-белку SARS-CoV-1 способствовуют проникновению вируса в В-клетки[30][44],моноциты[40][41][45], и макрофаги[39][41][30]. В этих клетках вирус реплицируется, но не дает продуктивной инфекции. Это может быть связано с тем, что макрофаги не экспрессируют в достаточном количестве сериновых протеаз, необходимых для активации вирионов. Однако, не исключено, что неактивные вирионы могут активироваться и становиться инфекционными при проникновении в клетки дыхательного эпителия, в мембранах которых присутствуют нужные для активации протеазы. В то же время, репликация вируса, даже без образования инфекционных вирионов, может приводить к массовой гибели иммунных клеток, несущих рецептор Fc𝛾RIIγ. Некоторые моноклональные антитела к S-белку SARS-CoV-1[45] и МERS-CoV[46] также провоцируют ADE.
Существуют примеры того, что антитела класса IgG на антигены S-белка SARS-CoV-1 вызывают тяжёлое повреждение лёгких, опосредованное макрофагами у макак[47][48]. Несмотря на то, что вакцинация инактивированным вирусом[48] и векторным конструктом[47] снижала вирусную нагрузку после заражения SARS-CoV-1, наличие IgG антител к S-белку у иммунизированных макак значительно усиливало воспалительное повреждение лёгких при реальной инфекции. Интересно, что вирусная инфекция после вакцинации антигенами S-белка других модельных животных приводила к сходным негативным результатам[49][50].
У людей иммунодоминантный эпитоп SARS-CoV-1 S-белка индуцировал продукцию как специфических нейтрализующих антител, так и антител, усиливающих инфекцию макрофагов in vitro[51]. ADE может возникнуть в течении первичной инфекции или при повторном заражении после естественной инфекции. У кроликов, интраназально инфицированных MERS-CоV, развивалась лёгочная патология, характеризующаяся виремией и тяжёлым воспалением лёгких. При повторном заражении MERS-CоV, несмотря на наличие антител, кролики заболевали снова и повреждения лёгких были более тяжёлыми, чем во время первичной инфекции[52]. Инфекция вирусами SARS-CоV-1[49] или MERS-CoV[53] вызывала более тяжёлую пневмонию у вакцинированных животных, несмотря на высокий уровень специфических нейтрализующих антител.
Механизм антителозависимого усиления инфекции у коронавирусов
Существуют различные гипотезы о том, как происходит ADE, и вполне вероятно, что существует более одного механизма. Ниже описан механизм, который связан с FcγRII рецепторами иммунных клеток и S-белком коронавирусов.
Рецептор иммунных клеток FcγRII/СD32 способствует их заражению и ADE
Было показано, что специфические антитела (IgG) при ADE формируют несовершенные, непрочные комплексы с вирусом, помогая ему заражать иммунные клетки хозяина, несущие рецептор Fc𝛾RII[28][40][41]. Клетки, экспрессирующие этот рецептор (FcγRII/СD32), представлены моноцитами, макрофагами, некоторыми категориями дендритных клеток и B-лимфоцитов. Комплекс антитела с вирусом связывается с Fc𝛾II рецептором и фагоцитируется СD32+ клетками[28][40][41][42][43][46]. В норме этот процесс приводит к разрушению вируса внутри иммунной клетки и выздоровлению. Однако при патологии, вирус, освободившись от антитела, начинает репликативный цикл внутри поглотившей его иммунной клетки[39][28][40][41]. Этот процесс описан для разных альфа- и бета-коронавирусов, включая SARS-CoV-1[28][40][41][42]. Он может приводить к массовой гибели иммунных клеток и, как следствие этой гибели, вызывать цитокиновый шторм.
Специфические нейтрализующие антитела связывают вирус намного прочнее, и вирус полностью теряет способность инфицировать клетки. Более того, вирус, будучи внутри моноцита или макрофага, не может высвободиться после поглощения комплекса вирус-антитело и подвергается разрушению. Таким образом, комплекс вируса с специфическими нейтрализующими антителами приводит к элиминации вируса из организма, а комплекс с несовершенными антителами, у которых константа связывания (константа ассоциации, Ка) ниже по сравнению с нейтрализующими антителами, — к репликации вируса в клетках иммунной системы, усилению инфекции и возможному цитокиновому шторму.
Экспрессия двух видов рецепторов FcγRIIa и FcγRIIb, но не FcγRI или FcγRIIIa, индуцировала ADE, вызванное SARS-CoV-1[54]. При этом было показано, что тяжесть заболевания SARS зависит от аллельного полиморфизма FcγRIIa; у индивидуумов с изоформой FcγRIIa рецептора, который взаимодействует как с IgG1, так и с IgG2, развивается более тяжёлое заболевание, чем у индивидуумов с изоформой FcγRIIa рецептора, который связывается только с IgG2[55].
S-белки коронавирусов отвечают за ADE
На основании анализа литературы[56] некоторые исследователи делают вывод о том, что для SARS-CoV-1, MERS-CoV и SARS-CoV-2 существует универсальный механизм заражения иммунных клеток, который приводит к ADE. Этот механизм был частично изучен на примере меняющихся иммунодоминантных антигенных детерминант рецептор-связывающего домена (RBD) S-белка вирусов SARS-CoV-1 и MERS-CoV[39][43][46][57].
У вирусов SARS-CoV-1 и SARS-CoV-2 этот домен высоко гомологичен и отвечает за связывание одного и того же мембранного клеточного рецептора ACE2, который является «входной дверью» для обоих вирусов[58]. Конформационные изменения RBD, которые могут приводить к ADE у вируса, вызывающего SARS, обнаружены также и у вируса, вызывающего COVID-19[49].
Механизм ADE описан также для RBD S-белка MERS-CoV[46]. В работе показано, что моноклональные нейтрализующие антитела, специфичные к RBD, опосредуют проникновение вируса в иммунные клетки, функционально имитируя вирус-специфические рецепторы. Авторы считают, что антитела, направленные против других участков S-белка и не связанные с его конформационными изменениями, с меньшей вероятностью будут приводить к ADE. Также показан доза-зависимый эффект степени тяжести ADE от концентрации антител[46].
S-белок бетакоронавирусов существует в виде тримера и состоит из трёх цепей, каждая из которых, в свою очередь, образует две cубъединицы S1 и S2[59]. Субъединица S1 несёт рецептор-связывающий домен (RBD). Между субъединицами S1 и S2 находится сайт разрезания сериновыми протеазами. Вирус приобретает способность инфицировать клетки только после того, как происходит протеолитическое расщепление и каждая молекула белка разделяется на две субъединицы. S1 может находиться в двух конформациях — открытой и закрытой. Биофизическое исследование структуры S-белка SARS-CoV-2 и анализ структуры с разрешением в 3.5 A показали, что наиболее часто встречается S-белок, у которого одна из молекул тримера RBD находится в открытой конформации[59].
Можно предположить, что антигенные детерминанты S-белка будут меняться в результате смены одной его конформации на другую. Специфические нейтрализующие антитела хозяина могут в этом случае утрачивать аффинность к вирусу и начинать образовывать с ним несовершенные и нестабильные комплексы, что приведёт к ADE.
Заметим, что теоретически ADE может быть обусловлено не только наличием ряда конформаций S-белка, но и разными вариантами гликозилирования этого белка поскольку в белке идентифицировали 22 сайта гликозилирования[60]. С одной стороны, известно, что углеводные цепи белков затрудняют связывание антител с эпитопами и тем самым способствуют образованию низкоаффинных комплексов антитело-вирус, то есть «работают» на ADE. С другой стороны, сами углеводные цепи могут входить в состав антигенных детерминант, а их отсутствие в составе белка будет опять-таки приводить к снижению аффинности связывания антитела с антигеном — и это снова «игра в одни ворота». Не исключено, что замены аминокислот в последовательности S-белка в результате антигенного дрейфа[61] также могут приводить к ADE. Так что вакцины, выработанные на один вариант белка, могут провоцировать выработку антител, которые при реальной инфекции вариантом вируса с видоизмененными антигенными детерминантами будут слабее связывают вирус.
Возможная роль ADE в патогенезе SARS и COVID-19
Патогенез заболеваний SARS и COVID-19, по мнению авторов некоторых работ[56], связан с ADE, проявляющемся в инфекции макрофагов и моноцитов. Авторы работы считают, что эта инфекция является ключевым шагом в развитии болезни и её эволюции от лёгкой формы до тяжёлой с критическими симптомами. ADE может объяснить наблюдаемое нарушение регуляции иммунитета, включая апоптоз иммунных клеток, способствующий развитию Т-клеточной лимфопении (лимфоцитопении)[62], воспалительный каскад с накоплением макрофагов и нейтрофилов в лёгких, а также цитокиновый шторм[63]. Ранее другие исследователи тоже выссказывали похожую гипотезу в отношении SARS[30][64].
Быстрый гуморальный ответ на S-белок может вредить больным
В пользу того, что антитела к S-белку могут вредить пациентам, вызывая ADE, говорят и следующие наблюдения. Сравнительный анализ специфического гуморального ответа показал, что у пациентов, умерших от SARS-CoV-1 инфекции, специфические нейтрализующие антитела к S-белку вырабатывались значительно быстрее, чем у выздоровевших людей[65]. В результате сравнительного анализа специфического гуморального ответа шести больных SARS было выявлено, что на 15-й день заболевания у пациентов, впоследствии умерших, титр антител к S-белку был значимо выше, чем у тех, кто впоследствии выздоровел. При этом хотя титр нейтрализующих антител в течение заболевания у пациентов, в последствии умерших, рос быстрее, по сравнению с титром, у впоследствии выздоровевших пациентов, он также быстрее падал. В то же время, у пациентов, которые впоследствии выздоровели, титр антител увеличивался медленнее, но вырастал до более высокого уровня и дольше держался на этом уровне. Такая динамика изменения титров антител была характерна как для IgM, так и IgG антител[65]. Можно предположить, что у пациентов, в последствии умерших, развилось антителозависмоу усиление вирусной инфекции в тяжелой форме и быстрая выработка антител к S-белку способствовала этому. Возможно, замедленный рост титра способствовал выработке антител с более высокой константной связывания, соостветствующей более прочным комплексам антиген-антитело. Похожие результаты были получены и при измерении количества IgG антител к S-белку вируса SARS-CoV-2, обнаруженных в сыворотке 29 госпитализированных пациентов в интервале от 10 до 15 дня после появления симптомов. Было показано, что титр антител линейно коррелировал с тяжестью заболевания, чем выше был титр, тем тяжелее протекала болезнь[66]. У пожилых пациентов титр антител антител в интервале от 10 до 15 дня после появления симптомов был выше чем у молодых. Кроме того, была обнаружена положительная и значимая корреляция между количеством антител в крови и концентрацией маркера воспаления цитореактивного белка C[66]. В то же время, была выявлена значимая негативная корреляция между титром антител и числом лимфоцитов[66]. Такая иммунопатология так же может быть результатом антителозависимого усиления инфекции. Более раннее появление антител IgG у пациентов с тяжело протекающей болезнью по сравнению с теми, у которых она протекала легко наблюдалось и на выборке 285 человек [67].
Изменчивость S-белка может обеспечивать антигенное разнообразие, провоцирующее ADE
Вирус с измененными антигенными свойствами S-белка может взаимодействовать с нейтрализуюзщим антителами, выработанными на изначальный вариант вируса, образуя менее стабильные комплексы. Эти комплексы могут «затаскивать» вирус в моноциты или макрофаги, где тот, высвобождаясь из комлекса, может реплицироваться. При этом может развиваться генерализованная инфекция (i. generalisata) и цитокиновый шторм[68][69]. Не исключено, что вирус меняет антигенные детерминанты за счет мутаций[61], изменения гликозилирования[60] и/или конформации S-белка[59]. В разных изолятах SARS-CoV-2 в позиции 614 S-белка часто находят либо аспарагиновую кислоту, либо глицин (614D/G). Некоторые исследователи связывают замену аминокислоты в этой позиции с потенциальной способностью вируса вызывать антителозависимое усиление инфекции[70].
См. также
- Антигенный импринтинг
- Вакцина против COVID-19
- Коронавирусная инфекция COVID-19
- Пандемия COVID-19
- Тестирование на коронавирусную инфекцию COVID-19
Примечания
- ↑ 1 2 3 Sol M. Cancel Tirado, Kyoung-Jin Yoon. Antibody-Dependent Enhancement of Virus Infection and Disease // Viral Immunology. — 2003-04-01. — Т. 16, вып. 1. — С. 69–86. — ISSN 0882-8245. — doi:10.1089/088282403763635465.
- ↑ 1 2 Khandia, R.; Munjal, A.; Dhama, K.; Karthik, K.; Tiwari, R.; Malik, Y. S.; Singh, R. K.; Chaicumpa, W. (2018). "Modulation of Dengue/Zika Virus Pathogenicity by Antibody-Dependent Enhancement and Strategies to Protect Against Enhancement in Zika Virus Infection". Frontiers in Immunology. 9: 597. doi:10.3389/fimmu.2018.00597. PMC 5925603. PMID 29740424.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Hawkes R.A. Enhancement of the infectivity of arboviruses by specific antisera produced in domestic fowls // Aust. J. Exp. Biol. Med. Sci. 1964. V. 43. P. 465—482.
- ↑ Hawkes R.A., Lafferty K.J. The enhancement of virus infectivity by antibody // Virology. 1967. V. 33. P. 250—261.
- ↑ Halstead S.B., Chow J., Marchette N.J. Immunologic enhancement of Dengue virus replication // Nat. New Biol. 1973. V. 243. P. 24—26.
- ↑ Halstead S.B., Mahalingam P.S., Marovich M.A. et al. Intrinsic antibody-dependent enhancement of microbial infection in macrophages: disease regulation by immune complexes // Lancet Infect. Dis. 2010. V. 10, № 10. P. 712—722.
- ↑ Sri Rezeki Hadinegoro, Jose Luis Arredondo-García, Maria Rosario Capeding, Carmen Deseda, Tawee Chotpitayasunondh. Efficacy and Long-Term Safety of a Dengue Vaccine in Regions of Endemic Disease // New England Journal of Medicine. — 2015-09-24. — Т. 373, вып. 13. — С. 1195—1206. — ISSN 0028-4793. — doi:10.1056/NEJMoa1506223.
- ↑ 1 2 3 Saranya Sridhar, Alexander Luedtke, Edith Langevin, Ming Zhu, Matthew Bonaparte. Effect of Dengue Serostatus on Dengue Vaccine Safety and Efficacy // New England Journal of Medicine. — 2018-07-26. — Т. 379, вып. 4. — С. 327—340. — ISSN 0028-4793. — doi:10.1056/NEJMoa1800820.
- ↑ Scott B. Halstead, Philip K. Russell. Protective and immunological behavior of chimeric yellow fever dengue vaccine (англ.) // Vaccine. — Elsevier, 2016-03. — Vol. 34, iss. 14. — P. 1643—1647. — ISSN 0264-410X. — doi:10.1016/j.vaccine.2016.02.004.
- ↑ Lisa Rosenbaum. Trolleyology and the Dengue Vaccine Dilemma // New England Journal of Medicine. — 2018-07-26. — Т. 379, вып. 4. — С. 305—307. — ISSN 1533-4406 0028-4793, 1533-4406. — doi:10.1056/nejmp1804094.
- ↑ A year after Dengvaxia: Immunization drops, measles outbreaks soar. Part 1 // Rappler. December 01, 2018
- ↑ Post Dengvaxia controversy: Paving the way forward for vaccines, health care. Part 2 // Rappler. December 02, 2018
- ↑ Controversy over dengue vaccine causes panic in the Philippines // CGTN. 24 февраля 2018 г.
- ↑ Dengue Vaccine | Dengue | CDC (англ.). www.cdc.gov (23 сентября 2019). Дата обращения: 12 мая 2020.
- ↑ Jon Cohen. New dengue vaccine performs well in large trial, but safety remains key concern (англ.) // Science. — 2019-11-06. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.aba1295.
- ↑ Stephen J. Thomas, In-Kyu Yoon. A review of Dengvaxia®: development to deployment // Human Vaccines & Immunotherapeutics. — 2019-10-03. — Т. 15, вып. 10. — С. 2295–2314. — ISSN 2164-554X 2164-5515, 2164-554X. — doi:10.1080/21645515.2019.1658503.
- ↑ Белло-Джил Д., Манец Р. Использование естественных антиуглеводных антител в терапевтических целях: Обзор // Биохимия. 2015. Т. 80, вып. 7. С. 998—1009.
- ↑ Также список вирусов, которые могут вызывать антителозависимое усиление инфекции, приведён на страницах 179—182 в руководстве по проведению доклинических исследований, выпущенном в 2012 году ФГБУ «НЦЭСМП» Минздравсоцразвития России (Меркулов В.А. и др. Руководство по проведению доклинических исследований лекарственных средств (часть 2) / Миронов А. Н.. — М.: Гриф и К, 2012. — С. 179—182. — 536 с.
- ↑ Феномен антитело-зависимого усиления инфекции у вакцинированных и переболевших. supotnitskiy.ru. Дата обращения: 14 августа 2020.
- ↑ Coronavirus Resource Center: As coronavirus spreads, many questions and some answers. Updated: May 6, 2020
- ↑ WHO Director-General’s opening remarks at the media briefing on COVID-19 — 11 March 2020
- ↑ ВОЗ объявила о пандемии коронавируса.
- ↑ Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry // Journal of Virology. 11 December 2019.
- ↑ Ann M. Arvin, Katja Fink, Michael A. Schmid, Andrea Cathcart, Roberto Spreafico. A perspective on potential antibody-dependent enhancement of SARS-CoV-2 (англ.) // Nature. — 2020-07-13. — P. 1–11. — ISSN 1476-4687. — doi:10.1038/s41586-020-2538-8.
- ↑ I-Na Lu, Claude P. Muller, Feng Q. He. Applying next-generation sequencing to unravel the mutational landscape in viral quasispecies // Virus Research. — 2020-07. — Т. 283. — С. 197963. — ISSN 0168-1702. — doi:10.1016/j.virusres.2020.197963.
- ↑ Gavin Koh. Faculty Opinions recommendation of SARS CoV subunit vaccine: antibody-mediated neutralisation and enhancement. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature (22 марта 2020). Дата обращения: 30 апреля 2020.
- ↑ Hiu-lan, Nancy Leung. Mechanism of antibody-dependent enhancement in severe acute respiratory syndrome coronavirus infection. — The University of Hong Kong Libraries.
- ↑ 1 2 3 4 5 Yip, Ming Leung, Nancy Hiu Cheung, Chung Li, Ping Lee, Horace Hok Daëron, Marc Peiris, Joseph Sriyal Bruzzone, Roberto Jaume, Martial. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus.
- ↑ Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates. dx.doi.org. Дата обращения: 30 апреля 2020.
- ↑ 1 2 3 4 Ming S Yip, Chung Y Cheung, Ping H Li, Roberto Bruzzone, JS Malik Peiris. Investigation of Antibody-Dependent Enhancement (ADE) of SARS coronavirus infection and its role in pathogenesis of SARS // BMC Proceedings. — 2011-01-10. — Т. 5, вып. S1. — ISSN 1753-6561. — doi:10.1186/1753-6561-5-s1-p80.
- ↑ Современный взгляд на диагностику, лечение и профилактику инфекционного перитонита кошек / Терехова Ю. О., Цибезов В. В., Верховский О. А., Рахманина Н. А., Елаков А. Л. // VetPharma. 2014. № 2, март.
- ↑ Javier A. Jaimes, Gary R. Whittaker. Feline coronavirus: Insights into viral pathogenesis based on the spike protein structure and function (англ.) // Virology. — 2018-04-01. — Vol. 517. — P. 108–121. — ISSN 0042-6822. — doi:10.1016/j.virol.2017.12.027.
- ↑ Harry Vennema, Amy Poland, Janet Foley, Niels C. Pedersen. Feline Infectious Peritonitis Viruses Arise by Mutation from Endemic Feline Enteric Coronaviruses // Virology. — 1998-03. — Т. 243, вып. 1. — С. 150—157. — ISSN 0042-6822. — doi:10.1006/viro.1998.9045.
- ↑ 1 2 H Vennema, R J de Groot, D A Harbour, M Dalderup, T Gruffydd-Jones. Early death after feline infectious peritonitis virus challenge due to recombinant vaccinia virus immunization // Journal of Virology. — 1990. — Т. 64, вып. 3. — С. 1407—1409. — ISSN 1098-5514 0022-538X, 1098-5514. — doi:10.1128/jvi.64.3.1407-1409.1990.
- ↑ T. Hohdatsu, M. Nakamura, Y. Ishizuka, H. Yamada, H. Koyama. A study on the mechanism of antibody-dependent enhancement of feline infectious peritonitis virus infection in feline macrophages by monoclonal antibodies // Archives of Virology. — 1991-09. — Т. 120, вып. 3—4. — С. 207—217. — ISSN 1432-8798 0304-8608, 1432-8798. — doi:10.1007/bf01310476.
- ↑ 1 2 W V Corapi, C W Olsen, F W Scott. Monoclonal antibody analysis of neutralization and antibody-dependent enhancement of feline infectious peritonitis virus. // Journal of Virology. — 1992-11. — Т. 66, вып. 11. — С. 6695–6705. — ISSN 0022-538X.
- ↑ Tomomi TAKANO, Shinji YAMADA, Tomoyoshi DOKI, Tsutomu HOHDATSU. Pathogenesis of oral type I feline infectious peritonitis virus (FIPV) infection: Antibody-dependent enhancement infection of cats with type I FIPV via the oral route // Journal of Veterinary Medical Science. — 2019. — Т. 81, вып. 6. — С. 911—915. — ISSN 1347-7439 0916-7250, 1347-7439. — doi:10.1292/jvms.18-0702.
- ↑ Francesco Negro. Is antibody-dependent enhancement playing a role in COVID-19 pathogenesis? // Swiss Medical Weekly. — 2020-04-16. — ISSN 1424-3997. — doi:10.4414/smw.2020.20249.
- ↑ 1 2 3 4 Ming Shum Yip, Nancy Hiu Lan Leung, Chung Yan Cheung, Ping Hung Li, Horace Hok Yeung Lee. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus // Virology Journal. — 2014-05-06. — Т. 11, вып. 1. — С. 82. — ISSN 1743-422X. — doi:10.1186/1743-422X-11-82.
- ↑ 1 2 3 4 5 6 Lanjuan Li, Jianer Wo, Junbing Shao, Haihong Zhu, Nanping Wu. SARS-coronavirus replicates in mononuclear cells of peripheral blood (PBMCs) from SARS patients // Journal of Clinical Virology. — 2003-12. — Т. 28, вып. 3. — С. 239—244. — ISSN 1386-6532. — doi:10.1016/s1386-6532(03)00195-1.
- ↑ 1 2 3 4 5 6 7 Mamadi Yilla, Brian H. Harcourt, Carole J. Hickman, Marcia McGrew, Azaibi Tamin. SARS-coronavirus replication in human peripheral monocytes/macrophages // Virus Research. — 2005-01. — Т. 107, вып. 1. — С. 93—101. — ISSN 0168-1702. — doi:10.1016/j.virusres.2004.09.004.
- ↑ 1 2 3 Akiko Iwasaki, Yexin Yang. The potential danger of suboptimal antibody responses in COVID-19 (англ.) // Nature Reviews Immunology. — Nature Publishing Group, 2020-04-21. — ISSN 1474-1741 1474-1733, 1474-1741. — doi:10.1038/s41577-020-0321-6.
- ↑ 1 2 3 Hiu-lan, Nancy Leung. Mechanism of antibody-dependent enhancement in severe acute respiratory syndrome coronavirus infection. — The University of Hong Kong Libraries.
- ↑ Yiu Wing Kam, François Kien, Anjeanette Roberts, Yan Chung Cheung, Elaine W. Lamirande. Antibodies against trimeric S glycoprotein protect hamsters against SARS-CoV challenge despite their capacity to mediate FcgammaRII-dependent entry into B cells in vitro // Vaccine. — 2007-01-08. — Т. 25, вып. 4. — С. 729–740. — ISSN 0264-410X. — doi:10.1016/j.vaccine.2006.08.011.
- ↑ 1 2 Sheng-Fan Wang, Sung-Pin Tseng, Chia-Hung Yen, Jyh-Yuan Yang, Ching-Han Tsao. Antibody-dependent SARS coronavirus infection is mediated by antibodies against spike proteins // Biochemical and Biophysical Research Communications. — 2014-08-22. — Т. 451, вып. 2. — С. 208–214. — ISSN 0006-291X. — doi:10.1016/j.bbrc.2014.07.090.
- ↑ 1 2 3 4 5 Yushun Wan, Jian Shang, Shihui Sun, Wanbo Tai, Jing Chen. Molecular Mechanism for Antibody-Dependent Enhancement of Coronavirus Entry // Journal of Virology. — 02 14, 2020. — Т. 94, вып. 5. — ISSN 1098-5514. — doi:10.1128/JVI.02015-19.
- ↑ 1 2 Li Liu, Qiang Wei, Qingqing Lin, Jun Fang, Haibo Wang. Anti–spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection // JCI Insight. — 2019-02-21. — Т. 4, вып. 4. — ISSN 2379-3708. — doi:10.1172/jci.insight.123158.
- ↑ 1 2 Fan Luo, Fan-Lu Liao, Hui Wang, Hong-Bin Tang, Zhan-Qiu Yang. Evaluation of Antibody-Dependent Enhancement of SARS-CoV Infection in Rhesus Macaques Immunized with an Inactivated SARS-CoV Vaccine // Virologica Sinica. — 2018-03-14. — Т. 33, вып. 2. — С. 201–204. — ISSN 1674-0769. — doi:10.1007/s12250-018-0009-2.
- ↑ 1 2 3 Chien-Te Tseng, Elena Sbrana, Naoko Iwata-Yoshikawa, Patrick C. Newman, Tania Garron. Immunization with SARS Coronavirus Vaccines Leads to Pulmonary Immunopathology on Challenge with the SARS Virus (англ.) // PLOS One. — Public Library of Science, 2012-04-20. — Vol. 7, iss. 4. — P. e35421. — ISSN 1932-6203. — doi:10.1371/journal.pone.0035421.
- ↑ M. Bolles, D. Deming, K. Long, S. Agnihothram, A. Whitmore. A Double-Inactivated Severe Acute Respiratory Syndrome Coronavirus Vaccine Provides Incomplete Protection in Mice and Induces Increased Eosinophilic Proinflammatory Pulmonary Response upon Challenge // Journal of Virology. — 2011-09-21. — Т. 85, вып. 23. — С. 12201—12215. — ISSN 0022-538X. — doi:10.1128/jvi.06048-11.
- ↑ Qidi Wang, Lianfeng Zhang, Kazuhiko Kuwahara, Li Li, Zijie Liu. Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates // ACS infectious diseases. — 05 13, 2016. — Т. 2, вып. 5. — С. 361–376. — ISSN 2373-8227. — doi:10.1021/acsinfecdis.6b00006.
- ↑ Katherine V. Houser, Andrew J. Broadbent, Lisa Gretebeck, Leatrice Vogel, Elaine W. Lamirande. Enhanced inflammation in New Zealand white rabbits when MERS-CoV reinfection occurs in the absence of neutralizing antibody // PLoS Pathogens. — 2017-08-17. — Т. 13, вып. 8. — ISSN 1553-7366. — doi:10.1371/journal.ppat.1006565.
- ↑ Anurodh Shankar Agrawal, Xinrong Tao, Abdullah Algaissi, Tania Garron, Krishna Narayanan. Immunization with inactivated Middle East Respiratory Syndrome coronavirus vaccine leads to lung immunopathology on challenge with live virus // Human Vaccines & Immunotherapeutics. — 2016-06-07. — Т. 12, вып. 9. — С. 2351—2356. — ISSN 2164-554X 2164-5515, 2164-554X. — doi:10.1080/21645515.2016.1177688.
- ↑ Jaume, Martial Yip, Ming S. Cheung, Chung Y. Leung, Hiu L. Li, Ping H. Kien, Francois Dutry, Isabelle Callendret, Benoît Escriou, Nicolas Altmeyer, Ralf Nal, Beatrice Daëron, Marc Bruzzone, Roberto Peiris, J. S. Malik. Anti-Severe Acute Respiratory Syndrome Coronavirus Spike Antibodies Trigger Infection of Human Immune Cells via a pH- and Cysteine Protease-Independent FcγR Pathway ▿. — American Society for Microbiology.
- ↑ F. F. Yuan, J. Tanner, P. K. S. Chan, S. Biffin, W. B. Dyer. Influence of FcgammaRIIA and MBL polymorphisms on severe acute respiratory syndrome // Tissue Antigens. — 2005-10. — Т. 66, вып. 4. — С. 291—296. — ISSN 1399-0039 0001-2815, 1399-0039. — doi:10.1111/j.1399-0039.2005.00476.x.
- ↑ 1 2 Darrell Ricke, Robert W. Malone. Medical Countermeasures Analysis of 2019-nCoV and Vaccine Risks for Antibody-Dependent Enhancement (ADE) // SSRN Electronic Journal. — 2020. — ISSN 1556-5068. — doi:10.2139/ssrn.3546070.
- ↑ Qidi Wang, Lianfeng Zhang, Kazuhiko Kuwahara, Li Li, Zijie Liu. Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates // ACS infectious diseases. — 05 13, 2016. — Т. 2, вып. 5. — С. 361–376. — ISSN 2373-8227. — doi:10.1021/acsinfecdis.6b00006.
- ↑ Meng Yuan, Nicholas C. Wu, Xueyong Zhu, Chang-Chun D. Lee, Ray T. Y. So, Huibin Lv. A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV. dx.doi.org (14 марта 2020). Дата обращения: 30 апреля 2020.
- ↑ 1 2 3 Wladek Minor, Ivan Shabalin. Faculty Opinions recommendation of Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature (20 февраля 2020). Дата обращения: 30 апреля 2020.
- ↑ 1 2 Yasunori Watanabe, Joel D. Allen, Daniel Wrapp, Jason S. McLellan, Max Crispin. Site-specific analysis of the SARS-CoV-2 glycan shield. dx.doi.org (28 марта 2020). Дата обращения: 11 августа 2020.
- ↑ 1 2 Hangping Yao, Xiangyun Lu, Qiong Chen, Kaijin Xu, Yu Chen, Linfang Cheng. Patient-derived mutations impact pathogenicity of SARS-CoV-2. dx.doi.org (19 апреля 2020). Дата обращения: 30 апреля 2020.
- ↑ Ватутин Н. Т., Ещенко Е. В. Лимфопения: основные причины развития // Архивъ внутренней медицины. — 2016. — № 2(28). — С. 22-27.
- ↑ Darrell Ricke, Robert W. Malone. Medical Countermeasures Analysis of 2019-nCoV and Vaccine Risks for Antibody-Dependent Enhancement (ADE) // SSRN Electronic Journal. — 2020. — ISSN 1556-5068. — doi:10.2139/ssrn.3546070.
- ↑ Ajai A. Dandekar, Stanley Perlman. Immunopathogenesis of coronavirus infections: implications for SARS // Nature Reviews Immunology. — 2005-12. — Т. 5, вып. 12. — С. 917–927. — ISSN 1474-1741 1474-1733, 1474-1741. — doi:10.1038/nri1732.
- ↑ 1 2 Linqi Zhang, Fengwen Zhang, Wenjie Yu, Tian He, Jian Yu. Antibody responses against SARS coronavirus are correlated with disease outcome of infected individuals // Journal of Medical Virology. — 2005. — Т. 78, вып. 1. — С. 1—8. — ISSN 1096-9071 0146-6615, 1096-9071. — doi:10.1002/jmv.20499.
- ↑ 1 2 3 Fan Wu, Aojie Wang, Mei Liu, Qimin Wang, Jun Chen, Shuai Xia. Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications. dx.doi.org (6 апреля 2020). Дата обращения: 30 апреля 2020.
- ↑ Quan-Xin Long, Bai-Zhong Liu, Hai-Jun Deng, Gui-Cheng Wu, Kun Deng. Antibody responses to SARS-CoV-2 in patients with COVID-19 (англ.) // Nature Medicine. — 2020-06. — Vol. 26, iss. 6. — P. 845–848. — ISSN 1546-170X. — doi:10.1038/s41591-020-0897-1.
- ↑ Jiang Gu, Clive R. Taylor. Acute Immunodeficiency, Multiple Organ Injury, and the Pathogenesis of SARS // Applied Immunohistochemistry & Molecular Morphology. — 2003-12. — С. 281—282. — ISSN 1541-2016. — doi:10.1097/00129039-200312000-00001.
- ↑ Jiang Gu, Clive R. Taylor. Acute Immunodeficiency, Multiple Organ Injury, and the Pathogenesis of SARS // Applied Immunohistochemistry & Molecular Morphology. — 2003-12. — С. 281—282. — ISSN 1541-2016. — doi:10.1097/00129039-200312000-00001.
- ↑ Bette Korber, Will M. Fischer, Sandrasegaram Gnanakaran, Hyejin Yoon, James Theiler. Tracking Changes in SARS-CoV-2 Spike: Evidence that D614G Increases Infectivity of the COVID-19 Virus // Cell. — 2020-07-03. — ISSN 0092-8674. — doi:10.1016/j.cell.2020.06.043.
Литература
- Феномен антителозависимого усиления инфекции при доклиническом изучении иммунобиологических лекарственных препаратов // Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты): В 2 частях. Ч. 2 / Под ред. А. Н. Миронова; ФГБУ «НЦЭМСП» Минздравсоцразвития России. — М.: Гриф и К, 2012. — С. 177—185. — 536 с.
- Богадельников И. В., Крюгер Е. А. Последнее слово будет за микробами? // Клиническая инфектология и паразитология. — 2012. — № 2. — С. 4-12.
- Богадельников И. В. Микроорганизмы — властители эволюции / Мед. акад. им. С. И. Георгиевского, ФГАУВО «КФУ им. В. И. Вернадского». — Симферополь: Н. Орiанда, 2016. — 150 с. — 300 экз. — ISBN 978-5-9907469-8-5.
Ссылки
- Ржешевский А. В. Вирусы и человек. Противостояние длиной в тысячелетия // Biomolecula.ru. 8 ноября 2015.
- Анна Урманцева, Мария Недюк. Такая корона: вакцина от COVID-19 может усугубить заболевание : Специалисты опасаются развития так называемого синдрома антитело-зависимого усиления инфекции // Известия: Наука. 3 марта 2020.
- У коронавируса нашли новую опасную мутацию // Lenta.ru. 6 мая 2020. (Антителозависимое усиление инфекции как основа гипотез о механизмах мутаций) — Spike mutation pipeline reveals the emergence of a more transmissible form of SARS-CoV-2
- Topic 5 — Human Immune Pathways : Theory About Antibody Dependent Enhancement (Presented by : Dr. Nor Omaima Harun) // UMTMOOC. 21 декабря 2017 г. (видео) (англ.)
- Antibody Dependent Enhancement in Dengue Infection // Zayan Mahmooth 21 августа 2017 г. (видео) (англ.)
- CV Central — 5/4/2020 «Transmissibility, Mutations, and Immune Enhancement» // Tom Kawczynski. 4 мая 2020 г. (англ.)
- Ольга Матвеева: «Я бы не лила плазму всем подряд» // Голос Америки. 6 мая 2020 г. (Микробиолог — о том, равны ли антитела иммунитету, о надёжности тестов и об опасности антителозависимого усиления инфекции)
- Юрий Нечипоренко Чем новый коронавирус отличается от ВИЧ и почему вакцину невозможно создать за полгода // Независимая газета 9 июня 2020
- «Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты)» в двух частях. В разделе «Феномен антителозависимого усиления инфекции при доклиническом изучении иммунобиологических лекарственных препаратов» приведены подробные инструкции тестирования вакцин.
- Антитела против коронавируса могут вызвать сильное повторное заражение: Сибирские ученые приступают к изучению загадки // Московский комсомолец. 17.07.2020.