Хлорид фосфора(V)
| Хлорид фосфора(V) | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид фосфора(V) | ||
| Хим. формула | PCl5 | ||
| Рац. формула | PCl5 | ||
| Физические свойства | |||
| Состояние | зеленовато-белый или желтоватый порошок | ||
| Молярная масса | 208,22 г/моль | ||
| Плотность | 2,11[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 160[1] | ||
| • сублимации | 159[1] °C | ||
| Мол. теплоёмк. | 113,32 (газ)[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −376,0[1] кДж/моль | ||
| Давление пара | 1 ± 1 мм рт.ст.[2] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | реагирует | ||
| Классификация | |||
| Рег. номер CAS | 10026-13-8 | ||
| PubChem | 24819 | ||
| Рег. номер EINECS | 233-060-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | TB6125000 | ||
| ChEBI | 30335 | ||
| Номер ООН | 1806 | ||
| ChemSpider | 23204 | ||
| Безопасность | |||
| ЛД50 | 100 мг/кг | ||
| Токсичность | ядовит, сильный окислитель[1] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пентахлори́д фо́сфора (хлори́д фо́сфора(V), хлорангидри́д фо́сфорной кислоты, пятихло́ристый фо́сфор) — высший хлорид фосфора, бинарное неорганическое химическое соединение фосфора и хлора с формулой PCl5. Зеленовато-белые[1] или желтоватые[3] кристаллы тетрагональной сингонии с неприятным раздражающим запахом.
Физические свойства[править | править код]
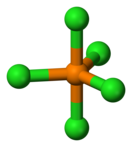
Молекула PCl5 в газообразном или жидком состояниях, а также в неполярных растворителях имеет конфигурацию тригональной бипирамиды (двух треугольных пирамид, соединённых основаниями) с атомом фосфора в основании. Основание является равносторонним треугольником с атомами хлора в вершинах, расстояние между которыми 0,349 нм, а длина связи между ними и атомом фосфора равна 0,202 нм; длина связи P-Cl для двух атомов хлора в вершинах пирамиды (апикальных) равна 0,214 нм. Твёрдый пентахлорид фосфора является ионным кристаллом, он состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]−; длина связи P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В полярных растворителях PCl5 диссоциирует на ионы [PCl4]+ и Cl− при низких концентрациях, [PCl4]+ и [РCl6]− при высоких концентрациях[4]
При температуре сублимации плотность паров в 7,2 раза больше плотности воздуха[5]. Давление паров при 20°C равно 1,6 Па (0,012 мм рт.ст.)[6].
Энтальпия сублимации при 390 К равна 67,4 ± 2,3 кДж/моль, при стандартных условиях 71,1 ± 5,0 кДж/моль[7].
Хорошо растворяется в тетрахлоруглероде, несколько хуже — в сероуглероде[1].
Химические свойства[править | править код]
При нагревании выше 300 °C практически полностью разлагается на PCl3 и Cl2[1]. Степень диссоциации при 182 °C равна 41,7%, при 200°C 48,5%, при 250°C 80,0%, при 300°C 97,3%[8].
Пентахлорид фосфора — типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора(V):
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
Для РCl5 характерны реакции окислительного хлорирования:
C концентрированной серной кислотой образует хлорсульфоновую кислоту:
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. Однако фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов хлора на органические радикалы можно получить водоустойчивые полимеры.
Пентахлорид фосфора является кислотой Льюиса.
Получение[править | править код]
Получают действием избытка хлора на хлорид фосфора(III) в газовой фазе либо пропусканием хлора через раствор PCl3 в сероуглероде:
- (ΔH = 129,7 кДж/моль)[1].
Мировой химической промышленностью, по данным на 2000 год, ежегодно производилось около 10 000 тонн пентахлорида фосфора[9]
Обратная реакция с полным разложением на хлор и трихлорид фосфора происходит при нагревании PCl5 до температуры выше 300 °C[1].
Основные сферы применения[править | править код]
Пятихлористый фосфор является хлорирующим агентом, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве красителей и лекарств[1].
Физиологические свойства[править | править код]
Хлорид фосфора(V) PCl5 является токсичным веществом (сильный неорганический яд) и мощным окислителем. Вызывает ожоги кожи.
ПДК в воздухе 0,2 мг/м3[1]. Класс опасности — 2.
История[править | править код]
Пентахлорид фосфора был впервые синтезирован в 1808 году британским химиком Хэмфри Дэви, который, сжигая фосфор в хлоре, получил прозрачную жидкость (трихлорид фосфора) и белое твёрдое вещество (пентахлорид фосфора)[10]
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Угай А. Я. Фосфора галогениды // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 147. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ http://www.cdc.gov/niosh/npg/npgd0509.html
- ↑ The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals (англ.) / M. J. O'Neil (ed.). — Whitehouse Station, NJ: Merck and Co., Inc., 2006. — P. 1267.
- ↑ Suter R. W. et al. Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents (англ.) // Journal of the American Chemical Society. — 1978. — Vol. 95, iss. 5. — P. 1474—1479. — doi:10.1021/ja00786a021.
- ↑ Ellison H. D. Handbook of Chemical and Biological Warfare Agents (англ.). — Baco Raton, FL: CRC Press, 2000. — P. 177.
- ↑ Fee D. C. et al. Phosphorus Compounds // Kirk-Othmer Encyclopedia of Chemical Technology (англ.). — NY: John Wiley & Sons, 2005.
- ↑ Л. Д. Поляченок, О. Г. Поляченок. Диссоциация, сублимация и устойчивость пентахлорида фосфора // Журнал физической химии. — 1973. — Т. 47, вып. 2. — С. 498.
- ↑ Азингер Г. Ф. Химия и технология парафиновых углеводородов. — М.: ГНТИ НГТЛ, 1959. — С. 184.
- ↑ Holleman A. F., Wiber E., Wiberg N. Inorganic Chemistry (англ.). — Academic Press, 2001. — ISBN 978-0-12-352651-9.
- ↑ Davy H. The Bakerian Lecture. An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory (англ.) // Philosophical Transactions of the Royal Society of London. — 1809. — Vol. 99. — P. 39—104. — doi:10.1098/rstl.1809.0005.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. — М.: Мир, 1969.