Протеолиз

Протеолиз — процесс гидролиза белков, катализируемый ферментами пептидгидролазами, или протеазами.
Значение[править | править код]
Протеолиз играет большую роль в следующих процессах в организме:
- расщепление до аминокислот белков пищи благодаря действию на них пищеварительных ферментов в желудке и тонкой кишке;
- расщепление собственных белков организма в процессе метаболизма;
- образование ферментов, гормонов и биологически активных пептидов из их неактивных предшественников;
- в растениях протеолиз участвует в мобилизации запасных белков семян при прорастании.
Типы протеолиза[править | править код]
Действие протеолитических ферментов может быть разделено на две категории:
- ограниченный протеолиз, при котором протеаза специфично расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
- неограниченный, или тотальный протеолиз, при котором белки расщепляются до отдельных аминокислот.
Классификация протеаз[править | править код]
По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы:
- эндопептидазы, или протеиназы, расщепляют пептидные связи внутри пептидной цепи. Они узнают и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определёнными аминокислотными остатками.
- экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы расщепляют только дипептиды.
Протеазы также классифицируются по типу их механизма катализа. Международный союз по биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology) выделяет несколько классов протеаз, включая[1]:
Ограниченный протеолиз[править | править код]
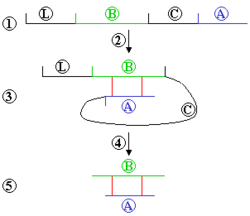
Ограниченный протеолиз — процесс расщепления одной или нескольких пептидных связей в молекуле белка ферментом-протеазой. Ограниченный протеолиз является одной из регуляторных посттрансляционных модификаций. Ограниченный протеолиз может изменять такие свойства белка, как ферментативная активность, способность связываться с другими белками, внутриклеточная локализация.
Примеры ограниченного протеолиза[править | править код]
Ограниченный протеолиз может использоваться клеткой для разных целей:
- для отщепления N- и С-концевых сигнальных последовательностей в процессе внутриклеточного транспорта белка[2];
- для удаления вспомогательной части полипептидной цепи пробелка, которая помогает формировать правильную третичную структуру (С-пептид в проинсулине);
- для активации предшественников ферментов (пищеварительные ферменты, протеазы свёртывания крови[3]);
- для изменения локализации белка (некоторые цитоплазматические белки переходят в ядро после ограниченного протеолиза: SREBP, NF-κB[4], YB-1[5]);
- для получения физиологически активных олигопептидов из белка-предшественника (расщепление проопиомеланокортина с образованием эндорфина, адренокортикотропного гормона, α- и γ-меланоцитстимулирующих гормонов и других физиологически активных пептидов);
- разрезание перемычки между доменами белка, при этом домены обычно остаются в контакте друг другом (созревание дифтерийного токсина[3], формирование фактора пролиферации клеток HCF-1;
- для разделения белковых глобул в полибелках (это характерно для вирусов)[6];
- для получения нескольких изоформ белка (ограниченный протеолиз белков Stat5 и Stat6 приводит к формированию их изоформ, лишённых доменов, активирующих транскрипцию).
Примечания[править | править код]
- ↑ Union of Biochemistry and Molecular Biology (NC-IUBMB). Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Дата обращения: 29 декабря 2012. Архивировано из оригинала 5 января 2013 года.
- ↑ Пушкина Н. В. (1998). Посттрансляционные модификации белков, издательство РГУ, Ростов-на-Дону
- ↑ 1 2 Степанов В. М. (1996). Молекулярная биология. Структура и функции белков, «Высшая школа», Москва.
- ↑ Goulet, B. and Nepveu, A. Complete and limited proteolysis in cell cycle progression (англ.) // Cell Cycle : journal. — 2004. — Vol. 3. — P. 986—989. — PMID 15254406.
- ↑ Sorokin, A.V., Selyutina, A.A., Skabkin, M.A., Guryanov, S.G., Nazimov, I.V., Richard, C., Th'ng, J., Yau, J., Sorensen, P.H., Ovchinnikov, L.P., and Evdokimova, V. Proteasome-mediated cleavage of the Y-box-binding protein 1 is linked to DNA-damage stress response (англ.) // Embo J : journal. — 2005. — Vol. 24. — P. 3602—3612. — doi:10.1038/sj.emboj.7600830. — PMID 16193061.
- ↑ Bianchi, E. and Pessi, A. Inhibiting viral proteases: challenges and opportunities (англ.) // Biopolymers : journal. — 2002. — Vol. 66. — P. 101—114. — PMID 12325160.
См. также[править | править код]
Для улучшения этой статьи желательно:
|