Фторид хлора(V)
| Фторид хлора(V) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Пентафторид хлора | ||
| Хим. формула | ClF5 | ||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 130,445 г/моль | ||
| Плотность | 0,0045 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −103 °C | ||
| • кипения | −13,1 °C | ||
| Энтальпия | |||
| • образования | −238,49 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролиз | ||
| Классификация | |||
| Рег. номер CAS | 13637-63-3 | ||
| PubChem | 61654 | ||
| Рег. номер EINECS | 237-123-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO2975000 | ||
| ChemSpider | 55559 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
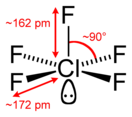
Фтори́д хло́ра(V) (пентафтори́д хло́ра, пятифто́ристый хлор) — ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в бесцветную жидкость. Впервые синтезирован в 1963 году.
Физические свойства[править | править код]
Температура плавления −103 °C, кипения −13,1 °C. В газовой фазе бесцветен, конденсируется в мутно-белую жидкость и в белые кристаллы. Давление паров в диапазоне от −80 до 25 °C зависит от абсолютной температуры как lg Pмм рт.ст. = 7,2683 − 1137,16/T. Плотность в жидкой фазе при −23 °C равна 1,922 г/см³, в диапазоне от −80 до −23 °C изменяется как 2,696 г/см³ − 3,08⋅10−3 T (K)[1].
Химические свойства[править | править код]
Сильный окислитель и очень сильный фторирующий агент. Реагирует с водой, взаимодействует со всеми элементами, кроме фтора, кислорода, азота и инертных газов[1]:
- С диоксидом кремния при комнатной температуре переходит во фторид кремния(IV)[2]:
- Под действием ультрафиолетового излучения вступает во взаимодействие с PtF6, при этом образуется смесь ClF6PtF6 и ClF4PtF6[3]:
Получение[править | править код]
- Реакция трифторида хлора с газообразным фтором при высоких температуре и давлении:
- Синтез из элементов при 350 °C и давлении 250 атм (фотохимическая активация позволяет снизить давление синтеза до 1 атм).
- Фторирование соединений вида Me[ClF4] (Me = K, Rb, Cs).
- Электролиз раствора ClF3 в HF.
Применение[править | править код]
Применяется как фторирующий агент, но используется редко, так как не имеет преимуществ перед трифторидом хлора. В США было предложено использовать его как компонент ракетного топлива, высококипящий окислитель, однако по данным на 1981 года работы по этой теме находились на стадии стендовых и лабораторных испытаний[4].
Токсичность[править | править код]
Очень токсичен, ядовитый (удушающий) газ.
Примечания[править | править код]
- ↑ 1 2 Pilipovich D., Maya W., Lawton E. A., Bauer H. F., Sheehan D. F., Ogimachi N. N., Wilson R. D., Gunderloy F. C., Bedwell V. E. Chlorine pentafluoride. Preparation and Properties (англ.) // Inorganic Chemistry : journal. — 1967. — Vol. 6, no. 10. — P. 1918—1919. — doi:10.1021/ic50056a036.
- ↑ Лидин, 2000, с. 264.
- ↑ FreePatentsOnline — Ionic Interhalogen Oxidizing Agent and Method. Дата обращения: 11 октября 2010. Архивировано 4 марта 2016 года.
- ↑ Пентафторид хлора // Космонавтика. Энциклопедия / Гл. ред. В. П. Глушко. — Москва: Советская энциклопедия, 1985. — С. 290. — 528 с.
Литература[править | править код]
- Николаев Н. С., Суховерхов В. Ф., Шишков В. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. М.: Наука, 1968.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.




![{\displaystyle {\mathsf {2PtF_{6}+2ClF_{5}\rightarrow ClF_{6}[PtF_{6}]+ClF_{4}[PtF_{6}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68e89972a20489d8be15642ff17f09d6f6286a08)
