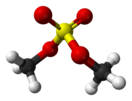
Диметилсульфат
| Диметилсульфат | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Диметилсульфат | ||
| Традиционные названия | Диметилсульфат, диметиловый эфир серной кислоты | ||
| Хим. формула | C2H6O4S | ||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 126,13 г/моль | ||
| Плотность | 1,33 г/см³ | ||
| Динамическая вязкость | 1,60 Па·с | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -32 °C | ||
| • кипения | 188 (с разложением) °C | ||
| • разложения | 370 ± 1 ℉[1] | ||
| • вспышки | 83 °C | ||
| Давление пара | 0,1 ± 0,1 мм рт.ст. | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролизуется | ||
| Оптические свойства | |||
| Показатель преломления | 1,3874 | ||
| Структура | |||
| Дипольный момент | 10,92 Д | ||
| Классификация | |||
| Рег. номер CAS | 77-78-1 | ||
| PubChem | 6497 | ||
| Рег. номер EINECS | 201-058-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | WS8225000 | ||
| ChEBI | 59050 | ||
| ChemSpider | 6252 | ||
| Безопасность | |||
| Предельная концентрация | 0,1 мг/м3 | ||
| ЛД50 | 140 мг/кг | ||
| Токсичность | Класс опасности 2 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Диметилсульфáт — органическое химическое соединение, сложный эфир метанола и серной кислоты с формулой , принятая сокращённая формула .
Впервые получен в начале XIX века.
Широко применяется как метилирующий реагент в органическом синтезе. В некоторых случаях может быть заменён метиловым эфиром трифторметансульфоновой кислоты , или иодметаном.
Как и все алкилирующие реагенты, диметилсульфат в высоких концентрациях токсичен и проявляет канцерогенные свойства.
Получение[править | править код]
Для получения диметилсульфата используются различные методы. Простейший — этерификация серной кислоты с метанолом:
- .
Другой возможный способ включает в себя дистилляцию метилсерной кислоты в вакууме (перегонка 60 % олеума с метанолом):
- .
Метилнитрит и метилхлорсульфонат также образуют диметисульфат:
- .
В США производится коммерчески с 20-х годов XX века в непрерывном процессе реакции диметилового эфира и триоксида серы:
- .
Ещё один способ получения диметилсульфата — реакция хлорсульфоновой кислоты с метанолом[2]:
- .
Физические свойства[править | править код]
Представляет собой бесцветную маслянистую жидкость, малорастворимую в воде. Чистый диметилсульфат не имеет запаха. Примеси могут придавать ему слабый запах чеснока.
Может быть перегнан при 140—150 °C и давлении примерно 15 мм рт. ст.
Химические свойства[править | править код]
Растворим в метаноле, этаноле, этиловом эфире, дихлорметане, ацетоне, хлороформе, нитробензоле, также реакции иногда ведут в воде. Со взрывом реагирует с аммиаком и аминами. Реакции растворов аминов дает соответственно вещества с большим содержанием метильных групп при азоте, третичные амины дают четвертичные соли. При этом первая метильная группа уходит значительно быстрее второй. Он также алкилирует фенолы и тиолы. Считается, что реакции идут по SN2 механизму.
Несмотря на высокую эффективность диметилсульфата для алкилирования, из-за токсичности и высокой стоимости его часто заменяют. Так при О-алкилировании используют иодметан. Диметилкарбонат менее токсичен чем иные реагенты, поэтому может успешно быть заменить их при N-алкилировании. В целом токсичность алкилирующих агентов прямо коррелирует с их способностью к алкилированию.
Применение[править | править код]
Широко применяется в органическом синтезе для метилирования различных веществ: фенолов, аминов, некоторых гетероциклических соединений пуринового ряда, таких как мочевая кислота и других. Так же применяется для получения нитрометана:
- .
Метилирование по углероду[править | править код]
С-Н кислоты метилируются диметилсульфатом в апротонных растворителях.
Метилирование по кислороду[править | править код]
Чаще всего диметилсульфат используется для метилирования фенолов. Некоторые простые спирты также могут быть метилированы, как, например, трет-бутанол в трет-бутилметиловый эфир.
- .
Алкоголяты легко метилируются, например[3]:
- .
Метилирование сахаров диметилсульфатом называется метилированием по Хаворту[4][5].
Метилирование по азоту[править | править код]
Диметилсульфат используется как для получения четвертичных солей так и третичных аминов.
- .
Кватернизованные аммониевые соли жирных кислот используют как поверхностно-активных веществ (ПАВ) так и в качестве смягчителя тканей[3]:
- .
Метилирование по сере[править | править код]
Так же как и метилирование спиртов, алкилируются тиоляты, но с большей скоростью[3]:
- ,
например[6]:
- .
Этот метод был использован для получения тиоэфиров:
- .
Другие применения[править | править код]
Диметилсульфат может вызвать специфические расщепление гуанина в ДНК путём разрушения имидазольного гетероцикла[7]. Этот процесс может быть использован для определения последовательности азотистых оснований в ДНК и других применениях.
Диметилсульфат используется для картирования одноцепочечных фрагментов ДНК. Метод основан на различии скорости метилирования фрагментов цитозина в составе одно- и двуцепочечных нуклеиновых кислот[8].
Токсикология и безопасность[править | править код]
Высокотоксичное вещество с кожно-резорбтивным воздействием, ЛД50 140 мг/кг (мыши, перорально).
Пары диметилсульфата оказывают сильное раздражающее и прижигающее воздействие на слизистые оболочки дыхательных путей и глаз (воспалительные явления, отёки, поражения дыхательных путей, конъюнктивит)[9].
Оказывает также общее токсическое действие, особенно на ЦНС. Жидкий диметилсульфат при попадании на кожу вызывает ожоги и долго незаживающие язвы, в высоких концентрациях омертвение (некроз). Токсичность обусловлена продуктами гидролиза, которые включают метанол и серную кислоту.
Скрытый период при лёгких отравлениях составляет до 15 часов, при отравлениях средней тяжести — до 5 часов, при тяжёлых — до 2—3 часов[9].
Особенно опасно поражение глаз (возможна потеря зрения). В тяжёлых случаях отравления наблюдается кома, паралич и смерть в течение 3—4 дней[9].
Является сильным канцерогеном, проявляет мутагенные эффекты. Канцерогенный и мутагенный эффекты обусловлены метилированием ДНК.
Примечания[править | править код]
- ↑ http://www.cdc.gov/niosh/npg/npgd0229.html
- ↑ Препаративная органическая химия. М., Госхимиздат, 1959, стр. 399
- ↑ 1 2 3 Dupont product information. Дата обращения: 2 мая 2009. Архивировано из оригинала 19 ноября 2008 года.
- ↑ Haworth W. N. J. Chem. Soc., 107, 13 (1915).
- ↑ Химическая энциклопедия Т1, М 1988 стр 64
- ↑ Fieser L. F. and Fieser M. Reagents for Organic Synthesis. John Wiley & Sons, Inc. 1967. p. 295
- ↑ Streitwieser A., Heathcock C. H. and Kosower E. M. Introduction to Organic Chemistry. Prentice-Hall Inc. 1992. p. 1169
- ↑ Kirkegaard K., Buc H., Spassky A., and Wang J. C. Mapping of single-stranded regions in duplex DNA at the sequence level: single-strand-specific cytosine methylation in RNA polymerase-promoter complexes (англ.) // PNAS. — 1983. — Vol. 80. — P. 2544-2548. — PMID 6573669. Архивировано 24 сентября 2015 года.
- ↑ 1 2 3 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е, пер. и доп. В трех томах. Том III. Органические вещества. Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. Л., «Химия», 1976. 592 стр., 27 табл., библиография 1850 названий.
Литература[править | править код]
- Сьютер Ч. Химия органических соединений серы. Пер. с англ., ч. 1, М., 1950, с. 61—74.
Ссылки[править | править код]
- [www.xumuk.ru/encyklopedia/1347.html www.xumuk.ru]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |













![{\displaystyle {\ce {CH3(C6H4)NH2 + (CH3)2SO4 ->[{\ce {NaHCO_3 + H_2O}}] CH3(C6H4)N(CH3)2 + Na(CH3)SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0c5a32f0be6e4b8dbc0aff9a05380d5116817581)


