Гетероциклические соединения
Гетероциклические соединения (гетероциклы) (от др.-греч. ἕτερος — другой) — органические соединения, содержащие циклы, в состав которых входят атомы, помимо углерода и водорода. Могут рассматриваться как карбоциклические соединения с гетерозаместителями (гетероатомами) в цикле. Наиболее разнообразны и хорошо изучены ароматические азотсодержащие гетероциклические соединения. Предельные случаи гетероциклических соединений — соединения, не содержащие атомов углерода в цикле, например, пентазол.
Реакционная способность[править | править код]
Особенности реакционной способности гетероциклических соединений по сравнению с их карбоциклическими аналогами обуславливаются именно такими гетерозаместителями. В качестве гетероатомов чаще всего выступают элементы второго периода (N, O) и S, реже — Se, P, Si и др. элементы. Как и в случае карбоциклических соединений, наиболее специфические свойства гетероциклических соединений проявляют ароматические гетероциклические соединения (гетероароматические соединения). В отличие от атомов углерода карбоциклических ароматических соединений, гетероатомы могут отдавать в ароматическую систему не только один (гетероатомы пиридинового типа), но и два (гетероатомы пиррольного типа) электрона. Гетероатомы пиррольного типа обычно входят в состав пятичленных циклов (пиррол, фуран, тиофен). В одном гетероцикле могут сочетаться оба типа гетероатомов (имидазол, оксазол). Особенности реакционной способности гетероароматических соединений определяются распределением электронной плотности в цикле, которая, в свою очередь, зависит от типов гетероатомов и их электроотрицательности.
Нуклеофильность[править | править код]
Так, для пятичленных гетероциклов с одним гетероатомом (пиррольный тип), ароматический секстет электронов распределяется по пяти атомам цикла так, что ведёт к высокой нуклеофильности этих соединений. Для них характерны реакции электрофильного замещения, они весьма легко протонируются по пиридиновому азоту (предпочтительно, см. далее) или углероду цикла, галогенируются и сульфируются в мягких условиях. Реакционная способность при электрофильном замещении убывает в ряду пиррол > фуран > селенофен > тиофен > бензол.
Введение гетероатомов пиридинового типа в пятичленные гетероциклы ведёт к снижению электронной плотности, нуклеофильности, и, соответственно, реакционной способности в реакциях электрофильного замещения, то есть эффект аналогичен влиянию электроноакцепторных заместителей для производных бензола. Азолы реагируют с электрофилами подобно пирролам с одним или несколькими электроноакцепторными заместителями в кольце, а для оксазолов и тиазолов становится возможным лишь при наличии активирующих заместителей с +M-эффектом (амино- и гидроксигруппы).
Для шестичленных гетероциклов (пиридиновый тип) пониженная по сравнению с бензолом электронная плотность ведёт с пониженной нуклеофильности этих соединений: реакции электрофильного замещения идут в жёстких условиях. Так, пиридин сульфируется олеумом при 220—270 °C.
Нуклеофильность гетероатомов[править | править код]
Для азотсодержащих гетероциклических соединений с азотом пиридинового типа п-электронная плотность максимальна именно на атоме азота. В качестве иллюстрации можно привести расчётную п-электронную плотность для пиридина:
| Положение атома | Электронная плотность |
|---|---|
| 1 (N) | 1.43 |
| 2 (α) | 0.84 |
| 3 (β) | 1.01 |
| 4 (γ) | 0.87 |
Соответственно, атаки электрофилов в этом случае направляются на пиридиновый атом азота. В качестве электрофилов могут выступать разнообразные алкилирующие и ацилирующие агенты (реакция кватернизиции с образованием соответствующих четвертичных солей) и надкислоты (с образованием N-оксидов).
Атом азота пиррольного типа значительно менее нуклеофилен — алкилирование N-замещенных имидазолов идёт преимущественно по азоту пиридинового типа, однако, при депротонировании незамещённого пиррольного азота направление замещения обращается. Так, 4-нитроимидазол при метилировании в нейтральных условиях даёт в основном 1-метил-5-нитроимидазол, а в щелочных растворах (где субстратом является его депротонированная форма) главным продуктом реакции оказывается 1-метил-4-нитроимидазол.
Такое повышение нуклеофильности азота пиррольного типа при депротонировании типично для всех гетероароматических соединений, однако направление атаки электрофила зависит от степени диссоциации образующегося аниона: если индолил- и пирролилмагнийгалогениды подвергаются электрофильной атаке преимущественно по углероду, то соответствующие соли щелочных металлов реагируют в основном по атому азота. Подтверждением влияния диссоциации комплекса N-анион — металл на направление реакции является обращения направления электрофильной атаки при реакции индолилмагнийгалогенидов с метилйодидом в ГМФТА вследствие промотируемой растворителем диссоциации магниевого комплекса.
Электрофильность[править | править код]
Электрофильность гетероароматических соединений растёт при падении п-электронной плотности, то есть при увеличении числа гетероатомов и, при их равном числе, выше для шестичленных, по сравнению с пятичленными, гетероциклами. Так, для пирролов и индолов реакции нуклеофильного замещения атипичны, пиридин и бензимидазол аминируются амидом натрия, а 1,3,5-триазин быстро гидролизуется до формиата аммония уже в водном растворе.
Реакционная способность заместителей и боковых цепей[править | править код]
Реакционная способность неароматических гетероциклических близка к таковой их ациклических аналогов с поправкой на стерические эффекты.
В случае гетероароматических соединений на реакционную способность боковых цепей существенно влияют мезомерные эффекты. Кислотность метиленовых водородов в 2- и 4-замещённых пиридинах существенно повышена: так, альдольная конденсация 2-метилпиридина (α-пиколина) с формальдегидом с образованием 2-этоксиэтил-2-пиридина с последующей его дегидратацией служит промышленным методом синтеза 2-винилпиридина.
Этот раздел не завершён. |
Номенклатура[править | править код]
В химии гетероциклические соединения в силу исторических причин широко применяются тривиальные названия; так, например, при именовании пяти- и шестичленных соединений, содержащих 1 или 2 гетероатома N, O или S в подавляющем большинстве случаев используются тривиальные названия.
Систематическая номенклатура гетероциклических соединений строится по правилам, предложенным Ганчем и Видманом.
| Простые гетероциклы с одним гетероатомом | |||||||
|---|---|---|---|---|---|---|---|
| Насыщенные гетероциклы | Ненасыщенные гетероциклы | ||||||
| Гетероатом | Азот | Кислород | Сера | Азот | Кислород | Сера | |
| Трёхчленные | |||||||
| Систематическое название | Азиридин | Оксиран | Тииран | Азирин | Оксирен | Тиирен | |
| Тривиальное название | Этиленимин | Этиленоксид | Этиленсульфид | - | - | - | |
| Структура |  |
 |
 |
 |

| ||
| Четырёхчленные | |||||||
| Систематическое название | Азетидин | Оксетан | Тиетан | Азет | Оксет | Тиет | |
| Тривиальное название | 1,3-Пропиленимин | Триметиленоксид | Триметиленсульфид | Азациклобутадиен | - | - | |
| Структура | 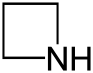 |
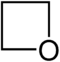 |
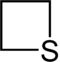 |
 |
 |

| |
| Пятичленные | |||||||
| Систематическое название | Азолидин | Оксолан | Тиолан | Азол | Оксол | Тиол | |
| Тривиальное название | Пирролидин | Тетрагидрофуран | Тетрагидротиофен | Пиррол | Фуран | Тиофен | |
| Структура | 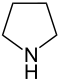 |
 |
 |
 |
 |
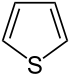
| |
| Шестичленные | |||||||
| Систематическое название | Азинан | Оксан | Тиан | Азин | Оксиний | Тииний | |
| Тривиальное название | Пиперидин | Тетрагидропиран | Тетрагидротиопиран | Пиридин | Пирилий | Тиопирилий | |
| Структура |  |
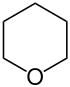 |
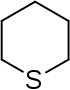 |
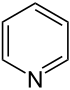 |
 |
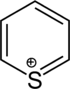
| |
| Семичленные | |||||||
| Систематическое название | Азепан | Оксепан | Тиепан | Азепин | Оксепин | Тиепин | |
| Тривиальное название | Гексаметиленимин | Гексаметиленоксид | Гексаметиленсульфид | Азатропилиден | Оксациклогептатриен | - | |
| Структура | 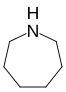 |
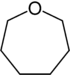 |
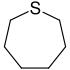 |
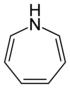 |
 |

| |
Основа названия присваивается гетероциклу в зависимости от размера цикла, а также от содержащихся в нём гетероатомов: для азотсодержащих гетероциклов часто применяют отдельный набор основ. Для насыщенных и максимально ненасыщенных гетероциклов также применяют различные наборы основ. Также иногда применяются специальные основы для указания на частичную ненасыщенность гетероцикла.
Насыщенные
- -иран (для трёхчленного цикла),
- -етан (для четырёхчленного цикла),
- -олан (для пятичленного цикла),
- -ан (для шестичленного цикла),
- -епан (для семичленного цикла),
- -окан (для восьмичленного цикла),
- -онан (для девятичленного цикла),
- -екан (для десятичленного цикла),
Ненасыщенные
- -ирен (для трёхчленного цикла),
- -ет (для четырёхчленного цикла),
- -ол (для пятичленного цикла),
- -ин (для шестичленного цикла),
- -епин (для семичленного цикла),
- -оцин (для восьмичленного цикла),
- -онин (для девятичленного цикла),
- -ецин (для десятичленного цикла),
содержащие азот
Насыщенные
- -еридин (для трёхчленного цикла),
- -етидин (для четырёхчленного цикла),
- -оллидин (для пятичленного цикла),
- -инан (для шестичленного цикла),
- -епан (для семичленного цикла),
- -окан (для восьмичленного цикла),
- -онан (для девятичленного цикла),
- -екан (для десятичленного цикла),
Ненасыщенные
- -ирин (для трёхчленного цикла),
- -ет (для четырёхчленного цикла),
- -ол (для пятичленного цикла),
- -ин (для шестичленного цикла),
- -епин (для семичленного цикла),
- -оцин (для восьмичленного цикла),
- -онин (для девятичленного цикла),
- -ецин (для десятичленного цикла),
Биологическое значение[править | править код]
Гетероциклические соединения широко распространены в живой природе и имеют важное значение в химии природных соединений и биохимии. Функции, выполняемые этими соединениями весьма широки — от структурообразующих полимеров (производные целлюлозы и других циклических полисахаридов) до коферментов и алкалоидов.
Производство и применение[править | править код]
Некоторые гетероциклические соединения получают из каменноугольной смолы (пиридин, хинолин, акридин и пр.) и при переработке растительного сырья (фурфурол). Многие природные и синтетические гетероциклические соединения — ценные красители (индиго), лекарственные вещества (хинин, морфин, акрихин, пирамидон). Гетероциклические соединения используют в производстве пластмасс, как ускорители вулканизации каучука, в кинофотопромышленности.
См. также[править | править код]
- Трёхчленные гетероциклы
- Четырёхчленные гетероциклы
- Пятичленные гетероциклы
- Шестичленные гетероциклы
- Семичленные гетероциклы
- 2-Метилбензотиазол
- 1-Диазидокарбамоил-5-азидотетразол