РНК-термометр: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
Minina (обсуждение | вклад) Нет описания правки |
Minina (обсуждение | вклад) Нет описания правки |
||
| Строка 18: | Строка 18: | ||
== Распространение == |
== Распространение == |
||
Большая часть известных сейчас РНК-термометров располагается в [[5'-нетранслируемая область|5'-нетранслируемых областях]] (5'-UTR) мРНК, кодирующих [[белки теплового шока]]. Возможно, такие результаты обусловлены {{нп5|Смещение отбора|смещением отбора|en|Sampling bias}} и непреодолимыми сложностями в поиске коротких [[Консервативные последовательности|неконсервативных]] последовательностей в [[Геномика|геномных данных]]<ref name="Nar10">{{cite pmid|20009504}}</ref><ref>{{cite pmid|19494584}}</ref>. |
Большая часть известных сейчас РНК-термометров располагается в [[5'-нетранслируемая область|5'-нетранслируемых областях]] (5'-UTR) прокариотических мРНК, кодирующих [[белки теплового шока]]. Возможно, такие результаты обусловлены {{нп5|Смещение отбора|смещением отбора|en|Sampling bias}} и непреодолимыми сложностями в поиске коротких [[Консервативные последовательности|неконсервативных]] последовательностей в [[Геномика|геномных данных]]<ref name="Nar10">{{cite pmid|20009504}}</ref><ref>{{cite pmid|19494584}}</ref>. |
||
Хотя большинство известных РНК-термометров обнаружены у [[Прокариоты|прокариот]], возможные РНК-термометры были выявлены у [[Млекопитающие|млекопитающих]], в том числе и [[человек]]а<ref name="Sha06">{{cite pmid|16554823}}</ref>. У человека возможный термосенсор РНК теплового шока-1 (HSR1) активирует {{нп5|транскрипционный фактор теплового шока-1||en|HSF1}} (HSF1) и запускает синтез защитных белков при температуре, превышающей 37 °C ({{нп5|Температура тела человека|нормальную температуру тела|en|Human body temperature}}), и тем самым защищает клетки от перегревания<ref name="Sha06" />. |
Хотя большинство известных РНК-термометров обнаружены у [[Прокариоты|прокариот]] (в том числе [[Цианобактерии|цианобактерий]]<ref name="r2014" />), возможные РНК-термометры были выявлены у [[Млекопитающие|млекопитающих]], в том числе и [[человек]]а<ref name="Sha06">{{cite pmid|16554823}}</ref>. У человека возможный термосенсор РНК теплового шока-1 (HSR1) активирует {{нп5|транскрипционный фактор теплового шока-1||en|HSF1}} (HSF1) и запускает синтез защитных белков при температуре, превышающей 37 °C ({{нп5|Температура тела человека|нормальную температуру тела|en|Human body temperature}}), и тем самым защищает клетки от перегревания<ref name="Sha06" />. ''Цис''-регуляторный элемент {{нп5|Hsp90||en|Hsp90}} регулирует экспрессию [[Шапероны|шаперона]] hsp90 у [[Drosophila melanogaster|дрозофилы]], повышая его трансляцию при высоких температурах<ref name="Ahm04" />. |
||
== Структура == |
== Структура == |
||
| Строка 34: | Строка 34: | ||
== Механизм == |
== Механизм == |
||
[[Файл:RNA thermometer.svg|250px|thumb|right|Стабильная шпилька (''слева'') расплетается при высокой температуре (''справа''). Выделенная последовательность Шайна — Дальгарно выставляется наружу, позволяя малой субъединице рибосомы (30S) присоединиться к мРНК<ref name="Nar06" />]] |
[[Файл:RNA thermometer.svg|250px|thumb|right|Стабильная шпилька (''слева'') расплетается при высокой температуре (''справа''). Выделенная последовательность Шайна — Дальгарно выставляется наружу, позволяя малой субъединице рибосомы (30S) присоединиться к мРНК<ref name="Nar06" />]] |
||
РНК-термометры располагаются в 5'-UTR мРНК, выше кодирующей последовательности<ref name="Nar06" />. В отличие от рибопереключателей, действующих на уровне [[Транскрипция (биология)|транскрипции]], [[Трансляция (биология)|трансляции]] и регуляции стабильности мРНК, все известные на данный момент РНК-термометры действуют на уровне инициации трансляции<ref name="r2016">{{cite pmid|27060146}}</ref>. Структурные изменения в РНК-термометров могут убирать сайт связывания [[рибосомы]] в глубь молекулы и тем самым предотвращать трансляцию мРНК в белок<ref name="Nar10" />. При повышении температуры шпилечная структура РНК-термометра может плавиться, выставляя наружу сайт связывания рибосомы или последовательность Шайна — Дальгарно, позволяя малой субъединице рибосомы ({{нп5|30S||en|30S}}) связаться с мРНК, вслед за чем собирается и весь аппарат трансляции<ref name="Nar06" />. [[Старт-кодон]], располагающийся, как правило, на 8 нуклеотидов ниже последовательности Шайна — Дальгарно<ref name="Nar10" />, отмечает начало {{нп5|Кодирующая область|белоккодирующей области|en|Coding region}}, которую рибосома транслирует в [[пептид]]. Помимо таких [[Цис-регуляторные элементы|''цис''-действующих]] РНК-термометров известен единственный [[Транс-регуляторные элементы|''транс''-действующий]] РНК-термометр, располагающийся в мРНК {{нп5|RpoS||en|RpoS mRNA 5'UTR}}, где он, как предполагается, регулирует ответ на длительное голодание<ref name="Nar06" />. |
РНК-термометры располагаются в 5'-UTR мРНК, выше кодирующей последовательности<ref name="Nar06" />. В отличие от рибопереключателей, действующих на уровне [[Транскрипция (биология)|транскрипции]], [[Трансляция (биология)|трансляции]] и регуляции стабильности мРНК, все известные на данный момент РНК-термометры действуют на уровне инициации трансляции<ref name="r2016">{{cite pmid|27060146}}</ref>. Структурные изменения в РНК-термометров могут убирать сайт связывания [[рибосомы]] в глубь молекулы и тем самым предотвращать трансляцию мРНК в белок<ref name="Nar10" />. При повышении температуры шпилечная структура РНК-термометра может плавиться, выставляя наружу сайт связывания рибосомы или последовательность Шайна — Дальгарно (а в некоторых случаях [[старт-кодон]] AUG<ref name="r2014">{{cite pmid|24657524}}</ref>), позволяя малой субъединице рибосомы ({{нп5|30S||en|30S}}) связаться с мРНК, вслед за чем собирается и весь аппарат трансляции<ref name="Nar06" />. [[Старт-кодон]], располагающийся, как правило, на 8 нуклеотидов ниже последовательности Шайна — Дальгарно<ref name="Nar10" />, отмечает начало {{нп5|Кодирующая область|белоккодирующей области|en|Coding region}}, которую рибосома транслирует в [[пептид]]. Помимо таких [[Цис-регуляторные элементы|''цис''-действующих]] РНК-термометров известен единственный [[Транс-регуляторные элементы|''транс''-действующий]] РНК-термометр, располагающийся в мРНК {{нп5|RpoS||en|RpoS mRNA 5'UTR}}, где он, как предполагается, регулирует ответ на длительное голодание<ref name="Nar06" />. |
||
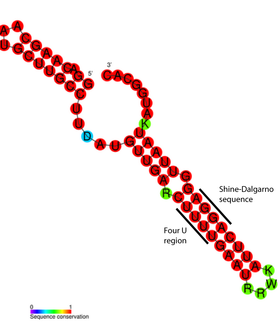
В качестве примера можно рассмотреть РНК-термометр FourU ''{{нп5|Salmonella enterica||en|Salmonella enterica}}''<ref name="Wald07" />. Под действием температур выше 45 °C шпилька, содержащая последовательность Шайна — Дальгарно, плавится, последовательность Шайна—Дальгарно становится неспаренной и трансляция мРНК становится возможной<ref name="Nik10" />. Показано, что на стабильность FourU влияет концентрация Mg<sup>2+</sup><ref name="Rin11">{{cite pmid|21727085}}</ref>. Наиболее изучен РНК-термометр, расположенный в мРНК гена ''rpoH'' у ''E. coli''<ref name="Sha10">{{cite pmid|20625392}}</ref>. Этот термосенсор положительно регулирует трансляцию белков теплового шока при высоких температурах посредством специализированного {{нп5|Сигма-фактор|сигма-фактора|en|Sigma factor}} σ<sup>32</sup><ref name=Storz99/>. |
В качестве примера можно рассмотреть РНК-термометр FourU ''{{нп5|Salmonella enterica||en|Salmonella enterica}}''<ref name="Wald07" />. Под действием температур выше 45 °C шпилька, содержащая последовательность Шайна — Дальгарно, плавится, последовательность Шайна—Дальгарно становится неспаренной и трансляция мРНК становится возможной<ref name="Nik10" />. Показано, что на стабильность FourU влияет концентрация Mg<sup>2+</sup><ref name="Rin11">{{cite pmid|21727085}}</ref>. Наиболее изучен РНК-термометр, расположенный в мРНК гена ''rpoH'' у ''E. coli''<ref name="Sha10">{{cite pmid|20625392}}</ref>. Этот термосенсор положительно регулирует трансляцию белков теплового шока при высоких температурах посредством специализированного {{нп5|Сигма-фактор|сигма-фактора|en|Sigma factor}} σ<sup>32</sup><ref name=Storz99/>. |
||
| ⚫ | У ''[[Bradyrhizobium japonicum]]'' и ''[[Rhizobium radiobacter]]'', протеобактерий порядка Rhizobiales, описаны РНК-термометры ROSE<sub>1</sub> и ROSE<sub>AT2</sub> соответственно. Они располагаются в 5'-UTR ''HspA'' и подавляют трансляцию белков теплового шока при [[Физиология|физиологических]] температурах<ref name="Noc01" /><ref>{{cite pmid|15466035}}</ref>. |
||
Хотя РНК-термометры обычно связаны с экспрессией белков теплового шока, они могут также регулировать экспрессию белков холодового шока<ref name="Bre10" />. Например, у [[термофил]]ьной бактерии ''[[Thermus thermophilus]]'' экспрессия двух белков массой 7 [[Дальтон (единица измерения)|кДа]] регулируется РНК-термометром<ref>{{cite pmid|20655297}}</ref>, кроме того, похожий механизм был описан у ''[[Escherichia coli]]''<ref name="Giu10" />. |
Хотя РНК-термометры обычно связаны с экспрессией белков теплового шока, они могут также регулировать экспрессию белков холодового шока<ref name="Bre10" />. Например, у [[термофил]]ьной бактерии ''[[Thermus thermophilus]]'' экспрессия двух белков массой 7 [[Дальтон (единица измерения)|кДа]] регулируется РНК-термометром<ref>{{cite pmid|20655297}}</ref>, кроме того, похожий механизм был описан у ''[[Escherichia coli]]''<ref name="Giu10" />. |
||
РНК-термометры, реагирующие на температуру 37 °C, могут использоваться [[патоген]]ными [[микроорганизм]]ами для активации генов, связанных с [[Инфекция|инфекцией]]. Например, путём пришивания гена, кодирующего [[зелёный флуоресцентный белок]], к 5'-концу гена ''{{нп5|prfA||en|PrfA thermoregulator UTR}}'', кодирующего ключевой регулятор транскрипции генов [[Вирулентность|вирулентности]] у ''{{нп5|Listeria monocytogenes||en|Listeria monocytogenes}}'', была продемонстрирована положительная регуляция экспрессии ''prfA'': при [[Транскрипция (биология)|транскрипции]] такого гибридного гена с [[промотор]]а Т7 ''E. coli'' [[флуоресценция]] наблюдалась при 37 °C, но не при 30 °C<ref name="Joh02">{{cite pmid|12230973}}</ref>. |
РНК-термометры, реагирующие на температуру 37 °C, могут использоваться [[патоген]]ными [[микроорганизм]]ами для активации генов, связанных с [[Инфекция|инфекцией]]. Например, путём пришивания гена, кодирующего [[зелёный флуоресцентный белок]], к 5'-концу гена ''{{нп5|prfA||en|PrfA thermoregulator UTR}}'', кодирующего ключевой регулятор транскрипции генов [[Вирулентность|вирулентности]] у ''{{нп5|Listeria monocytogenes||en|Listeria monocytogenes}}'', была продемонстрирована положительная регуляция экспрессии ''prfA'': при [[Транскрипция (биология)|транскрипции]] такого гибридного гена с [[промотор]]а Т7 ''E. coli'' [[флуоресценция]] наблюдалась при 37 °C, но не при 30 °C<ref name="Joh02">{{cite pmid|12230973}}</ref>. РНК-термометры вовлечены в регуляцию вирулентности такой болезнетворной бактерии, как ''{{нп5|Leptospira interrogans||en|Leptospira interrogans}}''. У болезнетворной бактерии ''[[Shigella dysenteriae]]'' и [[патоген]]ных [[штамм]]ов ''[[Escherichia coli]]'' РНК-термометры вовлечены в регуляцию процессов, влияющих на [[патогенез]]<ref name="r2014" /><ref>{{cite pmid|23704938}}</ref>. |
||
| ⚫ | |||
Стоит также отметить, что РНК-термометры могут использоваться не только для регуляции трансляции моно[[цистрон]]ных транскриптов, содержащих одну последовательность Шайна — Дальгарно, но и для полицистронных транскриптов, содержащих несколько последовательностей Шайна — Дальгарно<ref name="r2014" />. |
|||
== РНК-термометры и гипотеза мира РНК == |
== РНК-термометры и гипотеза мира РНК == |
||
| Строка 46: | Строка 52: | ||
Считается, что РНК-термометры и рибопереключатели являются [[Хронология эволюции|эволюционно древними]] элементами, поскольку они широко распространены у самых [[Эволюция (биологическая)|эволюционно]] далёких организмов<ref>{{cite pmid|17846637}}</ref>. Было высказано предположение, что в мире РНК РНК-термометры осуществляли температурозависимую регуляцию других РНК<ref name="Atk06" /><ref>{{cite pmid|18778966}}</ref>. У современных организмов РНК-термометры, возможно, являются «[[Живые ископаемые|молекулярными ископаемыми]]», которые в ушедшем мире РНК были гораздо более распространены, чем сейчас<ref name="Atk06" />. |
Считается, что РНК-термометры и рибопереключатели являются [[Хронология эволюции|эволюционно древними]] элементами, поскольку они широко распространены у самых [[Эволюция (биологическая)|эволюционно]] далёких организмов<ref>{{cite pmid|17846637}}</ref>. Было высказано предположение, что в мире РНК РНК-термометры осуществляли температурозависимую регуляцию других РНК<ref name="Atk06" /><ref>{{cite pmid|18778966}}</ref>. У современных организмов РНК-термометры, возможно, являются «[[Живые ископаемые|молекулярными ископаемыми]]», которые в ушедшем мире РНК были гораздо более распространены, чем сейчас<ref name="Atk06" />. |
||
== Другие примеры == |
|||
Кроме описанных выше РНК-термометров, известны и другие интересные примеры этих РНК. |
|||
* ''Цис''-регуляторный элемент {{нп5|Hsp90||en|Hsp90}} регулирует экспрессию [[Шапероны|шаперона]] hsp90 у [[Drosophila melanogaster|дрозофилы]], повышая его трансляцию при высоких температурах<ref name="Ahm04" />. |
|||
| ⚫ | |||
| ⚫ | |||
== Примечания == |
== Примечания == |
||
Версия от 15:57, 12 июня 2016
РНК-термо́метр, или РНК-термосе́нсор (англ. RNA thermometer, RNA thermosensor, RNAT) — температурочувствительная некодирующая РНК, которая принимает участие в регуляции экспрессии генов. РНК-термометры, как правило, регулируют гены, которые необходимы для ответа на тепловой[англ.] или холодовой шок[англ.], однако показано их участие в регуляции таких процессов, как длительное голодание и патогенность[1].
Принцип работы РНК-термометра заключается в изменении вторичной структуры этой молекулы в ответ на изменение температуры. В ходе этих структурных изменений важные участки этой РНК, например, сайт связывания рибосомы[англ.], выставляются наружу или, наоборот, уходят в глубь молекулы, тем самым влияя на трансляцию близлежащего белоккодирующего гена.
РНК-термометры, наряду с рибопереключателями, служат доводами в поддержку гипотезы мира РНК. Согласно этой теории, сначала единственной нуклеиновой кислотой, представленной в клетках, была РНК, которая впоследствии была заменена современной системой ДНК → РНК → белок[2].
Примерами РНК-термометров могут служить FourU[англ.][3], цис-регуляторный элемент Hsp90[англ.][4], ROSE-элемент[англ.][5], Hsp17-термометр[6].
История изучения
Об открытии первого температурочувствительного РНК-элемента было сообщено в 1989 году[7]. Предшествующие исследования показали, что мутации, располагающиеся выше сайта начала трансляции в мРНК cIII фага лямбда (λ), оказывают влияние на уровень трансляции белка cIII[8]. Этот белок участвует в выборе программы (литический?! или лизогенный?! путь) жизненного цикла фага λ, причём высокая концентрация белка cIII соответствует лизогенному пути[8]. Дальнейшие исследования показали, что у этого вышестоящего участка РНК имеются две альтернативные вторичные структуры. Оказалось, что эти структры не взаимозаменяемы и зависят от концентрации ионов Mg2+ и температуры[7][9]. Сейчас считается, что эти РНК-термометры запускают литический путь в условиях теплового шока, чтобы бактериофаг смог быстро реплицироваться и покинуть клетку-хозяина[1].
Термин «РНК-термометр» не использовался до 1999 года[10], когда так был назван РНК-элемент rpoH бактерии Escherichia coli[11]. В недавнее время с помощью методов биоинформатики было выявлено несколько новых возможных РНК-термометров[12]. В этом случае обычный поиск по последовательностям неэффективен, так как вторичная структура РНК-термометров гораздо более консервативна, чем их нуклеотидные последовательности[12].
Для изучения работы РНК-термометров применяют различные подходы. Для изучения динамики РНК-термометров можно заменять в них обычные нуклеотиды в определённых сайтах на флуоресцентные и, таким образом, наблюдать за их изменениями[13]. Для определения положения РНК-термометра в исследуемой последовательности при определённых температурах был разработан специальный web-сервер RNAthermsw[14]. Для идентификации бактериальных РНК-термометров используются и генетические методы, например, Tet-Trap[15].
В 2016 году было сообщено о создании «термопереключателей» — интеграции температурочувствительных РНК-термометров и аптамеров рибопереключателей в единую структуру. Термопереключатели функционируют как рибопереключатели при низких температурах и реагируют на связывание со своим лигандом изменением структуры, а при высокой температуре они переходят в постоянно «включённое» состояние. Таким образом, термопереключатели — первые РНК-термометры, действующие на уровне транскрипции. Подобные искусственные РНК-регуляторы могут широко применяться для регуляции экспрессии генов[16].
Распространение
Большая часть известных сейчас РНК-термометров располагается в 5'-нетранслируемых областях (5'-UTR) прокариотических мРНК, кодирующих белки теплового шока. Возможно, такие результаты обусловлены смещением отбора[англ.] и непреодолимыми сложностями в поиске коротких неконсервативных последовательностей в геномных данных[17][18].
Хотя большинство известных РНК-термометров обнаружены у прокариот (в том числе цианобактерий[19]), возможные РНК-термометры были выявлены у млекопитающих, в том числе и человека[20]. У человека возможный термосенсор РНК теплового шока-1 (HSR1) активирует транскрипционный фактор теплового шока-1[англ.] (HSF1) и запускает синтез защитных белков при температуре, превышающей 37 °C (нормальную температуру тела[англ.]*), и тем самым защищает клетки от перегревания[20]. Цис-регуляторный элемент Hsp90?! регулирует экспрессию шаперона hsp90 у дрозофилы, повышая его трансляцию при высоких температурах[4].
Структура

Структура РНК-термометров проста и может быть образована короткими последовательностями РНК. Длина наименьшего из известных РНК-термометров составляет 44 нуклеотида. Он располагается в мРНК белка теплового шока (hsp17) у цианобактерии Synechocystis[англ.] sp.PCC 6803[6][6]. В общем случае длина РНК-термометров варьирует от 60 до 110 нуклеотидов[22], и они, как правило, содержат шпильку, в которой небольшая доля оснований не спарена. Они уменьшают стабильность структуры, благодаря чему она может легко расплавляться при повышении температуры[17].
Детальный структурный анализ РНК-термометра ROSE показал, что неспаренные основания на самом деле принимают участие в нестандартном спаривании оснований, которое поддерживает спиральную структуру РНК. Эти необычные пары представлены парами G-G, U-U и UC-U. Поскольку эти неканонические пары относительно нестабильны, повышение температуры вызывает локальное расплавление РНК в этой области, из-за чего последовательность Шайна — Дальгарно выставляется наружу[21].
Некоторые РНК-термометры имеют гораздо более сложную структуру, чем единственная шпилька, как в случае 5'-UTR мРНК CspA[англ.], где РНК-термометр содержит псевдоузел и множество шпилек[23][24].
Были разработаны искусственные РНК-термометры, содержащие одну лишь шпильку[25]. Однако нуклеотидная последовательность столь коротких РНК-термометров может быть чувствительна к мутациям, и замена единственного основания может сделать этот РНК-термометр неактивным in vivo[26].
Механизм

РНК-термометры располагаются в 5'-UTR мРНК, выше кодирующей последовательности[1]. В отличие от рибопереключателей, действующих на уровне транскрипции, трансляции и регуляции стабильности мРНК, все известные на данный момент РНК-термометры действуют на уровне инициации трансляции[16]. Структурные изменения в РНК-термометров могут убирать сайт связывания рибосомы в глубь молекулы и тем самым предотвращать трансляцию мРНК в белок[17]. При повышении температуры шпилечная структура РНК-термометра может плавиться, выставляя наружу сайт связывания рибосомы или последовательность Шайна — Дальгарно (а в некоторых случаях старт-кодон AUG[19]), позволяя малой субъединице рибосомы (30S[англ.]) связаться с мРНК, вслед за чем собирается и весь аппарат трансляции[1]. Старт-кодон, располагающийся, как правило, на 8 нуклеотидов ниже последовательности Шайна — Дальгарно[17], отмечает начало белоккодирующей области?!, которую рибосома транслирует в пептид. Помимо таких цис-действующих РНК-термометров известен единственный транс-действующий РНК-термометр, располагающийся в мРНК RpoS[англ.], где он, как предполагается, регулирует ответ на длительное голодание[1].
В качестве примера можно рассмотреть РНК-термометр FourU Salmonella enterica?![3]. Под действием температур выше 45 °C шпилька, содержащая последовательность Шайна — Дальгарно, плавится, последовательность Шайна—Дальгарно становится неспаренной и трансляция мРНК становится возможной[26]. Показано, что на стабильность FourU влияет концентрация Mg2+[27]. Наиболее изучен РНК-термометр, расположенный в мРНК гена rpoH у E. coli[28]. Этот термосенсор положительно регулирует трансляцию белков теплового шока при высоких температурах посредством специализированного сигма-фактора?! σ32[10].
У Bradyrhizobium japonicum и Rhizobium radiobacter, протеобактерий порядка Rhizobiales, описаны РНК-термометры ROSE1 и ROSEAT2 соответственно. Они располагаются в 5'-UTR HspA и подавляют трансляцию белков теплового шока при физиологических температурах[5][29].
Хотя РНК-термометры обычно связаны с экспрессией белков теплового шока, они могут также регулировать экспрессию белков холодового шока[23]. Например, у термофильной бактерии Thermus thermophilus экспрессия двух белков массой 7 кДа регулируется РНК-термометром[30], кроме того, похожий механизм был описан у Escherichia coli[24].
РНК-термометры, реагирующие на температуру 37 °C, могут использоваться патогенными микроорганизмами для активации генов, связанных с инфекцией. Например, путём пришивания гена, кодирующего зелёный флуоресцентный белок, к 5'-концу гена prfA[англ.], кодирующего ключевой регулятор транскрипции генов вирулентности у Listeria monocytogenes[англ.], была продемонстрирована положительная регуляция экспрессии prfA: при транскрипции такого гибридного гена с промотора Т7 E. coli флуоресценция наблюдалась при 37 °C, но не при 30 °C[31]. РНК-термометры вовлечены в регуляцию вирулентности такой болезнетворной бактерии, как Leptospira interrogans[англ.]. У болезнетворной бактерии Shigella dysenteriae и патогенных штаммов Escherichia coli РНК-термометры вовлечены в регуляцию процессов, влияющих на патогенез[19][32].
Иногда оперон может регулироваться несколькими РНК-термометрами. Предсказано, что оперон ibpAB E. coli содержит два кооперативных РНК-термометра: элемент ROSE и IbpB-термометр[англ.][33].
Стоит также отметить, что РНК-термометры могут использоваться не только для регуляции трансляции моноцистронных транскриптов, содержащих одну последовательность Шайна — Дальгарно, но и для полицистронных транскриптов, содержащих несколько последовательностей Шайна — Дальгарно[19].
РНК-термометры и гипотеза мира РНК
Гипотеза мира РНК утверждает, что изначально РНК и выступала носителем наследственной информации, и осуществляла ферментативные процессы, причём различные последовательности РНК выступали биокатализаторами, регуляторами и сенсорами[34]. Позже под действием отбора большая часть функций, выполняемых РНК, стала выполняться другими биомолекулами, и на смену жизни, основанной исключительно на РНК, пришла жизнь, основанная на ДНК, РНК и белке[2].
Считается, что РНК-термометры и рибопереключатели являются эволюционно древними элементами, поскольку они широко распространены у самых эволюционно далёких организмов[35]. Было высказано предположение, что в мире РНК РНК-термометры осуществляли температурозависимую регуляцию других РНК[2][36]. У современных организмов РНК-термометры, возможно, являются «молекулярными ископаемыми», которые в ушедшем мире РНК были гораздо более распространены, чем сейчас[2].
Примечания
- ↑ 1 2 3 4 5 6 Narberhaus F., Waldminghaus T., Chowdhury S. RNA thermometers. (англ.) // FEMS microbiology reviews. — 2006. — Vol. 30, no. 1. — P. 3—16. — doi:10.1111/j.1574-6976.2005.004.x. — PMID 16438677.
- ↑ 1 2 3 4 Atkins, John F.; Gesteland, Raymond F.; Cech, Thomas. The RNA world: the nature of modern RNA suggests a prebiotic RNA world. — Plainview, N.Y : Cold Spring Harbor Laboratory Press, 2006. — ISBN 0-87969-739-3.
- ↑ 1 2 Waldminghaus T., Heidrich N., Brantl S., Narberhaus F. FourU: a novel type of RNA thermometer in Salmonella. (англ.) // Molecular microbiology. — 2007. — Vol. 65, no. 2. — P. 413—424. — doi:10.1111/j.1365-2958.2007.05794.x. — PMID 17630972.
- ↑ 1 2 Ahmed R., Duncan R. F. Translational regulation of Hsp90 mRNA. AUG-proximal 5'-untranslated region elements essential for preferential heat shock translation. (англ.) // The Journal of biological chemistry. — 2004. — Vol. 279, no. 48. — P. 49919—49930. — doi:10.1074/jbc.M404681200. — PMID 15347681.
- ↑ 1 2 Nocker A., Hausherr T., Balsiger S., Krstulovic N. P., Hennecke H., Narberhaus F. A mRNA-based thermosensor controls expression of rhizobial heat shock genes. (англ.) // Nucleic acids research. — 2001. — Vol. 29, no. 23. — P. 4800—4807. — PMID 11726689.
- ↑ 1 2 3 Kortmann J., Sczodrok S., Rinnenthal J., Schwalbe H., Narberhaus F. Translation on demand by a simple RNA-based thermosensor. (англ.) // Nucleic acids research. — 2011. — Vol. 39, no. 7. — P. 2855—2868. — doi:10.1093/nar/gkq1252. — PMID 21131278.
- ↑ 1 2 Altuvia S., Kornitzer D., Teff D., Oppenheim A. B. Alternative mRNA structures of the cIII gene of bacteriophage lambda determine the rate of its translation initiation. (англ.) // Journal of molecular biology. — 1989. — Vol. 210, no. 2. — P. 265—280. — PMID 2532257.
- ↑ 1 2 Altuvia S., Oppenheim A. B. Translational regulatory signals within the coding region of the bacteriophage lambda cIII gene. (англ.) // Journal of bacteriology. — 1986. — Vol. 167, no. 1. — P. 415—419. — PMID 2941413.
- ↑ Altuvia S., Kornitzer D., Kobi S., Oppenheim A. B. Functional and structural elements of the mRNA of the cIII gene of bacteriophage lambda. (англ.) // Journal of molecular biology. — 1991. — Vol. 218, no. 4. — P. 723—733. — PMID 1827163.
- ↑ 1 2 Storz G. An RNA thermometer. (англ.) // Genes & development. — 1999. — Vol. 13, no. 6. — P. 633—636. — PMID 10090718.
- ↑ Morita M. T., Tanaka Y., Kodama T. S., Kyogoku Y., Yanagi H., Yura T. Translational induction of heat shock transcription factor sigma32: evidence for a built-in RNA thermosensor. (англ.) // Genes & development. — 1999. — Vol. 13, no. 6. — P. 655—665. — PMID 10090722.
- ↑ 1 2 Waldminghaus T., Gaubig L. C., Narberhaus F. Genome-wide bioinformatic prediction and experimental evaluation of potential RNA thermometers. (англ.) // Molecular genetics and genomics : MGG. — 2007. — Vol. 278, no. 5. — P. 555—564. — doi:10.1007/s00438-007-0272-7. — PMID 17647020.
- ↑ Narayan S., Kombrabail M. H., Das S., Singh H., Chary K. V., Rao B. J., Krishnamoorthy G. Site-specific fluorescence dynamics in an RNA 'thermometer' reveals the role of ribosome binding in its temperature-sensitive switch function. (англ.) // Nucleic acids research. — 2015. — Vol. 43, no. 1. — P. 493—503. — doi:10.1093/nar/gku1264. — PMID 25477380.
- ↑ Churkin A., Avihoo A., Shapira M., Barash D. RNAthermsw: direct temperature simulations for predicting the location of RNA thermometers. (англ.) // Public Library of Science ONE. — 2014. — Vol. 9, no. 4. — P. e94340. — doi:10.1371/journal.pone.0094340. — PMID 24718440.
- ↑ Delvillani F., Sciandrone B., Peano C., Petiti L., Berens C., Georgi C., Ferrara S., Bertoni G., Pasini M. E., Dehò G., Briani F. Tet-Trap, a genetic approach to the identification of bacterial RNA thermometers: application to Pseudomonas aeruginosa. (англ.) // RNA (New York, N.Y.). — 2014. — Vol. 20, no. 12. — P. 1963—1976. — doi:10.1261/rna.044354.114. — PMID 25336583.
- ↑ 1 2 Roßmanith J., Narberhaus F. Exploring the modular nature of riboswitches and RNA thermometers. (англ.) // Nucleic acids research. — 2016. — doi:10.1093/nar/gkw232. — PMID 27060146.
- ↑ 1 2 3 4 Narberhaus F. Translational control of bacterial heat shock and virulence genes by temperature-sensing mRNAs. (англ.) // RNA biology. — 2010. — Vol. 7, no. 1. — P. 84—89. — PMID 20009504.
- ↑ Johansson J. RNA thermosensors in bacterial pathogens. (англ.) // Contributions to microbiology. — 2009. — Vol. 16. — P. 150—160. — doi:10.1159/000219378. — PMID 19494584.
- ↑ 1 2 3 4 Krajewski S. S., Narberhaus F. Temperature-driven differential gene expression by RNA thermosensors. (англ.) // Biochimica et biophysica acta. — 2014. — Vol. 1839, no. 10. — P. 978—988. — doi:10.1016/j.bbagrm.2014.03.006. — PMID 24657524.
- ↑ 1 2 Shamovsky I., Ivannikov M., Kandel E. S., Gershon D., Nudler E. RNA-mediated response to heat shock in mammalian cells. (англ.) // Nature. — 2006. — Vol. 440, no. 7083. — P. 556—560. — doi:10.1038/nature04518. — PMID 16554823.
- ↑ 1 2 Chowdhury S., Maris C., Allain F. H., Narberhaus F. Molecular basis for temperature sensing by an RNA thermometer. (англ.) // The EMBO journal. — 2006. — Vol. 25, no. 11. — P. 2487—2497. — doi:10.1038/sj.emboj.7601128. — PMID 16710302.
- ↑ Waldminghaus T., Fippinger A., Alfsmann J., Narberhaus F. RNA thermometers are common in alpha- and gamma-proteobacteria. (англ.) // Biological chemistry. — 2005. — Vol. 386, no. 12. — P. 1279—1286. — doi:10.1515/BC.2005.145. — PMID 16336122.
- ↑ 1 2 Breaker R. R. RNA switches out in the cold. (англ.) // Molecular cell. — 2010. — Vol. 37, no. 1. — P. 1—2. — doi:10.1016/j.molcel.2009.12.032. — PMID 20129048.
- ↑ 1 2 Giuliodori A. M., Di Pietro F., Marzi S., Masquida B., Wagner R., Romby P., Gualerzi C. O., Pon C. L. The cspA mRNA is a thermosensor that modulates translation of the cold-shock protein CspA. (англ.) // Molecular cell. — 2010. — Vol. 37, no. 1. — P. 21—33. — doi:10.1016/j.molcel.2009.11.033. — PMID 20129052.
- ↑ Neupert J., Karcher D., Bock R. Design of simple synthetic RNA thermometers for temperature-controlled gene expression in Escherichia coli. (англ.) // Nucleic acids research. — 2008. — Vol. 36, no. 19. — P. e124. — doi:10.1093/nar/gkn545. — PMID 18753148.
- ↑ 1 2 Nikolova E. N., Al-Hashimi H. M. Thermodynamics of RNA melting, one base pair at a time. (англ.) // RNA (New York, N.Y.). — 2010. — Vol. 16, no. 9. — P. 1687—1691. — doi:10.1261/rna.2235010. — PMID 20660079.
- ↑ Rinnenthal J., Klinkert B., Narberhaus F., Schwalbe H. Modulation of the stability of the Salmonella fourU-type RNA thermometer. (англ.) // Nucleic acids research. — 2011. — Vol. 39, no. 18. — P. 8258—8270. — doi:10.1093/nar/gkr314. — PMID 21727085.
- ↑ Shah P., Gilchrist M. A. Is thermosensing property of RNA thermometers unique? (англ.) // Public Library of Science ONE. — 2010. — Vol. 5, no. 7. — P. e11308. — doi:10.1371/journal.pone.0011308. — PMID 20625392.
- ↑ Balsiger S., Ragaz C., Baron C., Narberhaus F. Replicon-specific regulation of small heat shock genes in Agrobacterium tumefaciens. (англ.) // Journal of bacteriology. — 2004. — Vol. 186, no. 20. — P. 6824—6829. — doi:10.1128/JB.186.20.6824-6829.2004. — PMID 15466035.
- ↑ Mega R., Manzoku M., Shinkai A., Nakagawa N., Kuramitsu S., Masui R. Very rapid induction of a cold shock protein by temperature downshift in Thermus thermophilus. (англ.) // Biochemical and biophysical research communications. — 2010. — Vol. 399, no. 3. — P. 336—340. — doi:10.1016/j.bbrc.2010.07.065. — PMID 20655297.
- ↑ Johansson J., Mandin P., Renzoni A., Chiaruttini C., Springer M., Cossart P. An RNA thermosensor controls expression of virulence genes in Listeria monocytogenes. (англ.) // Cell. — 2002. — Vol. 110, no. 5. — P. 551—561. — PMID 12230973.
- ↑ Kouse A. B., Righetti F., Kortmann J., Narberhaus F., Murphy E. R. RNA-mediated thermoregulation of iron-acquisition genes in Shigella dysenteriae and pathogenic Escherichia coli. (англ.) // Public Library of Science ONE. — 2013. — Vol. 8, no. 5. — P. e63781. — doi:10.1371/journal.pone.0063781. — PMID 23704938.
- ↑ Gaubig L. C., Waldminghaus T., Narberhaus F. Multiple layers of control govern expression of the Escherichia coli ibpAB heat-shock operon. (англ.) // Microbiology (Reading, England). — 2011. — Vol. 157, no. Pt 1. — P. 66—76. — doi:10.1099/mic.0.043802-0. — PMID 20864473.
- ↑ Walter Gilbert (February 1986). "The RNA World". Nature. 319 (6055): 618—618. Bibcode:1986Natur.319..618G. doi:10.1038/319618a0.
- ↑ Serganov A., Patel D. J. Ribozymes, riboswitches and beyond: regulation of gene expression without proteins. (англ.) // Nature reviews. Genetics. — 2007. — Vol. 8, no. 10. — P. 776—790. — doi:10.1038/nrg2172. — PMID 17846637.
- ↑ Bocobza S. E., Aharoni A. Switching the light on plant riboswitches. (англ.) // Trends in plant science. — 2008. — Vol. 13, no. 10. — P. 526—533. — doi:10.1016/j.tplants.2008.07.004. — PMID 18778966.
Литература
- O. Ю. Лиманская, Л. А. Муртазаева, А. П. Лиманский. Поиск новых потенциальных РНК-термометров в геноме Salmonella enterica. // Микробиология. — 2013. — Т. 82, № 1. — С. 69—78.
- Righetti F., Narberhaus F. How to find RNA thermometers. (англ.) // Frontiers in cellular and infection microbiology. — 2014. — Vol. 4. — P. 132. — doi:10.3389/fcimb.2014.00132. — PMID 25279353.
- Krajewski S. S., Narberhaus F. Temperature-driven differential gene expression by RNA thermosensors. (англ.) // Biochimica et biophysica acta. — 2014. — Vol. 1839, no. 10. — P. 978—988. — doi:10.1016/j.bbagrm.2014.03.006. — PMID 24657524.
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |