Альдолаза A
| Альдолаза A | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | fructose-1,6-bisphosphate triosephosphate-lyasemuscle-type aldolasefructose-bisphosphate aldolase Alung cancer antigen NY-LU-1aldolase Afructose-bisphosphateALDOAepididymis secretory sperm binding protein Li 87p | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| фруктозо-бисфосфат альдолаза | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 4.1.2.13 |
| Номер CAS | 9024-52-6 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9024-52-6 |
Альдолаза A, также фруктозо-бисфосфат альдолаза A или реже мышечный тип альдолазы (англ. Aldolase A, сокр. ALDOA) — фермент (КФ 4.1.2.13) из семейства фруктозо-1,6-бисфосфат альдолазы I класса (класс лиазы), является одним из трёх изоферментов (A, B и C). Альдолаза А играет ключевую роль в углеводном обмене: в глюконеогенезе и гликолизе в скелетных мышцах и эритроцитах. Фермент катализирует обратимую реакцию альдольного расщепления (негидролитического) и конденсации молекулы фруктозо-1,6-бисфосфата по реакции:
- фруктозо-1,6-бисфосфат
 дигидроксиацетонфосфат + глицеральдегид-3-фосфат.
дигидроксиацетонфосфат + глицеральдегид-3-фосфат.
В результате альдольного расщепления фруктозо-1,6-бисфосфата, происходящего в процессе гликолиза, образуются два триозофосфата — дигидроксиацетонфосфат (ДАФ) и глицеральдегид-3-фосфат (ГАФ) соответственно, обратная реакция — альдольная конденсация приводит к образованию фруктозо-1,6-бисфосфата в глюконеогенезе.
Экспрессия альдолазы А подавляется в печени, почках и кишечнике взрослых и аналогична уровням альдолазы C в мозге и других нервных тканях. Дефицит альдолазы А связан с миопатией и гемолитической анемией. Альтернативный сплайсинг и использование альтернативного промотора приводят к образованию множества вариантов транскрипта. Родственные псевдогены были идентифицированы на хромосомах 3 и 10[1].
Альдолаза A кодируется геном ALDOA, который у человека локализован на коротком плече (p-плече) 16-й хромосомы.
Структура[править | править код]
Альдолаза A представляет собой гомотетрамер и один из трёх изоферментов альдолазы (A, B и C), кодируемых тремя различными генами[2][3]. Ген ALDOA содержит 8 экзонов и 5'-UTR IB[3]. Идентифицированы ключевые аминокислоты, отвечающие за его каталитическую функцию. Остаток Tyr363 выполняет функцию кислотно-основного катализатора протонирования С3 субстрата, а Lys146, как предполагается, стабилизирует отрицательный заряд образующегося сопряжённого основания Tyr363 и напряжённую конфигурацию С-конца. Остаток Glu187 участвует во множестве функций, включая катализ альдолазой молекулы Ф-1,6-БФ, кислотно-основной катализ при связывании субстрата, дегидратацию и расщепление субстрата[4]. Хотя альдолаза А локализуется в ядре, у неё отсутствуют известные сигналы ядерной локализации[5].
Функции[править | править код]
Альдолаза А — ключевой фермент четвёртой реакции гликолиза, а также обратной реакции в глюконеогенезе. Она катализирует обратимое превращение фруктозо-1,6-бисфосфата в глицеральдегид-3-фосфат и дигидроксиацетонфосфат путём альдольного расщепления связи C3-C4. В результате альдолаза является важнейшим участником биосинтеза АТФ[2][4][5][6][7]. ALDOA также участвует в других "подрабатывающих" функциях (минорных), таких как поддержание мышц, регуляция формы и подвижности клеток, сокращение поперечно-полосатых мышц, организация актинового цитоскелета и регуляция пролиферации клеток[2][5][6]. Альдолаза A, вероятно, регулирует ремоделирование актинового цитоскелета через взаимодействие с цитогезином-2 (ARNO) и Arf6[6].
Альдолаза A является убиквитарной и экспрессируется в большинстве тканей, но преимущественно в мышцах развивающегося эмбриона и взрослого человека[2][7]. В лимфоцитах ALDOA является преобладающей изоформой альдолазы[7]. Внутри клетки альдолаза А обычно локализуется в цитозоле, но может локализоваться и в ядре во время синтеза ДНК (S-фаза клеточного цикла). Эта ядерная локализация регулируется протеинкиназами AKT и p38. Предполагается, что ядро служит резервуаром для ALDOA в условиях низкого уровня глюкозы[5]. Фермент также обнаружен в митохондриях[7].
Альдолаза A регулируется субстратами энергетического метаболизма — глюкозой, лактатом и глутамином[5]. В тучных клетках (мастоцитах) человека, фермент подвергается посттрансляционной модификации путём нитрозирования молекул тирозина в белке, что может изменять его относительное сродство к Ф-1,6-БФ и/или к инозитолтрифосфату (ИФ3). Такое изменение сродства в дальнейшем влияет на сигнальные каскады ИФ3 и фосфолипазы C (PLC) в IgE-зависимых реакциях[7].
Механизм катализа[править | править код]
В альдолазе млекопитающих ключевыми каталитическими аминокислотными остатками, участвующими в реакции, являются лизин и тирозин. Тирозин выступает в качестве эффективного акцептора водорода, а лизин ковалентно связывает и стабилизирует интермедиаты (промежуточные продукты).
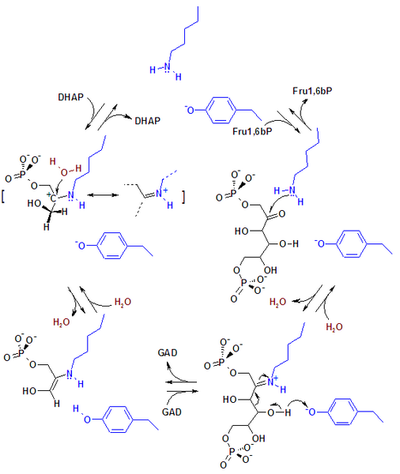 Механизм катализа альдолазы A. Сокращения: DHAP — дигидроксиацетонфосфат; Fru1,6bP — Фруктозо-1,6-бисфосфат; GAD — глицеральдегид-3-фосфат;Боковые цепи аминокислот реактивного участка фермента показаны на рисунке blue. |
Клиническое значение[править | править код]
Альдолаза А (ALDOA) высоко экспрессируется в опухолевых клетках многих видов рака, включая плоскоклеточную карциному лёгкого (ПККЛ), рак почек и гепатоцеллюлярную карциному. Предполагается, что сверхэкспрессия ALDOA усиливает гликолиз в этих опухолевых клетках, способствуя их росту. В клетках плоскоклеточной карциномы лёгкого её повышение коррелирует с метастазированием и плохим прогнозом, а снижение — с уменьшением подвижности опухолевых клеток и снижением опухолевого генеза. Таким образом, ALDOA может быть потенциальным биомаркером ПККЛ и терапевтической мишенью для лекарственных препаратов[2].
Дефицит альдолазы А — редкое аутосомно-рецессивное заболевание, связанное с гемолизом и сопровождающееся слабостью, мышечными болями и миопатией[3].
Взаимодействия с белками[править | править код]
Показано, что альдолаза А взаимодействует с:
- PLD2,[8]
- актином,[7]
- GLUT4,[9]
- фосфолипазой D2,[9]
- лёгкой цепью 8 динеина,[9]
- анионообменным белком эритроцитов Band3,[9]
- гуанидиновым рецептором[7]
- Цитогезином-2,[6] и
- V-AТФазой (вакулярный тип H+-АТФазы)[6].
Примечания[править | править код]
- ↑ Entrez Gene: ALDOA aldolase A, fructose-bisphosphate.
- ↑ 1 2 3 4 5 Du, S; Guan, Z; Hao, L; Song, Y; Wang, L; Gong, L; Liu, L; Qi, X; Hou, Z; Shao, S (2014). "Fructose-bisphosphate aldolase a is a potential metastasis-associated marker of lung squamous cell carcinoma and promotes lung cell tumorigenesis and migration". PLOS ONE. 9 (1): e85804. Bibcode:2014PLoSO...985804D. doi:10.1371/journal.pone.0085804. PMC 3900443. PMID 24465716.
- ↑ 1 2 3 Yao, DC; Tolan, DR; Murray, MF; Harris, DJ; Darras, BT; Geva, A; Neufeld, EJ (15 March 2004). "Hemolytic anemia and severe rhabdomyolysis caused by compound heterozygous mutations of the gene for erythrocyte/muscle isozyme of aldolase, ALDOA(Arg303X/Cys338Tyr)". Blood. 103 (6): 2401—3. doi:10.1182/blood-2003-09-3160. PMID 14615364.
- ↑ 1 2 Tittmann, K (December 2014). "Sweet siblings with different faces: the mechanisms of FBP and F6P aldolase, transaldolase, transketolase and phosphoketolase revisited in light of recent structural data". Bioorganic Chemistry. 57: 263—80. doi:10.1016/j.bioorg.2014.09.001. PMID 25267444.
- ↑ 1 2 3 4 5 Mamczur, P; Gamian, A; Kolodziej, J; Dziegiel, P; Rakus, D (December 2013). "Nuclear localization of aldolase A correlates with cell proliferation". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1833 (12): 2812—22. doi:10.1016/j.bbamcr.2013.07.013. PMID 23886627.
- ↑ 1 2 3 4 5 Merkulova, M; Hurtado-Lorenzo, A; Hosokawa, H; Zhuang, Z; Brown, D; Ausiello, DA; Marshansky, V (June 2011). "Aldolase directly interacts with ARNO and modulates cell morphology and acidic vesicle distribution". American Journal of Physiology. Cell Physiology. 300 (6): C1442-55. doi:10.1152/ajpcell.00076.2010. PMC 3118619. PMID 21307348.
- ↑ 1 2 3 4 5 6 7 Sekar, Y; Moon, TC; Slupsky, CM; Befus, AD (1 July 2010). "Protein tyrosine nitration of aldolase in mast cells: a plausible pathway in nitric oxide-mediated regulation of mast cell function". Journal of Immunology. 185 (1): 578—87. doi:10.4049/jimmunol.0902720. PMID 20511553.
- ↑ Kim, Jong Hyun; Lee Sukmook; Kim Jung Hwan; Lee Taehoon G; Hirata Masato; Suh Pann-Ghill; Ryu Sung Ho (Mar 2002). "Phospholipase D2 directly interacts with aldolase via Its PH domain". Biochemistry. United States. 41 (10): 3414—21. doi:10.1021/bi015700a. ISSN 0006-2960. PMID 11876650.
- ↑ 1 2 3 4 St-Jean, M; Izard, T; Sygusch, J (11 May 2007). "A hydrophobic pocket in the active site of glycolytic aldolase mediates interactions with Wiskott-Aldrich syndrome protein". The Journal of Biological Chemistry. 282 (19): 14309—15. doi:10.1074/jbc.m611505200. PMID 17329259.
