Синдром нечувствительности к андрогенам
| Синдром нечувствительности к андрогенам | |
|---|---|
 Структура тестостерона. | |
| МКБ-11 | LD2A.4 |
| МКБ-10 | E34.5 |
| МКБ-10-КМ | E34.50, E34.51 и E34.5 |
| МКБ-9 | 259.5 |
| МКБ-9-КМ | 259.5[1] и 259.51[1] |
| OMIM | 312300 |
| DiseasesDB | 29662 |
| MedlinePlus | 001180 |
| eMedicine | ped/2222 |
| MeSH | D013734 |

Синдро́м нечувстви́тельности к андроге́нам (синдро́м резисте́нтности к андроге́нам, синдром Морриса, синдром тестикуля́рной феминиза́ции[2]; англ. Androgen insensitivity syndrome — AIS) — врожденные эндокринные вариации полового развития, вызванные мутацией гена, отвечающего за андрогеновый рецептор. Подобные синдромы варьируются в зависимости от структуры и чувствительности аномального рецептора. Клинические фенотипы находятся в диапазоне от номинального мужского телосложения с мягким синдромом сперматогенеза до крайне феминного телосложения, в дополнение к наличию Y-хромосомы[3][4][5].
Нечувствительность к андрогенам является клинически значимой только для людей с Y-хромосомой, или, более конкретно, с геном SRY [3].
Для синдрома характерно X-сцепленное рецессивное наследование.
Синдром нечувствительности к андрогенам делится на три типа, которые различаются по степени маскулинизации гениталий: синдром полной нечувствительности к андрогенам (когда наружные гениталии имеют женский фенотип); синдром лёгкой нечувствительности к андрогенам (когда наружные гениталии имеют мужской фенотип) и синдром частичной нечувствительности к андрогенам (когда наружные гениталии частично, но не полностью, маскулинизированы)[6][7][8][9][10][11][12][13][14]. Синдром нечувствительности к андрогенам это наиболее частая причина гениталий неопределённого типа у людей с кариотипом 46.XY[15].
Помощь пациентам с данным состоянием на текущий момент проводится симптоматически; в настоящее время не существует метода для коррекции неправильно функционирующих рецепторов белков к андрогенам, происходящих из-за мутаций гена AR. Области в которых оказывается медицинская помощь включают в себя генитопластику (по желанию пациента), гонадэктомию (в случаях развития риска опухолей), заместительную гормональную терапию, генетическое консультирование и психологическую помощь.
Генетика
[править | править код]Рецептор андрогена человека (AR) представляет собой белок, кодируемый геном, расположенным на проксимальном длинном плече Х-хромосомы (локус Xq11-Xq12)[16]. Область, кодирующая белок, состоит из приблизительно 2757 нуклеотидов (919 кодонов), охватывающих восемь экзонов, обозначенных 1-8 или A-H[3][17]. Интроны различаются по размеру от 0,7 до 26 кб[17]. Как и другие ядерные рецепторы, белок AR состоит из нескольких функциональных доменов: домена трансактивации (также называемого доменом регуляции транскрипции или амино / NH2-терминальным доменом), ДНК-связывающего домена, шарнирной области и стероид-связывающего домен (также называемый карбоксильным лиганд-связывающим доменом)[3][7][17][14]. Домен трансактивации кодируется экзоном 1 и составляет более половины белка AR[17]. Экзоны 2 и 3 кодируют ДНК-связывающий домен, тогда как 5'-часть экзона 4 кодирует шарнирную область[17]. Остальная часть экзонов с 4 по 8 кодирует лиганд-связывающий домен[17].

Мутации в гене AR
[править | править код]По состоянию на 2010г. в базе данных мутаций AR зарегистрировано более 400 разновидностей мутаций этого гена, и их число продолжает расти[7]. Наследование обычно происходит по материнской линии путём X-сцепленного рецессивного наследования[3][18]. Примерно в 30% случаев мутация гена AR имеет спонтанный характер и не наследуется[11]. Такие мутации de novo являются результатом мутации гоноцита или мозаицизма в гоноците в гонаде одного из родителей или мутаций в самой оплодотворенной яйцеклетке[19]. В одном исследовании[20] три из восьми мутаций de novo произошли на постзиготически[3]. Не каждая мутация гена AR приводит к нечувствительности к андрогенам; одна конкретная мутация встречается у 8–14% генетических мужчин[21][22][23][24], и, как полагают, отрицательно влияет на небольшое количество особей при наличии других генетических факторов[25].
Другие причины
[править | править код]У некоторых людей с полной или частичной нечувствительностью нет мутаций гена AR, несмотря на клинические, гормональные и гистологические особенности, необходимые для установления диагноза синдром нечувствительности к андрогенам; до 5% женщин с полной нечувствительностью к андрогенам не имеют мутации гена AR[7], а также от 27[9][26] до 72%[27] людей с частичной нечувствительностью к андрогенам.
У одного пациента основной причиной предполагаемой частичной нечувствительности к андрогенам была мутация белка стероидогенного фактора-1 (SF-1)[28]. У другого пациента полная нечувствительность к андрогенам была результатом дефицита в передаче трансактивирующего сигнала от N-концевой области нормального рецептора андрогена к основному механизму транскрипции клетки[29].
XY кариотип
[править | править код]В зависимости от мутации, человек с кариотипом 46,XY и нечувствительностью к андрогенам может иметь мужской или женский фенотип[30] или могут иметь гениталии промежуточного типа[31]. У таких людей гонады являются яичками независимо от фенотипа из-за наличия Y-хромосомы[32][33]. Человек 46,XY, таким образом, может не имееть яичников или матки, внешне не отличаясь при этом от женщины с кариотипом 46,XX[34].
Было опубликовано несколько тематических исследований фертильных мужчин с кариотипом 46,XY и нечувствительностью к андрогенам[35][36][37][38][39], хотя эта группа считается малочисленной[14]. Кроме того, некоторые бесплодные мужчины с легкой формой нечувствительности к андрогенам смогли зачать детей после увеличения количества сперматозоидов с помощью дополнительного тестостерона[3][40]. Генетический мужчина, зачатый мужчиной с нечувствительностью к андрогенам, не получит Х-хромосому своего отца и, следовательно, не наследует и не несет ген синдрома. Генетическая женщина, зачатая таким образом, получит Х-хромосому своего отца, следовательно, станет носителем.
ХХ кариотип
[править | править код]Генетические женщины (кариотип 46,ХХ) имеют две Х-хромосомы, поэтому имеют два гена AR. Мутация в одном (но не в обоих) приводит минимальным проявлениям. Эти женщины фертильны и являются носителями мутации. Было отмечено, что у некоторых носителей слегка уменьшено количество волос на теле, наблюдаются задержки полового созревание и/или наблюдается высокий рост, вероятно, из-за искаженной инактивации Х-хромосомы[17][35]. Женщина-носитель будет передавать мутировавший ген AR своим детям в 50% случаев. Если ребенок, получивший мутацию - генетически женщина, то она тоже будет носителем мутации. Если ребенок, получивший мутацию - генетически мужчина, то у него будет нечувствительность к андрогенам.
Генетическая женщина с мутациями в обоих генах AR теоретически может возникнуть в результате объединения фертильного мужчины с нечувствительностью к андрогенам и женщиной-носителя гена с мутацией или в результате мутации de novo. Однако, учитывая малое количество фертильных мужчин с нечувствительностью к андрогенам и низкий уровень мутации гена AR, шансы на это невелики. Фенотип такого человека является предметом спекуляций; по состоянию на 2010 год, не было зарегистрировано таких случаев.
Патофизиология
[править | править код]
Андрогены в развитии плода
[править | править код]Эмбрионы человека развиваются одинаково в течение первых шести недель, независимо от генетического пола (46,XX или 46,XY); единственный способ определить разницу между 46,XX или 46,XY эмбрионами в этот период времени — это поиск телец Барра или Y-хромосомы[42]. Гонады изначально представляют собой выпуклости ткани, называемые генитальным бугорком. К пятой неделе генитальный бугорок превращается в индифферентные гонады[42]. К шестой неделе индифферентные гонады начинают дифференцироваться в зависимости от генетического пола. Если кариотип 46,XY, яички развиваются из-за влияния гена SRY Y-хромосомы[33][32]. Этот процесс не требует присутствия андрогена или функционального рецептора андрогена[32][33].
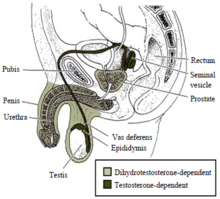
Примерно до седьмой недели развития зародыш имеет индифферентные протоки, которые состоят из двух пар протоков: мюллеровых и вольфовых[42]. Примерно в это время клетки Сертоли в яичках выделяют антимюллеров гормон, чтобы подавить развитие мюллеровых протоков и вызвать их дегенерацию[42]. Если этого не происходит, то мюллеровы протоки развиваются в женские половые органы (матка, шейка матки, фаллопиевы трубы и верхняя часть влагалища)[42]. В отличие от мюллеровых протоков, вольфовы протоки не будут развиваться по умолчанию[43]. При наличии тестостерона и функциональных андрогенных рецепторов протоки Вольфа превращаются в эпидидимис, семявыносящие протоки и семенные пузырьки[42]. Если яички не способны секретировать тестостерон или андрогенные рецепторы не функционируют должным образом, протоки Вольфа вырождаются[44].
Маскулинизация мужских половых органов зависит как от тестостерона, так и от дигидротестостерона[41].
Маскулинизация мужских наружных половых органов, а также предстательной железы, зависит от андрогенного дигидротестостерона[45][46][47][48]. Тестостерон превращается в дигидротестостерон с помощью фермента 5-альфа-редуктазы[49]. Если этот фермент отсутствует или его мало, то дигидротестостерон не генерируется, и внешние мужские гениталии не развиваются должным образом[45][46][47][48][49]. Как и в случае с внутренними мужскими органами, для дигидротестостерона необходим функциональный рецептор андрогена, чтобы регулировать транскрипцию генов-мишеней, участвующих в развитии[50].
Патогенез нечувствительности к андрогенам
[править | править код]Мутации в гене рецептора андрогена могут вызывать проблемы на любом из этапов андрогенизации, начиная с синтеза самого белка рецептора андрогена и заканчивая транскрипционной способностью димеризованного комплекса андроген-АР[17]. Нечувствительность к андрогенам может привести к значительному нарушению хотя бы одного из этих этапов, поскольку каждый шаг необходим андрогенам для успешной активации AR и регуляции экспрессии генов[17]. То, какие именно этапы будут мешать конкретной мутации, можно до некоторой степени предсказать, идентифицируя область AR, в которой находится мутация. Эта прогнозирующая способность в основном имеет ретроспективный характер; различные функциональные домены гена AR были выяснены путем анализа эффектов специфических мутаций в различных областях AR[17]. Например, известно, что мутации в стероидсвязывающем домене влияют на сродство или удержание андроген-связывающего вещества, известно, что мутации в шарнирной области влияют на транслокацию ядер, известно, что мутации в ДНК-связывающем домене влияют на димеризацию и связывание с мишенью. Известно, что ДНК и мутации в домене трансактивации влияют на регуляцию транскрипции гена-мишени[17][43]. Даже когда пораженный функциональный домен известен, предсказать фенотипические последствия конкретной мутации сложно.
Некоторые мутации могут отрицательно повлиять на более чем один функциональный домен. Например, мутация в одном функциональном домене может оказывать вредное влияние на другой, изменяя способ взаимодействия доменов[43]. Одиночная мутация может повлиять на все нижестоящие функциональные домены, если результатом является преждевременный стоп-кодон или ошибка кадрирования; такая мутация может привести к совершенно непригодному (или несинтезируемому) белку рецептора андрогена[17]. Стероидсвязывающий домен особенно чувствителен к эффектам преждевременного стоп-кодона или ошибочному кадрированию, поскольку он возникает в конце гена, и поэтому его информация, скорее всего, будет усечена или неверно истолкована, чем другие функциональные домены[17].
Другие, более сложные отношения наблюдались как следствие мутированного AR; некоторые мутации, связанные с мужскими фенотипами, были связаны с мужским раком молочной железы, раком простаты или, в случае спинальной и бульбарной мышечной атрофии, заболеванием центральной нервной системы[51][52][53][54][55]. Форма рака молочной железы, наблюдаемая у некоторых мужчин с частичной нечувствительностью к андрогенам, вызвана мутацией в ДНК-связывающем домене AR[53][55]. Считается, что эта мутация вызывает нарушение взаимодействия гена-мишени AR, что позволяет ему действовать на определенных дополнительных мишенях, возможно, в сочетании с белком рецептора эстрогена, вызывая рост раковых клеток[17]. Патогенез спинальной и бульбарной мышечной атрофии показывает, что даже сам мутантный белок AR может привести к патологии. Расширение тринуклеотидного повтора полиглатаминового тракта гена AR, связанного с этой атрофией, приводит к синтезу неправильно свернутого белка AR, который клетка не может протеолизовать должным образом[56]. Эти неправильно свернутые AR-белки образуют агрегаты в цитоплазме и ядре клетки[56]. В течение 30-50 лет эти агрегаты накапливаются и оказывают цитотоксическое действие, что в конечном итоге приводит к нейродегенеративным симптомам, связанным с атрофией[56].
Диагностика
[править | править код]
Варианты фенотипа, возникающие из-за нечувствительности к андрогенам, не являются уникальными для этого состояния, поэтому диагностика требует полного исключения других причин[15][57]. Клинические признаки, указывающие на нечувствительность к андрогенам, включают наличие слепого влагалища[58] или недостаточную маскулинизацию гениталий[3][59][45], частичную или полную регрессию мюллеровых протоков[60], двусторонние недиспластические яички[61], и нарушение сперматогенеза и/или вирилизацию[3][5][9][51], кариотип 46,XY[7] и нормальный или повышенный уровень постпубертатного тестостерона, лютеинизирующего гормона и эстрадиола[7][15]. Андроген-связывающая активность фибробластов кожи гениталий, как правило, снижается[17][62], хотя сообщалось об исключениях[63]. Преобразование тестостерона в дигидротестостерон может быть нарушено[17]. Диагноз подтверждается, если секвенирование гена рецептора андрогена обнаруживает мутацию, хотя не у всех людей с нечувствительностью к андрогенам (особенно с частичной нечувствительностью) присутствует мутация гена AR[7][9][26][27].
Каждый из трех типов состояния (полная, частичная и легкая нечувствительность к андрогенам) имеет свой список дифференциальных диагнозов[3]. В зависимости от формы подозреваемого состояния, список может включать[33][32][64][65][66]:
- Хромосомные аберрации:
- Синдром Клайнфелтера (кариотип 47,XXY)
- Синдром Шерешевского — Тёрнера (кариотип 45, ХО)
- Смешанная дисгенезия гонад (кариотип 45, XO / 46, XY)
- Тетрагаметический химеризм (кариотип 46, XX / 46, XY)
- Андрогенная биосинтетическая дисфункция у лиц с кариотипом 46,XY:
- Мутации рецепторов лютеинизирующего гормона (ЛГ)
- Синдром Смита – Лемли – Опица (связанный с умственной отсталостью)
- Липоидная врождённая гиперплазия надпочечников
- ВГКН вследствие недостаточности 3-бета-гидроксистероиддегидрогеназы
- ВГКН вследствие недостаточности 17-альфа-гидроксилазы
- 17,20 lyase deficiency
- Дефицит 17β-гидроксистероиддегидрогеназы III
- Дефицит 5-альфа-редуктазы
- Избыток андрогена у 46, XX человек:
- ВГКН вследствие недостаточности 21-гидроксилазы
- ВГКН вследствие недостаточности 3-бета-гидроксистероиддегидрогеназы
- Дефицит цитохрома P450 оксидоредуктазы
- ВГКН вследствие недостаточности 11-бета-гидроксилазы
- Дефицит ароматазы
- Мутации глюкокортикоидных рецепторов
- Материнская вирилизирующая опухоль (например, лютеома)
- Повышенное воздействие андрогенов в утробе матери, не указано иное (например, андрогенные препараты)
- Связанные с развитием
- Синдром Майера — Рокитанского — Кустера — Хаузера (кариотип 46,ХХ)
- Синдром Свайера (кариотип 46,ХY)
- XX дисгенезия гонад (46, XX кариотип)
- Гипоплазия клеток Лейдига
- Анорхизм
- Овотестикулярное НФП
- НФП яичка
- Тератогенные причины (например, эстрогены, антиэстрогены)
- Другое:
- Синдром Фрейзера (связанный с прогрессирующей гломерулопатией)
- Синдром Дениса-Драш (связанный с нефропатией и опухолью Вильмса)
- Синдром WAGR (связан с опухолью Вильмса и аниридиями)
- Синдром Мак-Кьюсика-Кауфмана (связанный с постаксиальной полидактилией)
- Синдром Робинова (связанный с карликовостью)
- Синдром Аарскога – Скотта (связанный с аномалиями лица)
- Hand-foot-genital syndrome (связан с пороками развития конечностей)
- Синдром подколенного птеригиума (связан с обширными перепонками за коленями)
- Синдром Каллмана (часто связанный с аносмией)
- Гипоспадия, не указанная иным образом
- Крипторхизм не указано иное
- Атрезия влагалища, не указанная иным образом
Эпидемиология
[править | править код]Оценки встречаемости нечувствительности к андрогенам основаны на относительно небольших выборках, поэтому неточны[3]. По оценкам, полная нечувствительность к андрогенам случается с вероятностью 1 на 20 400 родившихся людей с кариотипом 46,XY[67]. Общенациональный опрос в Нидерландах, основанный на пациентах с генетическим подтверждением диагноза, показывает, что минимальная частота полной нечувствительности составляет один на 99 000[68]. Встречаемость частичной нечувствительности к андрогенам оценивается как 1 из 130 000[69]. Из-за своего тонкого проявления легкая нечувствительность к андрогенам обычно не исследуется, за исключением случаев бесплодия у мужчин[45], поэтому его истинная распространенность неизвестна[7].
История
[править | править код]Ранее для обозначения нарушения использовался термин синдром тестикулярной феминизации (англ. testicular feminisation syndrom), который отражает исторически ошибочное понимание причины заболевания. В 1953 году американский гинеколог Джон Моррис дал первое полное описание синдрома на основе 82 случаев, собранных из медицинской литературы, в том числе двух своих пациентов[3][17]. Термин testicular feminisation syndrom был выбран для того, чтоб отразить представление Морриса о том, что яички у пациентов производят гормон, обладающий феминизирующим воздействием на организм. В настоящее время причину заболевания связывают с бездействием андрогенов и последующим превращением тестостерона в эстроген[3]. За несколько лет до Морриса Лоусон Уилкинс на собственных экспериментах показал, что невосприимчивость клеток-мишеней к андрогенным гормонам была причиной «мужского псевдогермафродитизма»[57][70]. Опыты Уилкинса наглядно продемонстрировали отсутствие терапевтического эффекта, когда женщин с генотипом 46XY лечили андрогенами. Понимание причины заболевания повлекло постепенный переход в номенклатуре от термина «testicular feminisation syndrom» к «androgen resistance»[71].
Хронология основных вех
[править | править код]- 1950: Лоусон Уилкинс[англ.] прописывает метилтестостерон пациентке с кариотипом 46,XY, у которой нет признаков вирилизации. Его эксперимент — первая задокументированная попытка лечения нечувствительности к андрогенам[57][72].
- 1970: Мэри Ф. Лайон и Сьюзен Хоукс сообщили, что ген на Х-хромосоме вызывал полную нечувствительность к андрогенам у мышей[73][74].
- 1981: Барбара Мигеон с коллегами сузили локус гена рецептора андрогена у человека (или фактора, контролирующего ген рецептора андрогена) где-то между Xq11 и Xq13[75][76].
- 1988: Ген рецептора андрогенов у человека впервые клонируется и частично анализируется[77][78]. Терри Браун с коллегами сообщили о первых найденных мутациях, доказано вызывающих нечувствительность к андрогенам[7][76].
- 1989: Терри Браун с коллегами сообщили о нахождении точного локуса гена AR (Xq11-Xq12)[16]; Деннис Любан с коллегами опубликовал его экзон-интрон границы[79].
- 1994: Создана база данных мутаций генов рецепторов андрогенов, для ведения полного списка мутаций, опубликованных в медицинских журналах и материалах конференций[80].
Ранняя терминология
[править | править код]Первые описания эффектов нечувствительности к андрогенам появились в медицинской литературе как отдельные случаи или как часть всестороннего описания физических свойств интерсексов. В 1839 году шотландский акушер сэр Джеймс Янг Симпсон опубликовал одно такое описание[81] в исчерпывающем исследовании интерсекс-состояний[82]. Система таксономии Симпсона, однако, была далеко не первой; таксономии или описания для классификации интерсекс-вариаций были разработаны итальянским врачом и физиком Фортуне Аффайтати в 1549 году[83][84], французским хирургом Амбруазом Паре в 1573 году[82][85], французским врачом и пионером сексологии Николя Венетт в 1687 году (под псевдоним Vénitien Salocini)[86][87], и французским зоологом Исидор Жоффруа Сен-Илер в 1832 году[88]. Все пять этих авторов использовали разговорный термин «гермафродит» в качестве основы своих таксономий, хотя сам Симпсон поставил под сомнение правильность этого слова в своей публикации[81]. Использование слова «гермафродит» в медицинской литературе сохранилось до наших дней[89][90], хотя его обоснованность все еще остается под вопросом. Недавно была предложена альтернативная система номенклатуры[91], но предмет того, какое именно слово или слова следует использовать вместо него, все еще вызывает много споров[65][92][93][94][95].
Псевдогермафродитизм
[править | править код]Термин «псевдогермафродитизм» до недавнего времени[91] использовался в медицинской литературе для описания состояния индивидуума, у которого гонады и кариотип не совпадают с внешними гениталиями. Например, лица с кариотипом 46.XY имеют женский фенотип, и вместе с тем яички вместо яичников. Группа, включающая всех людей с полной нечувствительностью к андрогенам, а также ряд лиц с частичной нечувствительностью к андрогенам классифицируются как имеющие мужской «псевдогермафродитизм», в то время как люди у которых есть яичник и яичко (или, по крайней мере, один яичник) классифицируются как имеющие «истинный гермафродитизм»[90][91]. Использование этого слова в медицинской литературе предшествует открытию хромосомы, поэтому при его использовании не учитывается кариотип при определении пола индивидуума. Предыдущие определения «псевдогермафродитизма» основывались на предполагаемых несоответствиях между внутренними и внешними органами; «истинный» пол индивида определялся внутренними органами, а внешние органы определяли «воспринимаемый» пол индивида[81][88].
Немецко-швейцарский патолог Эдвин Клебс иногда упоминается за использование слова «псевдогермафродитизм» в его таксономии интерсекс-состояний в 1876 году[96], хотя это слово явно не является его изобретением, как иногда сообщается; История слова «псевдогермафродит» и соответствующее желание отделить «истинных» гермафродитов от «ложных» или «псевдо» гермафродитов датируются как минимум 1709 годом, когда голландский анатом Фредерик Рюйш использовал его в описание субъекта с яичками и преимущественно женским фенотипом[97]. «Псевдогермафродит» также появился в Acta Eruditorum позже в том же году, в обзоре работы Рюйша[98]. Также некоторые данные указывают на то, что слово уже использовалось медицинским сообществом Германии и Франции задолго до того, как Клебс использовал его; Немецкий физиолог Йоханнес Петер Мюллер приравнивал «псевдогермафродитизм» к подклассу гермафродитизма из таксономии Сен-Илера в публикации от 1834 года[99], а к 1840-м годам «псевдогермафродитизм» появлялся в нескольких французских и немецких публикациях, включая словари[14][100][101][102].
Тестикулярная феминизация
[править | править код]В 1953 году американский гинеколог Джон Моррис дал первое полное описание того, что он назвал «тестикулярной феминизацией», основываясь на 82 случаях, собранных из медицинской литературы, в том числе двух его собственных пациентов[3][17][103]. Термин «тестикулярная феминизация» был придуман, чтобы отразить наблюдение Морриса о том, что яички у этих пациентов продуцируют гормон, который оказывает феминизирующее действие на организм, явление, которое, как теперь понимают, связано с бездействием андрогенов и последующей ароматизацией тестостерона в эстрогены[3]. За несколько лет до того, как Моррис опубликовал свою знаменательную статью, Лоусон Уилкинс в ходе эксперимента показал, что невосприимчивость клетки-мишени к действию андрогенных гормонов является причиной "мужского псевдогермафродитизма"[57][70]. Работа Уилкинса, которая ясно продемонстрировала отсутствие терапевтического эффекта, когда женщины с кариотипом 46.XY получали андрогены, вызвала постепенный сдвиг в номенклатуре от термина «тестикулярная феминизация» к термину «резистентность к андрогенам»[71].
Другие названия
[править | править код]Отдельное название было дано многим различным проявлениям нечувствительности к андрогенам, например, синдром Рейфенштейна (1947)[104], синдром Голдберга-Максвелла (1948)[105], синдром Морриса (1953)[103], синдром Гилберта-Дрейфуса (1957)[106], синдром Луба (1959)[107], «неполная тестикулярная феминизация» (1963)[108], синдром Розуотера (1965)[109], и синдром Аймана (1979)[110]. Поскольку не было понятно, что все эти различные проявления были вызваны одним и тем же набором мутаций в гене рецептора андрогена, каждому новому сочетанию симптомов было присвоено уникальное имя, что привело к сложному разделению на, казалось бы, не сопоставимые состояний[57][111].
За последние 60 лет, поскольку сообщения о поразительно различных фенотипах, как сообщалось, имели место даже среди членов одной семьи, и поскольку был достигнут устойчивый прогресс в понимании основного молекулярного патогенеза нечувствительности к андрогенам, было обнаружено, что эти состояния являются различными фенотипическими выражениями. одного и того же, вызванного молекулярными дефектами в гене рецептора андрогена[3][14][57][111].
В настоящее время нечувствительность к андрогенам является общепринятым названием для состояний, возникающих в результате невосприимчивости клеток-мишеней к действию андрогенных гормонов. Полная нечувствительность к андрогенам включает в себя фенотипы, ранее описанные как «тестикулярная феминизация», «синдром Морриса» и «синдром Голдберга-Максвелла»[3][112]; Частичная нечувствительность к андрогенам включает в себя «синдром Рейфенштейна», «синдром Гилберта-Дрейфуса, «синдром Луба», «неполную тестикулярную феминизацию» и «синдром Розуотера»[111][113][114]. Легкая нечувствительность к андрогенам включает «синдром Аймана»[115].
Более вирилизированные фенотипы нечувствительности к андрогенам иногда описывались как «синдром недовиризованного мужчины», «синдром бесплодного мужчины» и т.д. До того, как появились данные о том, что эти состояния были вызваны мутациями в гене AR[38], эти диагнозы были использованы для описания различных легких дефектов вирилизации; в результате фенотипы некоторых мужчин, которым был поставлен диагноз, лучше описываются частичной нечувствительностью (например, микропенис, гипоспадия и неопущенные яички), в то время как другие лучше описываются легкой нечувствительностью (например, изолированное мужское бесплодие или гинекомастия)[3][38][39][114][116][117].
В культуре
[править | править код]- В документальном фильме «Орхидеи: Мои интерсексуальные приключения» обе героини, Фиби Харт и Бонни Харт имеют данный синдром[118].
- В 13-й серии 2-го сезона сериала «Доктор Хаус» «Внешность обманчива» (англ. Skin Deep) главному пациенту серии ставят диагноз полная нечувствительность к андрогенам.
- В книге «None of the Above» у главной героини нечувствительность к андрогенам[119].
- В автобиографической книге «XOXY, A Memoir: Intersex Woman, Mother, Activist» Кимберли Зизельман описывает свой опыт жизни с данным состоянием[120].
Примечания
[править | править код]- ↑ 1 2 Disease Ontology (англ.) — 2016.
- ↑ Эндокринология / Под ред. Н. Лавина. — 2-е изд. Пер. с англ. — М.: Практика, 1999. — С. 48-49. — 1128 с. — 10 000 экз. — ISBN 5-89816-018-3.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Hughes I.A., Deeb A. Androgen resistance (неопр.) // Best Pract. Res. Clin. Endocrinol. Metab.. — 2006. — December (т. 20, № 4). — С. 577—598. — doi:10.1016/j.beem.2006.11.003. — PMID 17161333.
- ↑ Stouffs K., Tournaye H., Liebaers I., Lissens W. Male infertility and the involvement of the X chromosome (англ.) // Hum. Reprod. Update[англ.] : journal. — 2009. — Vol. 15, no. 6. — P. 623—637. — doi:10.1093/humupd/dmp023. — PMID 19515807.
- ↑ 1 2 Zuccarello D., Ferlin A., Vinanzi C., Prana E., Garolla A., Callewaert L., Claessens F., Brinkmann A.O., Foresta C. Detailed functional studies on androgen receptor mild mutations demonstrate their association with male infertility (англ.) // Clin. Endocrinol. (Oxf) : journal. — 2008. — April (vol. 68, no. 4). — P. 580—588. — doi:10.1111/j.1365-2265.2007.03069.x. — PMID 17970778.
- ↑ Ieuan A. Hughes, Asma Deeb. Androgen resistance // Best Practice & Research Clinical Endocrinology & Metabolism. — 2006-12. — Т. 20, вып. 4. — С. 577—598. — ISSN 1521-690X. — doi:10.1016/j.beem.2006.11.003.
- ↑ 1 2 3 4 5 6 7 8 9 Angeliki Galani, Sophia Kitsiou-Tzeli, Christalena Sofokleous, Emmanuel Kanavakis, Ariadni Kalpini-Mavrou. Androgen insensitivity syndrome: clinical features and molecular defects // HORMONES. — 2008-07-15. — Т. 7, вып. 3. — С. 217—229. — ISSN 1109-3099. — doi:10.14310/horm.2002.1201.
- ↑ D. Zuccarello, A. Ferlin, C. Vinanzi, E. Prana, A. Garolla. Detailed functional studies on androgen receptor mild mutations demonstrate their association with male infertility // Clinical Endocrinology. — 2008-04. — Т. 68, вып. 4. — С. 580—588. — ISSN 1365-2265 0300-0664, 1365-2265. — doi:10.1111/j.1365-2265.2007.03069.x.
- ↑ 1 2 3 4 Alberto Ferlin, Cinzia Vinanzi, Andrea Garolla, Riccardo Selice, Daniela Zuccarello. Male infertility and androgen receptor gene mutations: clinical features and identification of seven novel mutations // Clinical Endocrinology. — 2006-11. — Т. 65, вып. 5. — С. 606—610. — ISSN 1365-2265 0300-0664, 1365-2265. — doi:10.1111/j.1365-2265.2006.02635.x.
- ↑ K. Stouffs, H. Tournaye, I. Liebaers, W. Lissens. Male infertility and the involvement of the X chromosome // Human Reproduction Update. — 2009-06-10. — Т. 15, вып. 6. — С. 623—637. — ISSN 1460-2369 1355-4786, 1460-2369. — doi:10.1093/humupd/dmp023.
- ↑ 1 2 Tamer Özülker, Tevfik Özpaçacı, Filiz Özülker, Ümit Özekici, Remziye Bilgiç. Incidental detection of Sertoli–Leydig cell tumor by FDG PET/CT imaging in a patient with androgen insensitivity syndrome // Annals of Nuclear Medicine. — 2009-12-04. — Т. 24, вып. 1. — С. 35—39. — ISSN 1864-6433 0914-7187, 1864-6433. — doi:10.1007/s12149-009-0321-x.
- ↑ Carol A. Davis-Dao, Ellenie D. Tuazon, Rebecca Z. Sokol, Victoria K. Cortessis. Male Infertility and Variation in CAG Repeat Length in the Androgen Receptor Gene: A Meta-analysis // The Journal of Clinical Endocrinology & Metabolism. — 2007-11-01. — Т. 92, вып. 11. — С. 4319—4326. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2007-1110.
- ↑ Hisaya Kawate, Yin Wu, Keizo Ohnaka, Rong-Hua Tao, Kei-ichiro Nakamura. Impaired Nuclear Translocation, Nuclear Matrix Targeting, and Intranuclear Mobility of Mutant Androgen Receptors Carrying Amino Acid Substitutions in the Deoxyribonucleic Acid-Binding Domain Derived from Androgen Insensitivity Syndrome Patients // The Journal of Clinical Endocrinology & Metabolism. — 2005-11. — Т. 90, вып. 11. — С. 6162—6169. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2005-0179.
- ↑ 1 2 3 4 5 Bruce Gottlieb, Rose Lombroso, Lenore K Beitel, Mark A Trifiro. Molecular pathology of the androgen receptor in male (in)fertility // Reproductive BioMedicine Online. — 2005-01. — Т. 10, вып. 1. — С. 42—48. — ISSN 1472-6483. — doi:10.1016/s1472-6483(10)60802-4.
- ↑ 1 2 3 S Ahmed, A Cheng, I Hughes. [https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1717906/ Assessment of the gonadotrophin-gonadal axis in androgen insensitivity syndrome] // Archives of Disease in Childhood. — 1999-4. — Т. 80, вып. 4. — С. 324—329. — ISSN 0003-9888. Архивировано 11 ноября 2020 года.
- ↑ 1 2 C J Brown, S J Goss, D B Lubahn, D R Joseph, E M Wilson. Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism. // American Journal of Human Genetics. — 1989-2. — Т. 44, вып. 2. — С. 264—269. — ISSN 0002-9297. Архивировано 10 марта 2021 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Quigley C.A., De Bellis A., Marschke K.B., el-Awady M.K., Wilson E.M., French F.S. Androgen receptor defects: historical, clinical, and molecular perspectives (англ.) // Endocrine Reviews[англ.] : journal. — Endocrine Society[англ.], 1995. — June (vol. 16, no. 3). — P. 271—321. — doi:10.1210/edrv-16-3-271. — PMID 7671849.
- ↑ Bruce Gottlieb, Lenore K. Beitel, Mark A. Trifiro. Variable expressivity and mutation databases: The androgen receptor gene mutations database // Human Mutation. — 2001. — Т. 17, вып. 5. — С. 382—388. — ISSN 1098-1004 1059-7794, 1098-1004. — doi:10.1002/humu.1113.
- ↑ Birgit Köhler, Serge Lumbroso, Juliane Leger, Francoise Audran, Enric Sarret Grau. Androgen Insensitivity Syndrome: Somatic Mosaicism of the Androgen Receptor in Seven Families and Consequences for Sex Assignment and Genetic Counseling // The Journal of Clinical Endocrinology & Metabolism. — 2005-01. — Т. 90, вып. 1. — С. 106—111. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2004-0462.
- ↑ Olaf Hiort, Gernot H.G. Sinnecker, Paul-Martin Holterhus, Esther Maria Nitsche, Klaus Kruse. Inherited and de novo androgen receptor gene mutations: Investigation of single-case families // The Journal of Pediatrics. — 1998-06. — Т. 132, вып. 6. — С. 939—943. — ISSN 0022-3476. — doi:10.1016/s0022-3476(98)70387-7.
- ↑ J. A. Batch, D. M. Williams, H. R. Davies, B. D. Brown, B. A. J. Evans. Androgen receptor gene mutations identified by SSCP in fourteen subjects with androgen insensitivity syndrome // Human Molecular Genetics[англ.]. — Oxford University Press, 1992. — Т. 1, вып. 7. — С. 497—503. — ISSN 1460-2083 0964-6906, 1460-2083. — doi:10.1093/hmg/1.7.497.
- ↑ Olaf Hiort, George Klauber, Mare Cendron, Gernot H. G. Sinnecker, Lutz Keim. Molecular characterization of the androgen receptor gene in boys with hypospadias // European Journal of Pediatrics. — 1994-05. — Т. 153, вып. 5. — С. 317—321. — ISSN 1432-1076 0340-6199, 1432-1076. — doi:10.1007/bf01956409.
- ↑ Jianming Lu, Mark Danielsen. A Stu I polymorphism in the human androgen receptor gene (AR) // Clinical Genetics. — 2008-06-28. — Т. 49, вып. 6. — С. 323—324. — ISSN 1399-0004 0009-9163, 1399-0004. — doi:10.1111/j.1399-0004.1996.tb03800.x.
- ↑ D. Hamer, S Hu, V. Magnuson, N Hu, A. Pattatucci. A linkage between DNA markers on the X chromosome and male sexual orientation (англ.) // Science. — 1993-07-16. — Vol. 261, iss. 5119. — P. 321—327. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.8332896.
- ↑ Bruce Gottlieb, Denise M. Vasiliou, Rose Lumbroso, Lenore K. Beitel, Leonard Pinsky. <527::aid-humu12>3.0.co;2-x Analysis of exon 1 mutations in the androgen receptor gene // Human Mutation. — 1999-12. — Т. 14, вып. 6. — С. 527—539. — ISSN 1098-1004 1059-7794, 1098-1004. — doi:10.1002/(sici)1098-1004(199912)14:6<527::aid-humu12>3.0.co;2-x.
- ↑ 1 2 Karla F. S. Melo, Berenice B. Mendonca, Ana Elisa C. Billerbeck, Elaine M. F. Costa, Marlene Inácio. Clinical, Hormonal, Behavioral, and Genetic Characteristics of Androgen Insensitivity Syndrome in a Brazilian Cohort: Five Novel Mutations in the Androgen Receptor Gene // The Journal of Clinical Endocrinology & Metabolism. — 2003-07. — Т. 88, вып. 7. — С. 3241—3250. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2002-021658.
- ↑ 1 2 S. F. Ahmed, A. Cheng, L. Dovey, J. R. Hawkins, H. Martin. Phenotypic Features, Androgen Receptor Binding, and Mutational Analysis in 278 Clinical Cases Reported as Androgen Insensitivity Syndrome1 // The Journal of Clinical Endocrinology & Metabolism. — 2000-02. — Т. 85, вып. 2. — С. 658—665. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.85.2.6337.
- ↑ Régis Coutant, Delphine Mallet, Najiba Lahlou, Natacha Bouhours-Nouet, Agnès Guichet. Heterozygous Mutation of Steroidogenic Factor-1 in 46,XY Subjects May Mimic Partial Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism. — 2007-08. — Т. 92, вып. 8. — С. 2868—2873. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2007-0024.
- ↑ Masahiro Adachi, Ryoichi Takayanagi, Arihiro Tomura, Kyosuke Imasaki, Shigeaki Kato. Androgen-Insensitivity Syndrome as a Possible Coactivator Disease // New England Journal of Medicine. — 2000-09-21. — Т. 343, вып. 12. — С. 856—862. — ISSN 1533-4406 0028-4793, 1533-4406. — doi:10.1056/nejm200009213431205.
- ↑ Farid J. Ghadessy, Joyce Lim, Abdullah A.R. Abdullah, Valerie Panet-Raymond, Chee Keong Choo. Oligospermic infertility associated with an androgen receptor mutation that disrupts interdomain and coactivator (TIF2) interactions // Journal of Clinical Investigation. — 1999-06-01. — Т. 103, вып. 11. — С. 1517—1525. — ISSN 0021-9738. — doi:10.1172/jci4289.
- ↑ Yvonne L. Giwercman, Sten A. Ivarsson, Jonas Richthoff, Kristina B. Lundin, Aleksander Giwercman. A Novel Mutation in the D-Box of the Androgen Receptor Gene (S597R) in Two Unrelated Individuals Is Associated with both Normal Phenotype and Severe PAIS // Hormone Research in Paediatrics. — 2004. — Т. 61, вып. 2. — С. 58—62. — ISSN 1663-2826 1663-2818, 1663-2826. — doi:10.1159/000075240.
- ↑ 1 2 3 4 Simpson JL, Rebar RW (2002). Hung, Wellington, Becker, Kenneth L., Bilezikian, John P., William J Bremner (eds.). Principles and Practice of Endocrinology and Metabolism. Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 852–885. ISBN 978-0-7817-4245-0.
- ↑ 1 2 3 4 Achermann JC, Jameson JL (2006). "Disorders of sexual differentiation". In Hauser SL, Kasper DL, Fauci AS, Braunwald E, Longo DL (eds.). Harrison's endocrinology. New York: McGraw-Hill Medical Pub. Division. pp. 161–172. ISBN 978-0-07-145744-6.
- ↑ Brinkmann A, Jenster G, Ris-Stalpers C, van der Korput H, Brüggenwirth H, Boehmer A, Trapman J (April 1996). "Molecular basis of androgen insensitivity". Steroids. 61 (4): 172–5. doi:10.1016/0039-128X(96)00008-6. PMID 8732995.
- ↑ 1 2 Yvonne Lundberg Giwercman, Agneta Nordenskjöld, E. Martin Ritzén, Karl Olof Nilsson, Sten-A. Ivarsson. An Androgen Receptor Gene Mutation (E653K) in a Family with Congenital Adrenal Hyperplasia due to Steroid 21-Hydroxylase Deficiency as well as in Partial Androgen Insensitivity // The Journal of Clinical Endocrinology & Metabolism. — 2002-06. — Т. 87, вып. 6. — С. 2623—2628. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.87.6.8518.
- ↑ Leonard Pinsky, Morris Kaufman, Donald W. Killinger, John M. Opitz, James F. Reynolds. Impaired spermatogenesis is not an obligate expression of receptor-defective androgen resistance // American Journal of Medical Genetics. — 1989-01. — Т. 32, вып. 1. — С. 100—104. — ISSN 1096-8628 0148-7299, 1096-8628. — doi:10.1002/ajmg.1320320121.
- ↑ PLACIDO B. GRINO, JAMES E. GRIFFIN, WILLIAM G. CUSHARD, JEAN D. WILSON. A Mutation of the Androgen Receptor Associated with Partial Androgen Resistance, Familial Gynecomastia, and Fertility* // The Journal of Clinical Endocrinology & Metabolism. — 1988-04. — Т. 66, вып. 4. — С. 754—761. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem-66-4-754.
- ↑ 1 2 3 T Tsukada, M Inoue, S Tachibana, Y Nakai, H Takebe. An androgen receptor mutation causing androgen resistance in undervirilized male syndrome. // The Journal of Clinical Endocrinology & Metabolism. — 1994-10. — Т. 79, вып. 4. — С. 1202—1207. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.79.4.7962294.
- ↑ 1 2 Aleksander Giwercman, Thomas Kledal, Marianne Schwartz, Yvonne Lundberg Giwercman, Henrik Leffers. Preserved Male Fertility Despite Decreased Androgen Sensitivity Caused by a Mutation in the Ligand-Binding Domain of the Androgen Receptor Gene1 // The Journal of Clinical Endocrinology & Metabolism. — 2000-06. — Т. 85, вып. 6. — С. 2253—2259. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.85.6.6626.
- ↑ E.L. Yong, S.C. Ng, A.C. Roy, G. Yun, S.S. Ratnam. Pregnancy after hormonal correction of severe spermatogenic defect due to mutation in androgen receptor gene (англ.) // The Lancet. — Elsevier, 1994-09. — Vol. 344, iss. 8925. — P. 826—827. — ISSN 0140-6736. — doi:10.1016/s0140-6736(94)92385-x.
- ↑ 1 2 3 L. V. Belousov. Scott F. Gilbert—Developmental Biology, 2010, Sinauer Associates, Inc., Sunderland, MA Ninth Edition // Russian Journal of Developmental Biology. — 2011-09. — Т. 42, вып. 5. — С. 349—349. — ISSN 1608-3326 1062-3604, 1608-3326. — doi:10.1134/s1062360411050043. Архивировано 2 июня 2018 года.
- ↑ 1 2 3 4 5 6 Richard E. Jones, Kristin H. Lopez. Sexual Differentiation // Human Reproductive Biology. — Elsevier, 2006. — С. 127—148. — ISBN 9780120884650.
- ↑ 1 2 3 E.L. Yong. Androgen receptor gene and male infertility // Human Reproduction Update. — 2003-01-01. — Т. 9, вып. 1. — С. 1—7. — ISSN 1460-2369 1355-4786, 1460-2369. — doi:10.1093/humupd/dmg003.
- ↑ Sabine E. Hannema, Ian S. Scott, John Hodapp, Howard Martin, Nick Coleman. Residual Activity of Mutant Androgen Receptors Explains Wolffian Duct Development in the Complete Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism. — 2004-11. — Т. 89, вып. 11. — С. 5815—5822. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2004-0709.
- ↑ 1 2 3 4 Meghan B. Oakes, Aimee D. Eyvazzadeh, Elisabeth Quint, Yolanda R. Smith. Complete Androgen Insensitivity Syndrome—A Review // Journal of Pediatric and Adolescent Gynecology. — 2008-12. — Т. 21, вып. 6. — С. 305—310. — ISSN 1083-3188. — doi:10.1016/j.jpag.2007.09.006.
- ↑ 1 2 A.K. Roy, Y. Lavrovsky, C.S. Song, S. Chen, M.H. Jung. Regulation of Androgen Action // Vitamins & Hormones. — Elsevier, 1998. — С. 309—352. — ISBN 9780127098555.
- ↑ 1 2 John M. Kokontis, Shutsung Liao. Molecular Action of Androgen in the Normal and Neoplastic Prostate // Vitamins & Hormones. — Elsevier, 1998. — С. 219—307. — ISBN 9780127098555.
- ↑ 1 2 Singh Rajender, Nalini J. Gupta, Baidyanath Chakrabarty, Lalji Singh, Kumarasamy Thangaraj. Ala 586 Asp mutation in androgen receptor disrupts transactivation function without affecting androgen binding // Fertility and Sterility. — 2009-03. — Т. 91, вып. 3. — С. 933.e23—933.e28. — ISSN 0015-0282. — doi:10.1016/j.fertnstert.2008.10.041.
- ↑ 1 2 Vivian Sobel, Brian Schwartz, Yuan-Shan Zhu, Juan J. Cordero, Julianne Imperato-McGinley. Bone Mineral Density in the Complete Androgen Insensitivity and 5α-Reductase-2 Deficiency Syndromes // The Journal of Clinical Endocrinology & Metabolism. — 2006-08-01. — Т. 91, вып. 8. — С. 3017—3023. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2005-2809.
- ↑ Qi Wang, Farid J. Ghadessy, Alan Trounson, David de Kretser, Rob McLachlan. Azoospermia Associated with a Mutation in the Ligand-Binding Domain of an Androgen Receptor Displaying Normal Ligand Binding, but DefectiveTrans-Activation1 // The Journal of Clinical Endocrinology & Metabolism. — 1998-12. — Т. 83, вып. 12. — С. 4303—4309. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.83.12.5358.
- ↑ 1 2 Annastiina Lund, Vesa Juvonen, Jaana Lähdetie, Kristiina Aittomäki, Juha S Tapanainen. A novel sequence variation in the transactivation regulating domain of the androgen receptor in two infertile Finnish men // Fertility and Sterility. — 2003-06. — Т. 79. — С. 1647—1648. — ISSN 0015-0282. — doi:10.1016/s0015-0282(03)00256-5.
- ↑ Roberto Casella, Maria Rosa Maduro, Larry I Lipshultz, Dolores J Lamb. Significance of the polyglutamine tract polymorphism in the androgen receptor // Urology. — 2001-11. — Т. 58, вып. 5. — С. 651—656. — ISSN 0090-4295. — doi:10.1016/s0090-4295(01)01401-7.
- ↑ 1 2 Richard Wooster, Jonathan Mangion, Rosalind Eeles, Simon Smith, Mitchell Dowsett. A germline mutation in the androgen receptor gene in two brothers with breast cancer and Reifenstein syndrome // Nature Genetics. — 1992-10. — Т. 2, вып. 2. — С. 132—134. — ISSN 1546-1718 1061-4036, 1546-1718. — doi:10.1038/ng1092-132.
- ↑ B.A.J. Evans, M.E. Harper, C.E. Daniells, C.E. Watts, S. Matenhelia. <162::aid-pros3>3.0.co;2-h Low incidence of androgen receptor gene mutations in human prostatic tumors using single strand conformation polymorphism analysis // The Prostate. — 1996-03. — Т. 28, вып. 3. — С. 162—171. — ISSN 1097-0045 0270-4137, 1097-0045. — doi:10.1002/(sici)1097-0045(199603)28:3<162::aid-pros3>3.0.co;2-h.
- ↑ 1 2 Jean-Marc Lobaccaro, Serge Lumbroso, Charles Belon, Florence Galtier-Dereure, Jacques Bringer. Androgen receptor gene mutation in male breast cancer // Human Molecular Genetics[англ.]. — Oxford University Press, 1993. — Т. 2, вып. 11. — С. 1799—1802. — ISSN 1460-2083 0964-6906, 1460-2083. — doi:10.1093/hmg/2.11.1799.
- ↑ 1 2 3 D. L. Stenoien, C. J. Cummings, H. P. Adams, M. G. Mancini, K. Patel. Polyglutamine-Expanded Androgen Receptors Form Aggregates That Sequester Heat Shock Proteins, Proteasome Components and SRC-1, and Are Suppressed by the HDJ-2 Chaperone // Human Molecular Genetics[англ.]. — Oxford University Press, 1999-05-01. — Т. 8, вып. 5. — С. 731—741. — ISSN 1460-2083 0964-6906, 1460-2083. — doi:10.1093/hmg/8.5.731.
- ↑ 1 2 3 4 5 6 Gregorio Pérez-Palacios, Bertha Chávez, Juan Pablo Méndez, Julianne Imperato McGinley, Alfredo Ulloa-Aguirre. The syndromes of androgen resistance revisited // Journal of Steroid Biochemistry. — 1987-01. — Т. 27, вып. 4—6. — С. 1101—1108. — ISSN 0022-4731. — doi:10.1016/0022-4731(87)90196-8.
- ↑ I. S. Ismail-Pratt, M. Bikoo, L.-M. Liao, G. S. Conway, S. M. Creighton. Normalization of the vagina by dilator treatment alone in Complete Androgen Insensitivity Syndrome and Mayer-Rokitansky-Kuster-Hauser Syndrome // Human Reproduction. — 2007-07-01. — Т. 22, вып. 7. — С. 2020—2024. — ISSN 1460-2350 0268-1161, 1460-2350. — doi:10.1093/humrep/dem074.
- ↑ Evans, B Hughes, I Bevan, C Patterson, M Gregory, J. Phenotypic diversity in siblings with partial androgen insensitivity syndrome. — BMJ Group, 1997-06.
- ↑ Jennifer L. Nichols, Eric J. Bieber, Jennifer S. Gell. Case of sisters with complete androgen insensitivity syndrome and discordant Müllerian remnants // Fertility and Sterility. — 2009-03. — Т. 91, вып. 3. — С. 932.e15—932.e18. — ISSN 0015-0282. — doi:10.1016/j.fertnstert.2008.09.027.
- ↑ SE Hannema, IS Scott, E Rajpert-De Meyts, NE Skakkebæk, N Coleman. Testicular development in the complete androgen insensitivity syndrome // The Journal of Pathology. — 2006. — Т. 208, вып. 4. — С. 518—527. — ISSN 1096-9896 0022-3417, 1096-9896. — doi:10.1002/path.1890.
- ↑ Wolfgang Weidemann, Birgit Linck, Heike Haupt, Birgit Mentrup, Gabriela Romalo. Clinical and biochemical investigations and molecular analysis of subjects with mutations in the androgen receptor gene // Clinical Endocrinology. — 1996-12. — Т. 45, вып. 6. — С. 733—739. — ISSN 1365-2265 0300-0664, 1365-2265. — doi:10.1046/j.1365-2265.1996.8600869.x.
- ↑ A. Deeb, J. Jääskeläinen, M. Dattani, H. C. Whitaker, C. Costigan. A Novel Mutation in the Human Androgen Receptor Suggests a Regulatory Role for the Hinge Region in Amino-Terminal and Carboxy-Terminal Interactions // The Journal of Clinical Endocrinology & Metabolism. — 2008-10. — Т. 93, вып. 10. — С. 3691—3696. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jc.2008-0737.
- ↑ ELISABETH H. QUINT, JENIFER D. McCARTHY, YOLANDA R. SMITH. Vaginal Surgery for Congenital Anomalies // Clinical Obstetrics and Gynecology. — 2010-03. — Т. 53, вып. 1. — С. 115—124. — ISSN 0009-9201. — doi:10.1097/grf.0b013e3181cd4128.
- ↑ 1 2 Ieuan A. Hughes. Disorders of sex development: a new definition and classification // Best Practice & Research Clinical Endocrinology & Metabolism. — 2008-02. — Т. 22, вып. 1. — С. 119—134. — ISSN 1521-690X. — doi:10.1016/j.beem.2007.11.001.
- ↑ Kyu-Rae Kim, Youngmee Kwon, Jae Young Joung, Kun Suk Kim, Alberto G. Ayala. True Hermaphroditism and Mixed Gonadal Dysgenesis in Young Children: A Clinicopathologic Study of 10 Cases // Modern Pathology. — 2002-10. — Т. 15, вып. 10. — С. 1013—1019. — ISSN 1530-0285 0893-3952, 1530-0285. — doi:10.1097/01.mp.0000027623.23885.0d.
- ↑ Susanne Bangsbøll, Ingelise Qvist, Paul Erik Lebech, Marianne Lewinsky. Testicular feminization syndrome and associated gonadal tumors in Denmark // Acta Obstetricia et Gynecologica Scandinavica. — 1992-01. — Т. 71, вып. 1. — С. 63—66. — ISSN 1600-0412 0001-6349, 1600-0412. — doi:10.3109/00016349209007950.
- ↑ Annemie L. M. Boehmer, Hennie Brüggenwirth, Cissy van Assendelft, Barto J. Otten, Marja C. T. Verleun-Mooijman. GenotypeVersusPhenotype in Families with Androgen Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism. — 2001-09. — Т. 86, вып. 9. — С. 4151—4160. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.86.9.7825.
- ↑ I. Mazen, M. El-Ruby, R. Kamal, I. El-Nekhely, M. El-Ghandour. Screening of Genital Anomalies in Newborns and Infants in Two Egyptian Governorates // Hormone Research in Paediatrics. — 2010. — Т. 73, вып. 6. — С. 438—442. — ISSN 1663-2818 1663-2826, 1663-2818. — doi:10.1159/000313588.
- ↑ 1 2 Wilkins L. Heterosexual development. In: The diagnosis and treatment of endocrine disorders in childhood and adolescence. Springfield, IL: Charles C Thomas, 1950, pp. 256—279.
- ↑ 1 2 Oakes M.B., Eyvazzadeh A.D., Quint E., Smith Y.R. Complete androgen insensitivity syndrome--a review (англ.) // J Pediatr Adolesc Gynecol[англ.] : journal. — 2008. — December (vol. 21, no. 6). — P. 305—310. — doi:10.1016/j.jpag.2007.09.006. — PMID 19064222.
- ↑ THE DIAGNOSIS AND TREATMENT OF ENDOCRINE DISORDERS IN CHILDHOOD AND ADOLESCENCETHE DIAGNOSIS AND TREATMENT OF ENDOCRINE DISORDERS IN CHILDHOOD AND ADOLESCENCE. By WilkinsLawson, Associate Professor of Pediatrics, The Johns Hopkins University, Baltimore. Charles C Thomas, Publisher, Springfield, Illinois, xx+408 pp., 411 illustrations, 6 in color. $13.00. // Endocrinology. — 1950-11. — Т. 47, вып. 5. — С. 391—391. — ISSN 1945-7170 0013-7227, 1945-7170. — doi:10.1210/endo-47-5-391.
- ↑ MARY F. LYON, SUSAN G. HAWKES. X-linked Gene for Testicular Feminization in the Mouse (англ.) // Nature. — 1970-09. — Vol. 227, iss. 5264. — P. 1217—1219. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/2271217a0.
- ↑ Susumu Ohno, Mary F. Lyon. X-Linked testicular feminization in the mouse as a non-inducible regulatory mutation of the Jacob-Monod type // Clinical Genetics. — 1970-07. — Т. 1, вып. 3—4. — С. 121—127. — ISSN 0009-9163. — doi:10.1111/j.1399-0004.1970.tb01627.x.
- ↑ B. R. Migeon, T. R. Brown, J. Axelman, C. J. Migeon. Studies of the locus for androgen receptor: localization on the human X chromosome and evidence for homology with the Tfm locus in the mouse. (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 1981-10-01. — Vol. 78, iss. 10. — P. 6339—6343. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.78.10.6339.
- ↑ 1 2 T. R. Brown, D. B. Lubahn, E. M. Wilson, D. R. Joseph, F. S. French. Deletion of the steroid-binding domain of the human androgen receptor gene in one family with complete androgen insensitivity syndrome: evidence for further genetic heterogeneity in this syndrome. (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 1988-11-01. — Vol. 85, iss. 21. — P. 8151—8155. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.85.21.8151.
- ↑ D. Lubahn, D. Joseph, P. Sullivan, H. Willard, F. French. Cloning of human androgen receptor complementary DNA and localization to the X chromosome (англ.) // Science. — 1988-04-15. — Vol. 240, iss. 4850. — P. 327—330. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.3353727.
- ↑ C. Chang, J Kokontis, S. Liao. Molecular cloning of human and rat complementary DNA encoding androgen receptors (англ.) // Science. — 1988-04-15. — Vol. 240, iss. 4850. — P. 324—326. — ISSN 1095-9203 0036-8075, 1095-9203. — doi:10.1126/science.3353726.
- ↑ D. B. Lubahn, T. R. Brown, J. A. Simental, H. N. Higgs, C. J. Migeon. Sequence of the intron/exon junctions of the coding region of the human androgen receptor gene and identification of a point mutation in a family with complete androgen insensitivity. (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 1989-12-01. — Vol. 86, iss. 23. — P. 9534—9538. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.86.23.9534.
- ↑ B Gottlieb. The androgen receptor gene mutations database // Nucleic Acids Research. — 1996-01-01. — Т. 24, вып. 1. — С. 151—154. — ISSN 1362-4962. — doi:10.1093/nar/24.1.151.
- ↑ 1 2 3 Robert Bentley Todd. The cyclopædia of anatomy and physiology. Ed. by Robert B. Todd .... — London,: Sherwood, Gilbert, and Piper,, 1836.
- ↑ 1 2 Helen King. Midwifery, Obstetrics and the Rise of Gynaecology. — 2017-03-02. — doi:10.4324/9781315248981.
- ↑ Affaitati F [Affaitat]. De hermaphroditis. Venet. 1549.
- ↑ Panckoucke CLF, ed. Dictionnaire des sciences médicales - biographie médicale, 1st ed. Paris: Panckoucke 1820;1:59.
- ↑ Paré, A. Des monstres et prodiges. Paris: Dupuys 1573.
- ↑ Venette N [Vénitien Salocini]. Tableau de l'amour humain considéré dans l'état du mariage. A Parme: Chez Franc d'Amour 1687.
- ↑ Jacob G. Tractatus de hermaphroditis. London: E. Curll 1718.
- ↑ 1 2 Isidore. Geoffroy Saint Hilaire. Histoire générale et particulière des anomalies de l'organisation chez l'homme et les animaux.. — Paris :: J.B. Baillière,, 1832.
- ↑ Faith Y. Dorsey, Michael H. Hsieh, David R. Roth. 46,XX SRY-Negative True Hermaphrodite Siblings // Urology. — 2009-03. — Т. 73, вып. 3. — С. 529—531. — ISSN 0090-4295. — doi:10.1016/j.urology.2008.09.050.
- ↑ 1 2 G. Verkauskas, F. Jaubert, S. Lortat-Jacob, V. Malan, E. Thibaud. The Long-Term Followup of 33 Cases of True Hermaphroditism: A 40-Year Experience With Conservative Gonadal Surgery // Journal of Urology. — 2007-02. — Т. 177, вып. 2. — С. 726—731. — ISSN 1527-3792 0022-5347, 1527-3792. — doi:10.1016/j.juro.2006.10.003.
- ↑ 1 2 3 I.A. Hughes, C. Houk, S.F. Ahmed, P.A. Lee. Consensus statement on management of intersex disorders // Journal of Pediatric Urology. — 2006-06. — Т. 2, вып. 3. — С. 148—162. — ISSN 1477-5131. — doi:10.1016/j.jpurol.2006.03.004. Архивировано 10 декабря 2019 года.
- ↑ M Simmonds. Was "variations of reproductive development" considered? // Archives of Disease in Childhood. — 2007-01-01. — Т. 92, вып. 1. — С. 89—89. — ISSN 1468-2044 0003-9888, 1468-2044. — doi:10.1136/adc.2006.107797.
- ↑ Gian Franco Zannoni, Valerio Gaetano Vellone, Emanuela Lucci Cordisco, Eugenio Sangiorgi, Maria Eufemia Grimaldi. Morphology and Immunophenotyping of a Monolateral Ovotestis in a 46,XderY/45,X Mosaic Individual With Ambiguous Genitalia // International Journal of Gynecological Pathology. — 2010-01. — Т. 29, вып. 1. — С. 33—38. — ISSN 0277-1691. — doi:10.1097/pgp.0b013e3181b52e75.
- ↑ Ellen K. Feder, Katrina Karkazis. What's in a Name?: The Controversy over "Disorders of Sex Development" // Hastings Center Report. — 2008. — Т. 38, вып. 5. — С. 33—36. — ISSN 1552-146X. — doi:10.1353/hcr.0.0062.
- ↑ Elizabeth. Reis. Divergence or Disorder?: the politics of naming intersex // Perspectives in Biology and Medicine. — 2007. — Т. 50, вып. 4. — С. 535—543. — ISSN 1529-8795. — doi:10.1353/pbm.2007.0054.
- ↑ August Lucae. Handbuch der pathologischen Anatomie von Prof. Dr. E. Klebs. // Archiv für Pathologische Anatomie und Physiologie und für Klinische Medicin. — 1878-02. — Т. 72, вып. 2. — С. 288—288. — ISSN 1432-2307 0945-6317, 1432-2307. — doi:10.1007/bf01878774.
- ↑ Ruysch F. Thesaurus anatomicus octavus. Amsterdam: Joannem Wolters 1709. p. 33, Plate II.
- ↑ Mencke JB, ed. Acta eruditorum anno mdccix. Leipzig: Joh. Grossii Haeredes, Joh. Frid. Gleditsch, & Frid. Groschuf. 1709;28:272-274.
- ↑ Müller JP, ed. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin. Berlin: G. Eichler 1834, p. 171.
- ↑ Ritter von Raiman JN, Edlen von Rosas A, Fischer SC, Wisgrill J, eds. Medicinische Jahrbücher des kaiserlich-königlichen österreichischen Staates (volume 22). Vienna: Carl Gerold 1840;22:380-384.
- ↑ Bertuch FJ, Schütz CG, eds. Allgemeine Literatur-Zeitung Issues 1-97. Leipzig 1815, pp. 257-260.
- ↑ Peschier A, Mozin DJ, eds. Supplément au dictionnaire complet des langues française et allemande de l'abbe Mozin. Paris: Stuttgart et Augsbourg 1859, p. 333.
- ↑ 1 2 John McLean Morris. The syndrome of testicular feminization in male pseudohermaphrodites // American Journal of Obstetrics and Gynecology. — 1953-06. — Т. 65, вып. 6. — С. 1192—1211. — ISSN 0002-9378. — doi:10.1016/0002-9378(53)90359-7.
- ↑ Reifenstein EC Jr. (1947). "Hereditary familial hypogonadism". Proc Am Fed Clin Res. 3: 86.
- ↑ Goldberg MB, Maxwell A (May 1948). "Male pseudohermaphroditism proved by surgical exploration and microscopic examination; a case report with speculations concerning pathogenesis". J. Clin. Endocrinol. Metab. 8 (5): 367–79
- ↑ Gilbert-Dreyfus S, Sabaoun CI, Belausch J (1957). "Etude d'un cas familial d'androgynoidisme avec hypospadias grave, gynecomastie et hyperoestrogenie". Ann. Endocrinol. 18: 93–101.
- ↑ Lubs HA Jr, Vilar O, Bergenstal DM (September 1959). "Familial male pseudohermaphrodism with labial testes and partial feminization: endocrine studies and genetic aspects". J. Clin. Endocrinol. Metab. 19 (9): 1110–20.
- ↑ Morris JM, Mahesh VB (November 1963). "Further observations on the syndrome, "testicular feminization."". Am. J. Obstet. Gynecol. 87: 731–48.
- ↑ Rosewater S, Gwinup G, Hamwi JG (September 1965). "Familial gynecomastia". Annals of Internal Medicine. 63 (3): 377–85.
- ↑ Aiman J, Griffin JE, Gazak JM, Wilson JD, MacDonald PC (February 1979). "Androgen insensitivity as a cause of infertility in otherwise normal men". N. Engl. J. Med. 300 (5): 223–7.
- ↑ 1 2 3 Simpson JL (2008). "Male Pseudohermaphroditism Due to Androgen Insensitivity or 5α-Reductase Deficiency". Glob. Libr. Women's Med. The Global Library of Women's Medicine.
- ↑ Hester JD (2004). "Intersex(e) und alternative Heilungsstrategien - Medizin, soziale Imperative und identitatsstiftende Gegengemeinschaften". Ethik Med. 16: 48–67.
- ↑ Michael J McPhaul. Molecular defects of the androgen receptor // The Journal of Steroid Biochemistry and Molecular Biology. — 1999-04. — Т. 69, вып. 1—6. — С. 315—322. — ISSN 0960-0760. — doi:10.1016/s0960-0760(99)00050-3.
- ↑ 1 2 Hoff TA, Fuqua SA (2000). "Steroid and nuclear receptor polymorphism variants in hormone resistance and hormone independence". In Miller MS, Cronin MT (eds.). Genetic polymorphisms and susceptibility to disease. Washington, DC: Taylor & Francis. p. 111
- ↑ Charles Sultan, Serge Lumbroso, Françoise Paris, Claire Jeandel, B. Terouanne. Disorders of Androgen Action // Seminars in Reproductive Medicine. — 2002. — Т. 20, вып. 3. — С. 217—228. — ISSN 1526-4564 1526-8004, 1526-4564. — doi:10.1055/s-2002-35386.
- ↑ Jianhua Chu, Rongmei Zhang, Zhimin Zhao, Wei Zou, Yefei Han. Male Fertility Is Compatible with an Arg840Cys Substitution in the AR in a Large Chinese Family Affected with Divergent Phenotypes of AR Insensitivity Syndrome // The Journal of Clinical Endocrinology & Metabolism. — 2002-01. — Т. 87, вып. 1. — С. 347—351. — ISSN 1945-7197 0021-972X, 1945-7197. — doi:10.1210/jcem.87.1.8167.
- ↑ D Meschede. The molecular genetics of male infertility // Molecular Human Reproduction. — 1997-05-01. — Т. 3, вып. 5. — С. 419—430. — ISSN 1460-2407. — doi:10.1093/molehr/3.5.419.
- ↑ Hart, Phoebe, producer, director, cinematographer. Hart, Bonnie, cinematographer. Milton, Vanessa, editor. Rippingale, Simon, animator. Connor, Biddy, composer. Patterson, David, composer. Orchids : my intersex adventure. Дата обращения: 3 мая 2019.
- ↑ Gregorio, I. W., 1976-. None of the above. — First edition. — New York, NY. — 328 pages с. — ISBN 0-06-233531-6, 978-0-06-233531-9, 978-0-06-233532-6, 0-06-233532-4.
- ↑ Zieselman, Kimberly M.,. XOXY : a memoir (intersex woman, mother, activist). — Philadelphia, PA. — 1 online resource с. — ISBN 978-1-78450-990-3, 1-78450-990-6.
Ссылки
[править | править код]- www.indiana.edu — англоязычный сайт, посвящённый СНкА и схожим нарушениям
- http://www.medterms.com/script/main/art.asp?articlekey=14430
- http://www.hawaii.edu/PCSS/biblio/articles/2000to2004/2004-ais-and-klinefelters.html