Тримеризация

(CH3)2—C—O—O—
Тримеризация (от tri-, «три» и -mer, др.-греч. μέρος «часть») — образование олигомера из трёх молекул. Зачастую тримеризация является промежуточной стадией полимеризации: например, диметилсиландиол полимеризуется в полидиметилсилоксан, при этом на одной из стадий образуется тример:
- Me2Si(OH)2 + (HO)2SiMe2 → Me2(OH)Si-O-Si(OH)Me2 — димер
- Me2(OH)Si-O-Si(OH)Me2 + (HO)2SiMe2 → Me2(OH)Si-O-SiMe2-O-Si(OH)Me2 — тример
- Me2(OH)Si-O-SiMe2-O-Si(OH)Me2 + (HO)2SiMe2 → Me2(OH)Si-O-SiMe2-O-SiMe2-O-Si(OH)Me2 — тетрамер
- и так далее до Me2(OH)Si-O-[SiMe2-O-]nSi(OH)Me2 (n>100) — полимер
История
[править | править код]
Реакции тримеризации были известны еще в XIX веке, например получение бензола из ацетилена связывают с именем Марселена Бертло[1], работы которого были начаты в 1851 году. Однако, продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор - никель - для снижения температуры реакции.[2] В настоящее время такие и подобные реакции классифицирутся как тримеризация через разрыв тройной связи. Сюда входит, например, указанная выше реакция тримеризация алкинов (получение бензола) или первая описанная 1866 году Марселеном Бертло реакция об опыте цикломеризации с получением ароматических соединений, циклизации ацетилена в бензол[3]. В реакции Реппе при тримеризации ацетилена получают бензол:
Другие реакции с разрывом тройной связи
[править | править код]Список примеров в этой статье не основывается на авторитетных источниках, посвящённых непосредственно предмету статьи. |
Разрыв углеродных гетеро-связей с образованием симметричных ненасыщенных 1,3,5-гетероциклов
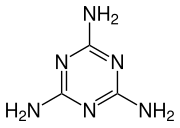
[править | править код]Симметричные 1,3,5-триазины получают путём тримеризации определенных нитрилов, таких как хлорциан или цианамид.
Цианурхлорид получают в две стадии из цианистого водорода через хлорциан, который тримеризируют при повышенных температурах в присутствии углеродного катализатора:
В 2005 году было произведено около 200 000 тонн соединения.[4]
Цианурбромид получают аналогично путём циклотримеризации бромциана:
- 3 BrCN → (BrCN)3
Получение циануровой кислоты промышленным способом влечёт за собой термическое разложение мочевины с выделением аммиака. Преобразование начинаеися примерно при 175°C[4]:
- 3 H2N-CO-NH2 → [C(O)NH]3 + 3 NH3
Синтез меламина
[править | править код]Эндотермические синтез меламина может быть разложен на два этапа. Сначала мочевина разлагается на изоциановую кислоту и аммиак в ходе эндотермической реакции:
- (NH2)2CO → HOCN + NH3
Затем циановая кислота полимеризируется с образованием циануровой кислоты, которая конденсируется с освобождением аммиака на первой стадии, чтобы высвободить меламин и воду.
- 3 HOCN → [C(O)NH]3
- [C(O)NH]3 + 3 NH3 → C3H6N6 + 3 H2O
Затем эта вода реагирует с синильной кислотой на текущей стадии, что помогает довести реакцию тримеризации, образуя диоксид углерода и аммиак.
- 3 HOCN + 3 H2O → 3 CO2 + 3NH3
В общей сложности, второй этап является экзотермической реакцией:
- 6 HCNO + 3 NH3 → C3H6N6 + 3 CO2 + 3NH3
но весь процесс является эндотермическим.
Тримеризация с двойной связью
[править | править код]Помимо реакций с разрывом тройной связи (первые описанные в научной литературе реакции тримеризации), можно аналогично выделить реакции с разрывом двойной связи.
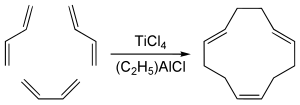
Тримеризация диенов
[править | править код]1,5,9-цис-транс-транс-Циклододекатриен C12H18 имеет некоторое промышленное значение[5] и получается путём циклотримеризации бутадиена с тетрахлоридом титана и алюминийорганического соединения для дополнительного катализа:[6]
Катализируемая серной кислотой тримеризация ацетона путём альдольной конденсации даёт в результате мезитилен.
Разрыв углеродных двойных гетеро-связей с образованием симметричных насыщенных 1,3,5-гетероциклов
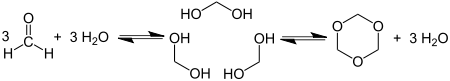
[править | править код]Циклотримеризация формальдегида даёт 1,3,5-триоксан:
1,3,5-Тритиан является циклическим тримером и одной из нестабильных форм тиоформальдегида. Этот гетероцикл состоит из шестичленного кольца с чередующимися метиленовыми связями и тиоэфирными группами. Его получают путём обработки формальдегида сероводородом.[7]
Три молекулы ацетальдегида конденсируются для образования паральдегида, циклического тримера, имеющего одинарную связь C-O.
Примечания
[править | править код]- ↑ Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes, Издание четвертое, Georg Thieme Verlag, 2014, ISBN 3131799749, 9783131799746
- ↑ Reppe, W.; Schweckendiek, W. Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen (нем.) // Liebigs Ann. Chem.[англ.] : magazin. — 1948. — Bd. 560. — S. 104. — doi:10.1002/jlac.19485600104.
- ↑ M. Berthelot. Schetter, M. C. R. (неопр.) // Hebd. Seances Acad. Sci.. — 1866. — Т. 62. — С. 905.
- ↑ 1 2 Klaus Huthmacher, Dieter Most «Cyanuric Acid and Cyanuric Chloride» Ullmann’s Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a08 191
- ↑ 1995 figures for global annual capacity 8000 ton
- ↑ Industrial Organic Chemistry, Klaus Weissermel, Hans-Jurgen Arpe John Wiley & Sons; 3rd 1997 ISBN 3-527-28838-4
- ↑ Bost, R. W.; Constable, E. W. «sym-Trithiane» Organic Syntheses, Collected Volume 2, p.610 (1943). Архивированная копия. Дата обращения: 5 мая 2014. Архивировано 29 марта 2012 года.