Холин-О-ацетилтрансфераза
| Холин-О-ацетилтрансфераза | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 2.3.1.6 |
| Номер CAS | 9012-78-6 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9012-78-6 |
| Холин-О-ацетилтрансфераза | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CHAT, CHOACTASE, CMS1A, CMS1A2, CMS6, choline O-acetyltransferase | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | OMIM: 118490 MGI: 88392 HomoloGene: 40693 GeneCards: CHAT | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
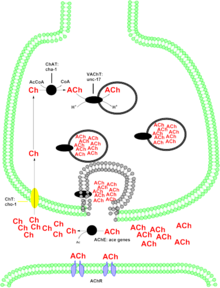
Холин-О-ацетилтрансфераза, также холин-ацетилтрансфераза, холинацетил-СоА-трансфераза (англ. Choline acetyltransferase, сокр. СhAT, ХАТ, но иногда и CAT) — фермент (КФ 2.3.1.6), из семейства ацилтрансфераз (класс трансферазы), катализирующий реакцию переноса ацетильной группы (CH3-CO) от молекулы ацетил-CoA на молекулу субстрата — холина, с образованием ацетилхолина (АЦХ) и кофермента А, по уравнению:
- ацетил-СоА + холин ацетилхолин + CoA-SH.
Фермент катализирует очень важную реакцию, образовавшийся ацетилхолин выполняет роль нейромедиатора. Как и большинство белков нервных окончаний, СhAT синтезируется в теле нейрона (соме) и затем транспортируется в нервные терминали (окончания), где он имеет самую высокую концентрацию. Наличие данного фермента в нервных клетках, классифицирует такую клетку, как "холинергический" нейрон. В организме человека фермент холин-ацетилтрансфераза кодируется геном СHAT, локализованный в 10-й хромосоме[5]. Белок состоит из последовательности 748 аминокислотных остатков и имеет молекулярную массу 82536 Да[6].
Исследования последних двух десятилетий свидетельствуют о существовании одного гена ChAT, в котором закодировано несколько форм и изоформ фермента[7].
Структура[править | править код]
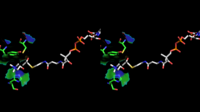
3D структура ChAT была получена с помощью рентгеновской кристаллографии PDB:2FY2. Холин связывается в активном центре фермента нековалетно, между положительно заряженной аминогруппой холина и гидроксильной группой остатка тирозина — Tyr552, помимо этого происходит образование водородных связей между гидроксильной группы холина и остатка гистидина — His324.
Холин как субстрат размещается в кармане внутренней части ChAT, в то время как ацетил-CoA размещён в кармане на поверхности белка. Трёхмерная кристаллическая структура фермента показывает, что ацетильная группа молекулы ацетил-CoA примыкает к холинсвязывающему карману — минимизируя расстояние между ацетильной группой донора и акцептора.
- Структура связывающего участка холин-ацетилтрансферазы
-
Кристаллическая структура иона холина, который связывается в холин-ацетилтрансферазе. Показаны боковые цепи остатков аминокислот His324A и Tyr552A.
-
Стереоскопическое изображение холина и ацетил-CoA в активном центре ChAT.
-
Стереоскопическое изображение связывания молекулы холина и ацетил-CoA в активном центре ChAT — вид с альтернативного угла.
Гомология[править | править код]
ChAT очень консервативна среди генома животных. В частности у млекопитающих имеется очень высокое сходство последовательностей. Человек и кошка, например, имеют 89 % идентичность последовательности ChAT. Идентичность последовательности с дрозофилой составляет около 30 %[8].
Формы фермента[править | править код]
Существуют две формы фермента: растворимая и мембранно-связанная[9]. Растворимая форма составляет 80-90 % от общей активности фермента, в то время как связанная с мембраной форма отвечает за остальные 10-20 % активности[10]. Тем не менее, уже давно существуют дебаты о том, как последняя форма ChAT связана с мембраной[11]. В мембранно-связанной форме ChAT ассоциирован с синаптическими везикулами[12].
Общие и периферические изоформы ChAT[править | править код]
Существуют две изоформы ChAT, обе закодированные в одной и той же последовательности. Общая изоформа ChAT (cChAT) присутствуют как в ЦНС, так и в ПНС. Периферическая изоформа ChAT (pChAT) преимущественно локализуется в ПНС организма человека, и возникает из-за пропуска экзона (экзоны 6-9) гена СHAT во время пост-транскрипционной модификации. Таким образом, аминокислотные последовательности очень похожи, однако, в pChAT отсутствуют части последовательности, присутствующие в cChAT.
Функции[править | править код]
Холинергические системы мозга представляют неизменный интерес нейробиологов в связи с их важной ролью в когнитивных функциях, функциях внимания и моторики. Дисфункция и дегенерация холинергических проекционных нейронов из подкорковых ядер переднего мозга, иннервирующих неокортекс и гиппокамп, лежит в основе патогенеза таких заболеваний, как болезнь Альцгеймера и деменция с тельцами Леви, а также и других нервно-психических заболеваний, течение которых часто осложняется нарушениями в когнитивной сфере, таких как шизофрения, болезнь Паркинсона, сосудистая деменция при хронической ишемии головного мозга [7][14][15][16][17][18][19][20].
Низкая экспрессия ChAT в холинергических нейронах моторных ядер спинного мозга является специфическим ранним признаком амиотрофического бокового склероза, множественные аномалии холинергической функции в моторных ядрах спинного мозга составляют этиологию врождённого миастенического синдрома, дисфункция холинергических интернейронов неостриатума несёт частичную ответственность за непроизвольные движения при болезни Харрингтона[17][21][22].
В нервных окончаниях активность ChAT тесно связана с нейромедиаторной холинергической функцией. Долгое время, на основании кинетических расчётов, ChAT не относили к скорость-лимитирующим ферментам. По своим кинетическим характеристикам ХАТ не насыщается субстратами, холином и ацетил-CoA, в их физиологических концентрациях и поэтому считалось, что скорость синтеза зависела только от колебаний концентраций самих субстратов[23][24]. Однако в последние десятилетия было выявлено множество других внутриклеточных факторов регуляции активности фермента, и эти данные свидетельствовали о важной регулирующей роли ChAT в синтезе ацетилхолина[25][21]. Предполагается, что причиной ряда заболеваний являются спонтанные точечные мутации в молекуле ХАТ или её регуляторных белков, приводящие к дизрегуляции фермента или изменению способности к коммуникации с регуляторными факторами[22][21]. Эти факты побуждают к интенсивному исследованию нейрональных, генетических и постгеномных, регуляторных механизмов метаболизма и секреторной активности ацетилхолина.
ChAT долго была общепризнана только как цитоплазматический, водорастворимый фермент, даже после того, как в 1967 году была обнаружена на синаптических мембранах. Позже было доказано существование ChAT как интегрального структурного белка. Многолетнее изучение in vitro свойств синаптической водорастворимой (с, синаптоплазматической) и мембраносвязанной (м) ChAT в разных функционально-метаболических условиях показало, что связь между активностью ChAT и холинергической секреторной функцией зависит от компартментализации фермента. Исследования такого рода in vivo отсутствуют.
Мутации[править | править код]
Мутанты ChAT были выделены у нескольких видов, включая C. elegans, Drosophila и человека. Большинство нелетальных мутантов, имеющих фенотип не дикого типа, проявляют некоторую активность, но значительно меньшую, чем дикий тип.
У C. elegans несколько мутаций в ChAT были прослежены до гена cha-1. Все мутации приводят к значительному снижению активности ChAT. В некоторых случаях потеря активности может превышать 98 %. Фенотипические эффекты включают замедление роста, уменьшение размеров, некоординированное поведение и отсутствие чувствительности к ингибиторам холинэстеразы[26]. Изолированные чувствительные к температуре мутанты у дрозофилы все были летальными. Перед смертью поражённые мухи демонстрируют изменения в поведении, включая неконтролируемые движения и изменение активности электроретинограммы[27].
Ген человека, отвечающий за кодирование ChAT, называется CHAT. Мутации в CHAT были связаны с врождённым миастеническим синдромом — заболеванием, которое приводит к общему дефициту двигательных функций и слабости. Дополнительные симптомы включают фатальное апноэ. Из десяти выделенных мутантов 1 полностью лишён активности, 8 имеют значительно сниженную активность, и 1 имеет неизвестную функцию[28].
Медицинское значение[править | править код]
Болезнь Альцгеймера[править | править код]
При болезни Альцгеймера (БА) возникают трудности с памятью и познанием (когницией). Концентрация ацетилхолина и ChAT значительно снижена в неокортексе головного мозга и гиппокампе[29]. Хотя потеря нервных клеток и дисфункция холинергических нейронов считается одним из факторов, способствующих развитию болезни Альцгеймера, она обычно не рассматривается как основной фактор в развитии этого заболевания. Предполагается, что агрегация и депонирование белка бета-амилоида нарушает метаболизм нейронов и приводит к дальнейшему повреждению холинергических аксонов в коре и холинергических нейронов в базальных отделах переднего мозга[30].
Боковой амиотрофический склероз[править | править код]
Боковой амиотрофический склероз (БАС) — одно из наиболее распространённых заболеваний двигательных нейронов. При БАС наблюдается значительная потеря иммунореактивности ChAT. Существует гипотеза, что холинергическая функция вовлечена в неконтролируемое повышение концентрации внутриклеточного кальция (Ca2+), причина которого до сих пор остается неясной.
Лекарственные средства[править | править код]
Неостигмин метилсульфат, антихолинэстеразный препарат, был использован для воздействия на ChAT. В частности, было показано, что применение неостигмина метилсульфата оказывает положительное воздействие на врождённый миастенический синдром[31].
Было показано, что воздействие эстрадиола увеличивает ChAT у самок крыс[32].
Примечания[править | править код]
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000070748 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000021919 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Strauss W.L., Kemper R.R., Jayakar P., Kong C.F., Hersh L.B., Hilt D.C., Rabin M. Human choline acetyltransferase gene maps to region 10q11-q22.2 by in situ hybridization (англ.) // Genomics : journal. — 1991. — February (vol. 9, no. 2). — P. 396—398. — doi:10.1016/0888-7543(91)90273-H. — PMID 1840566.
- ↑ UniProt, P28329 (англ.). Дата обращения: 18 марта 2018. Архивировано 18 марта 2018 года.
- ↑ 1 2 Gill S. K., Ishak M., Dobransky T., Haroutunian V., Davis K. L., Rylett R. J. 82-kDa choline acetyltransferase is in nuclei of cholinergic neurons in human CNS and altered in aging and Alzheimer disease. (англ.) // Neurobiology Of Aging. — 2007. — July (vol. 28, no. 7). — P. 1028—1040. — doi:10.1016/j.neurobiolaging.2006.05.011. — PMID 16797789.
- ↑ Oda Y. Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system. (англ.) // Pathology international : journal. — 1999. — November (vol. 49, no. 11). — P. 921—937. — doi:10.1046/j.1440-1827.1999.00977.x. — PMID 10594838.
- ↑ Tandon A., Bachoo M., Weldon P., Polosa C., Collier B. Effects of colchicine application to preganglionic axons on choline acetyltransferase activity and acetylcholine content and release in the superior cervical ganglion (англ.) // Journal of Neurochemistry : journal. — 1996. — Vol. 66, no. 3. — P. 1033—1041. — doi:10.1046/j.1471-4159.1996.66031033.x. — PMID 8769864.
- ↑ Pahud G., Salem N., van de Goor J., Medilanski J., Pellegrinelli N., Eder-Colli L. Study of subcellular localization of membrane-bound choline acetyltransferase in Drosophila central nervous system and its association with membranes (англ.) // European Journal of Neuroscience : journal. — 1998. — 25 May (vol. 10, no. 5). — P. 1644—1653. — doi:10.1046/j.1460-9568.1998.00177.x. — PMID 9751137.
- ↑ Bruce G., Hersh L.B. Studies on detergent released choline acetyltransferase from membrane fractions of rat and human brain. (англ.) // Neurochemical Research : journal. — 1987. — December (vol. 12, no. 12). — P. 1059—1066. — doi:10.1007/bf00971705. — PMID 2450285.
- ↑ Carroll P.T. Membrane-bound choline-O-acetyltransferase in rat hippocampal tissue is associated with synaptic vesicles (англ.) // Brain Research : journal. — 1994. — Vol. 633, no. 1—2. — P. 112—118. — doi:10.1016/0006-8993(94)91529-6. — PMID 8137149.
- ↑ Rand, James Acetylcholine. WormBook. Дата обращения: 18 декабря 2023. Архивировано 24 декабря 2013 года.
- ↑ Захаров В.В., Хатиашвили И.Т., Яхно Н.Н. Деменция с тельцами Леви // Неврологический журнал. — 1998. — №6 . —С. 7—11.
- ↑ Dobransky T., Brewer D., Lajoie G., Rylett R. J. Phosphorylation of 69-kDa choline acetyltransferase at threonine 456 in response to amyloid-beta peptide 1-42. (англ.) // The Journal Of Biological Chemistry. — 2003. — 21 February (vol. 278, no. 8). — P. 5883—5893. — doi:10.1074/jbc.M212080200. — PMID 12486117.
- ↑ Nardone R., De Blasi P., Seidl M., Höller Y., Caleri F., Tezzon F., Ladurner G., Golaszewski S., Trinka E. Cognitive function and cholinergic transmission in patients with subcortical vascular dementia and microbleeds: a TMS study. (англ.) // Journal Of Neural Transmission (Vienna, Austria : 1996). — 2011. — September (vol. 118, no. 9). — P. 1349—1358. — doi:10.1007/s00702-011-0650-5. — PMID 21516477.
- ↑ 1 2 Oda Y. Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system. (англ.) // Pathology International. — 1999. — November (vol. 49, no. 11). — P. 921—937. — doi:10.1046/j.1440-1827.1999.00977.x. — PMID 10594838.
- ↑ Shin J., Choi S., Lee J. E., Lee H. S., Sohn Y. H., Lee P. H. Subcortical white matter hyperintensities within the cholinergic pathways of Parkinson's disease patients according to cognitive status. (англ.) // Journal Of Neurology, Neurosurgery, And Psychiatry. — 2012. — March (vol. 83, no. 3). — P. 315—321. — doi:10.1136/jnnp-2011-300872. — PMID 22228726.
- ↑ Wang J., Zhang H. Y., Tang X. C. Cholinergic deficiency involved in vascular dementia: possible mechanism and strategy of treatment. (англ.) // Acta Pharmacologica Sinica. — 2009. — July (vol. 30, no. 7). — P. 879—888. — doi:10.1038/aps.2009.82. — PMID 19574993.
- ↑ Yarnall A., Rochester L., Burn D. J. The interplay of cholinergic function, attention, and falls in Parkinson's disease. (англ.) // Movement Disorders : Official Journal Of The Movement Disorder Society. — 2011. — December (vol. 26, no. 14). — P. 2496—2503. — doi:10.1002/mds.23932. — PMID 21898597.
- ↑ 1 2 3 Dobransky T., Doherty-Kirby A., Kim A. R., Brewer D., Lajoie G., Rylett R. J. Protein kinase C isoforms differentially phosphorylate human choline acetyltransferase regulating its catalytic activity. (англ.) // The Journal Of Biological Chemistry. — 2004. — 10 December (vol. 279, no. 50). — P. 52059—52068. — doi:10.1074/jbc.M407085200. — PMID 15381704.
- ↑ 1 2 Ohno K., Tsujino A., Brengman J. M., Harper C. M., Bajzer Z., Udd B., Beyring R., Robb S., Kirkham F. J., Engel A. G. Choline acetyltransferase mutations cause myasthenic syndrome associated with episodic apnea in humans. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2001. — 13 February (vol. 98, no. 4). — P. 2017—2022. — doi:10.1073/pnas.98.4.2017. — PMID 11172068.
- ↑ Tucek S. Regulation of acetylcholine synthesis in the brain. (англ.) // Journal Of Neurochemistry. — 1985. — January (vol. 44, no. 1). — P. 11—24. — doi:10.1111/j.1471-4159.1985.tb07106.x. — PMID 3880580.
- ↑ Tucek S. The synthesis of acetylcholine: twenty years of progress. (англ.) // Progress In Brain Research. — 1990. — Vol. 84. — P. 467—477. — PMID 2267316.
- ↑ Dobransky T., Rylett R. J. Functional regulation of choline acetyltransferase by phosphorylation. (англ.) // Neurochemical Research. — 2003. — April (vol. 28, no. 3-4). — P. 537—542. — doi:10.1023/a:1022873323561. — PMID 12675142.
- ↑ Rand JB, Russell RL (February 1984). "Choline acetyltransferase-deficient mutants of the nematode Caenorhabditis elegans". Genetics. 106 (2): 227—48. doi:10.1093/genetics/106.2.227. PMC 1202253. PMID 6698395.
- ↑ Greenspan RJ (1980). "Mutations of choline acetyltransferase and associated neural defects". Journal of Comparative Physiology. 137 (1): 83—92. doi:10.1007/BF00656920. S2CID 45897606.
- ↑ Ohno K, Tsujino A, Brengman JM, Harper CM, Bajzer Z, Udd B, Beyring R, Robb S, Kirkham FJ, Engel AG (13 February 2001). "Choline acetyltransferase mutations cause myasthenic syndrome associated with episodic apnea in humans". Proceedings of the National Academy of Sciences. 98 (4): 2017—2022. Bibcode:2001PNAS...98.2017O. doi:10.1073/pnas.98.4.2017. PMC 29374. PMID 11172068.
- ↑ Bartus RT, Dean RL, Beer B, Lippa AS (30 July 1982). "The cholinergic hypothesis of geriatric memory dysfunction". Science. 217 (4558): 408—14. Bibcode:1982Sci...217..408B. doi:10.1126/science.7046051. PMID 7046051.
- ↑ Geula C, Mesulam MM, Saroff DM, Wu CK (January 1998). "Relationship between plaques, tangles, and loss of cortical cholinergic fibers in Alzheimer disease". J Neuropathol Exp Neurol. 57 (1): 63—75. doi:10.1097/00005072-199801000-00008. PMID 9600198.
- ↑ Greer M, Schotland M (July 1960). "Myasthenia gravis in the newborn". Pediatrics. 26: 101—8. doi:10.1542/peds.26.1.101. PMID 13851666. S2CID 8672902.
- ↑ Luine VN (August 1985). "Estradiol increases choline acetyltransferase activity in specific basal forebrain nuclei and projection areas of female rats". Experimental Neurology. 89 (2): 484—90. doi:10.1016/0014-4886(85)90108-6. PMID 2990988. S2CID 1525252.