Фазовая диаграмма
Фа́зовая диагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки).
Анализ фазовых диаграмм
[править | править код]Обычными координатами для построения фазовой диаграммы являются термодинамические параметры — температура и давление — и состав системы (в мольных или массовых процентах).
В общем случае количество координат превышает число компонентов системы на единицу (диаграмма однокомпонентной системы двумерна, двухкомпонентной — трёхмерна и т. п.) Для конденсированных систем зачастую не учитывают изменение фазовых равновесий за счёт давления, в этом случае число измерений диаграммы равно числу компонентов (диаграмма конденсированной двухкомпонентной системы двумерна, трёхкомпонентной — трёхмерна и т. п.) Сложные фазовые диаграммы в печатных изданиях изображают в виде сечений или проекций.
Согласно правилу фаз, на двумерной диаграмме однофазная область описывается полем, двухфазная — линией (на p–T диаграммах) или набором параллельных линий конод, для которых фиксированы составы равновесных фаз (на диаграммах с участием состава), трёхфазная — точкой (на p–T диаграммах) или горизонталью (на T–x или p–x диаграммах).
Диаграммы температура-давление
[править | править код]Диаграммы однокомпонентных систем
[править | править код]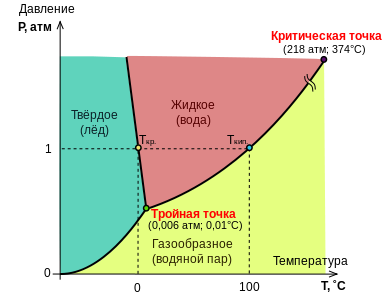

По правилу фаз, на фазовых диаграммах однокомпонентных систем поля соответствуют однофазным состояниям, линии, разграничивающие их — двухфазным, точки пересечения линий — трёхфазным (эти точки называют тройными точками).
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость–газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает. На двухфазных линиях также находятся точки — температуры кристаллизации и кипения при нормальном давлении.
Сечения и проекции диаграмм бинарных систем
[править | править код]Этот раздел не завершён. |
Диаграммы температура-состав
[править | править код]Диаграммы бинарных систем
[править | править код]Этот раздел не завершён. |
Диаграммы тройных систем
[править | править код]
Объёмная диаграмма состояния трёхкомпонентной системы представляет собой прямую трёхгранную призму, в основании которой лежит концентрационный треугольник Гиббса — Розебома, рёбра представляют собой оси температуры, а грани — диаграммы состояния трёх бинарных систем; геометрические элементы (точки и линии) внутри призмы отражают состояние трёхкомпонентной системы.
Для описания состава трёхкомпонентной системы обычно используют косоугольные координаты в виде треугольника Гиббса — Розебома[1]. Применительно к фазовым диаграммам изображённый на рис. TG равносторонний концентрационный треугольник Гиббса (1875) представляет собой изотермическое сечение пространственной диаграммы в форме призмы (ось, перпендикулярная плоскости треугольника, — температура). Любая точка внутри треугольника Гиббса отвечает трёхкомпонентной системе; стороны треугольника отвечают двухкомпонентным системам, вершины — однокомпонентным (содержание компонента 100 %). Содержание каждого из компонентов тем больше, чем ближе расположена фигуративная точка системы к соответствующей вершине. При изображении состава системы по методу Гиббса длина каждого перпендикуляра, опущенного из фигуративной точки на сторону концентрационного треугольника, расположенную напротив вершины, соответствующей искомому компоненту — A, B или C, — отвечает содержанию в системе указанного в вершине компонента, а сумма длин перпендикуляров, опущенных из любой фигуративной точки внутри равностороннего треугольника на его стороны есть величина постоянная и равная высоте этого треугольника, принятой за 100 %[1]. Для удобства треугольник размечают перпендикулярами, опущенными из вершин треугольника на противоположные им стороны, и линиями, параллельными сторонам треугольника. Для изображённой на рисунке фигуративной точки р доли компонентов A, B и C равны соответственно 50, 30 и 20 %.
При изображении состава системы по методу Розебома (1894), получившему большее распространение, нежели исходный метод Гиббса, используют шкалы, нанесённые на стороны равностороннего концентрационного треугольника Розебома (длина каждой стороны треугольника принята за100 %), и линии, параллельные сторонам треугольника[2]. Любая из этих прямых есть геометрическое место точек с одинаковым содержанием компонента, характеризуемого вершиной треугольника против этой стороны, причём самой вершине соответствует 100 % компонента[3]. Отсюда следует, что изначально существует два равноценных варианта выбора стороны концентрационного треугольника для нанесения шкалы искомого компонента, и выбор между этими сторонами произволен. Так, на рис. TR шкалу содержания компонента А можно разместить как на стороне АВ, так и на стороне АС. После того, как обсуждаемый выбор сделан, соответствие между двумя другими компонентами и используемыми для их шкал сторонами треугольника становится однозначным. Для изображённой на рис. TR фигуративной точки доли компонентов A, B и C равны соответственно 20, 20 и 60 %. Применительно к фазовым диаграммам треугольник Розебома представляет собой изотермическое сечение пространственной диаграммы в форме призмы (ось, перпендикулярная плоскости треугольника, — температура).

Изображённая на рис. TD пространственная диаграмма состояния трёхкомпонентной системы с одной тройной эвтектикой[4] соответствует простейшему случаю, когда три компонента А, В и С в бинарных комбинациях А—В, В—С и С—А дают только простые эвтектики. Для изображения свойств такой системы строят прямую призму, в основании которой лежит треугольник Гиббса — Розебома; точки основания треугольника дают состав смесей, а на рёбрах призмы откладывают температуры. Точки А1, B1, С1 отвечают температурам плавления чистых компонентов; кривые А1r1 и В1r1 есть кривые плавкости бинарных смесей А—В и лежат на грани А1АВВ1 призмы; r1 — эвтектика бинарной системы А—В. Такими же эвтектиками являются s1 в бинарной системе B—С и t1 в бинарной системе С—A, лежащие на соответствующих гранях призмы; u1 — тройная эвтектика, в которой в равновесии сосуществуют три твёрдые фазы и расплав, и в которой тройная смесь плавится/застывает как одно целое; r1u1, s1u1 и t1u1 — эвтектические кривые.
Неограниченная растворимость в твёрдом состоянии
[править | править код]Этот раздел не завершён. |
Эвтектические и эвтектоидные превращения
[править | править код]Этот раздел не завершён. |
Сплавы, образующие химические соединения
[править | править код]Этот раздел не завершён. |
Политермические сечения
[править | править код]Этот раздел не завершён. |
Изотермические сечения
[править | править код]Этот раздел не завершён. |
Методы экспериментального построения фазовых диаграмм
[править | править код]Динамические:
- Дифференциальный термический анализ
- Визуальный термический анализ
Статические:
Методы термодинамической оптимизации фазовых диаграмм
[править | править код]Примечания
[править | править код]- ↑ 1 2 Ларичева В. С., Ларичев Т. А., Химическая термодинамика, 2015, с. 224.
- ↑ Ларичева В. С., Ларичев Т. А., Химическая термодинамика, 2015, с. 224—225.
- ↑ Ларичева В. С., Ларичев Т. А., Химическая термодинамика, 2015, с. 225.
- ↑ Раковский А. В., Введение в физическую химию, 1938, рис. 347, с. 392.
Литература
[править | править код]- Ларичева В. С., Ларичев Т. А. Химическая термодинамика. — Кемерово: КемГУ, 2015. — 240 с. — ISBN 978-5-8353-1755-4.
- Раковский А. В. Введение в физическую химию. — М.: Редакция химической литературы ГОНТИ НКТП, 1938. — 680 с.



