Сульфат алюминия
| Сульфат алюминия | |
|---|---|
 | |
 | |
| Общие | |
| Традиционные названия | сернокислый алюминий |
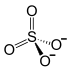
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см³ (безв.) 1,690 г/см³ (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C[1] |
| • кипения | 1600 °C[2] |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства[править | править код]
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см³, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[3][4].
Образует кристаллогидрат с формулой Al2(SO4)3 · 18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см³. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[3]:
- 150 °C — Al2(SO4)3 · 14 H2O,
- 160 °C — Al2(SO4)3 · 10 H2O,
- 250 °C — Al2(SO4)3 · 3 H2O,
- 420 °C — полностью безводную.
Химические свойства[править | править код]
- Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[3]:
- Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[4][5].
- Гидролизуется горячей водой:
- При сплавлении со щелочами образует алюминаты:
- В холодном концентрированном растворе аммиака образует осадок гидроксида, а в горячем – метагидроксида алюминия[6]:
Получение[править | править код]
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение[править | править код]
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[7].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[4].
Примечания[править | править код]
- ↑ Aluminum sulfate (англ.)
- ↑ Aluminum sulfate
- ↑ 1 2 3 Волохов, 1988.
- ↑ 1 2 3 Гурлев, 1988, с. 285.
- ↑ Джеймс, 1980, с. 83.
- ↑ Лидин, 2000, с. 85.
- ↑ E-520 (Е-520) Сульфат алюминия. Дата обращения: 30 марта 2010. Архивировано 15 сентября 2011 года.
Литература[править | править код]
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0)







