Рибосома
Рибосомы, также гранулы Паладе в честь первооткрывателя Джорджа Паладе — немембранные органеллы всех живых клеток. Представляют собой макромолекулярные машины, служащие для биосинтеза белка на стадии трансляции. Рибосомы вместе со связанными органеллами образуют белок-синтезирующий аппарат клеток и двумембранных органелл.
Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметр от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц. Малая субъединица считывает информацию с матричной РНК, а большая — присоединяет соответствующую аминокислоту к синтезируемой цепочке белка.
В эукариотических клетках рибосомы располагаются на мембранах шероховатой эндоплазматической сети и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Обзор рибосом прокариот и эукариот
[править | править код]Рибосомы существуют в клетках как про-, так и эукариот. Рибосомы бактерий, архей и эукариот в значительной степени похожи друг на друга, что свидетельствует об их общем происхождении.Также у клеток всех доменов по одной цепи мРНК одновременно может перемещаться более одной рибосомы (составляя полисому). Прокариотические и эукариотические рибосомы различаются по размеру, структуре, составу и соотношению белка и РНК.
Двумембранные органеллы эукариот (митохондрии и пластиды) обладают собственным белоксинтезирующим аппаратом, в который входят рибосомы, сходные с прокариотическими. Это является одним из доказательств симбиотической теории происхождения указанных органелл.
Различия в структуре прокариотических и эукариотических рибосом позволяют некоторым антибиотикам убивать бактерии, ингибируя их рибосомы и оставляя при этом человеческие рибосомы незатронутыми. Однако при этом они могут действовать на митохондриальные рибосомы.
Прокариотические рибосомы
[править | править код]Прокариотические рибосомы имеют диаметр около 20 нм (200 Å) и состоят из 65 % рРНК и 35 % рибосомальных белков, имеют коэффициент седиментации 70S, каждая рибосома состоит из малой (30S) и большой (50S) субъединиц.
Рибосомы архей имеют те же размеры, что и бактериальные (70S, состоящие из 50S большой субъединицы и 30S малой субъединицы). Однако по составу они гораздо ближе к эукариотическим, чем к бактериальным. Многие рибосомные белки архей имеет эукариотические, но не бактериальные аналоги.
Эукариотические рибосомы
[править | править код]Эукариотические рибосомы имеют диаметр от 25 до 30 нм (250-300 Å) с отношением рРНК к белку, близким к 1, имеют коэффициент седиментации 80S, каждая состоит из малой (40S) и большой (60S) субъединиц.
Миторибосомы и Пласторибосомы
[править | править код]У эукариот рибосомы присутствуют в митохондриях (миторибосомы) и в пластидах (пласторибосомы). Они также состоят из больших и малых субъединиц, связанных вместе с белками в одну частицу 70S. Эти рибосомы похожи на рибосомы бактерий. Из двух, ближе к бактериальным пласторибосомы. Многие фрагменты митохондриальных рРНК укорочены, а в случае 5S рРНК заменяется другими структурами у животных и грибов. В частности, Leishmania tarentolae имеет минимальный набор митохондриальной рРНК. Напротив, растительные миторибосомы имеют как расширенную рРНК, так и дополнительные белки по сравнению с бактериями, в частности, многие белки с пентатрикопетидным повтором.
Криптомонадные и хлорарахниофитные водоросли могут содержать нуклеоморф, напоминающий рудиментарное эукариотическое ядро. Эукариотические 80-е рибосомы могут присутствовать в отсеке, содержащем нуклеоморф.

1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Состав и структура рибосомы
[править | править код]Рибосомы представляют собой нуклеопротеид и состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов. Рибосомные белки и рРНК организованы в две отдельные рибосомальные части разного размера, известные обычно как большая и малая субъединицы рибосомы. Две субъединицы подходят друг к другу и работают как одна, чтобы преобразовать мРНК в полипептидную цепь во время синтеза белка. Поскольку субъединицы неодинакового размера, рибосомы немного длиннее по оси, чем по диаметру.
Соотношение РНК/белок в рибосомах составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом прокариотических клеток, митохондрий и пластид — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Рибосомные РНК
[править | править код]Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рРНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы
[править | править код]Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластид высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы
[править | править код]Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки
[править | править код]Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты
[править | править код]Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции
[править | править код]Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлиняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы
[править | править код]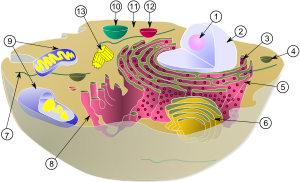
(1) Ядрышко
(2) Ядро
(3) рибосома (маленькие точки)
(4) Везикула
(5) шероховатый эндоплазматический ретикулум (ER)
(6) Аппарат Гольджи
(7) Цитоскелет
(8) Гладкий эндоплазматический ретикулум
(9) Митохондрия
(10) Вакуоль
(11) Цитоплазма
(12) Лизосома
(13) Центриоль и Центросома
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе, Альбер Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания
[править | править код]- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A., Beringer M., Rodnina M. V., Wolfenden R. The ribosome as an entropy trap. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2004. — 25 May (vol. 101, no. 21). — P. 7897—7901. — doi:10.1073/pnas.0402488101. — PMID 15141076.
- ↑ Schmeing T. M., Huang K. S., Strobel S. A., Steitz T. A. An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. (англ.) // Nature. — 2005. — 24 November (vol. 438, no. 7067). — P. 520—524. — doi:10.1038/nature04152. — PMID 16306996.
- ↑ Hesslein A. E., Katunin V. I., Beringer M., Kosek A. B., Rodnina M. V., Strobel S. A. Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes. (англ.) // Nucleic Acids Research. — 2004. — Vol. 32, no. 12. — P. 3760—3770. — doi:10.1093/nar/gkh672. — PMID 15256541.
- ↑ Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis. (англ.) // Science (New York, N.Y.). — 2000. — 11 August (vol. 289, no. 5481). — P. 920—930. — PMID 10937990.
- ↑ Schmeing T. M., Huang K. S., Kitchen D. E., Strobel S. A., Steitz T. A. Structural insights into the roles of water and the 2' hydroxyl of the P site tRNA in the peptidyl transferase reaction. (англ.) // Molecular Cell. — 2005. — 11 November (vol. 20, no. 3). — P. 437—448. — doi:10.1016/j.molcel.2005.09.006. — PMID 16285925.
- ↑ PALADE GE. A small particulate component of the cytoplasm. (англ.) // The Journal Of Biophysical And Biochemical Cytology. — 1955. — January (vol. 1, no. 1). — P. 59—68. — doi:10.1083/jcb.1.1.59. — PMID 14381428.
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. Crystal structure of the eukaryotic ribosome. (англ.) // Science (New York, N.Y.). — 2010. — 26 November (vol. 330, no. 6008). — P. 1203—1209. — doi:10.1126/science.1194294. — PMID 21109664.
- ↑ Bokov K., Steinberg S. V. A hierarchical model for evolution of 23S ribosomal RNA. (англ.) // Nature. — 2009. — 19 February (vol. 457, no. 7232). — P. 977—980. — doi:10.1038/nature07749. — PMID 19225518.
Литература
[править | править код]- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.