Ингибиторы белка NS5A: различия между версиями
Tosha (обсуждение | вклад) Создано переводом страницы «Discovery and development of NS5A inhibitors» |
(нет различий)
|
Версия от 02:58, 11 апреля 2017

Неструктурные белки 5А (белка ns5a) ингибиторы относятся к классу противовирусных препаратов под названием ингибиторы протеазы. Они прямого действия противовирусные препараты прямого действия, которые ориентированы на вирусные белки, и их развитие является кульминацией более глубокого понимания вирусного жизненного цикла.[1][2] однако, их механизм действия сложен и не полностью изучен. белка ns5a ингибиторы были в центре внимания большого внимания, когда они появились как часть первого лечения для вируса гепатита С (ВГС) инфекции в 2014 году.[3] благоприятные характеристики были введены через различные структурные изменения и структурные сходства между белка ns5a ингибиторы, которые клинически одобрены очевидны.[4][5] несмотря на недавнее появление многочисленных новых противовирусных препаратов, сопротивление по-прежнему вызывает озабоченность и эти ингибиторы поэтому всегда используется в сочетании с другими препаратами.[6][7]
Вирус гепатита С
ВГС является положительным смысле одноцепочечной РНК вирус , который был продемонстрирован на репликацию в гепатоцитах человека и шимпанзе. Один ВГС polyprotein переводится, а затем расщепляется клеточными и вирусными протеазами на три структурных белков (ядерный, E1 и Е2) и семь неструктурных белков (р7, в ns2, сайт ns3, NS4A, NS4B, ns5a, и NS5B).[8][9]
ВГС среди ведущих причин заболевания печени во всем мире. Он передается только через кровь и чаще всего заразилась через использование зараженных игл.[10] у пациентов, страдающих хронической HCV-инфекции находятся на значительный риск цирроза и гепатоцеллюлярной карциномы, которые являются ведущими причинами смерти ВИЧ-инфицированных.[11][12]
Вирус был вокруг в течение тысячелетий и был классифицирован в шести известных генотипов, каждый из которых содержит множество подтипов. Седьмой остается неспецифических. Генотип контракт указывает, какие конкретные процедуры являются жизнеспособными.[13]
Рецепторного белка ns5a
Базовая структура и химические свойства
Белка ns5a большой гидрофильные фосфопротеин , который необходим для ВГС жизненного цикла и находится в ассоциации с вирус-индуцированной мембраны везикулы, называют мембранозной веб.[14][15] белка ns5a представляет собой пролин-богатый белок , состоящий из примерно 447 аминокислот, которая разделена на три области.[16][17] эти домены связаны между собой двумя низкими сложности последовательностей, либо серин- или пролин-богатых.[18] домен я-это цинк-связывающий домен , который имеет два димерных конформациях. Домен II и III являются неструктурированными.[19] домен я предшествует N-терминального amphipathic спирали , которая позволяет протеину ассоциированный с эндоплазматическим ретикулумомполученных мембран.[20][21]
Белка ns5a, в основном, существует в двух различных фосфорилированных форм, hypophosphorylated и hyperphosphorylated форме, но точная функция фосфорилирования пока не определена.[22]
Функция
В белка ns5a белок играет важную роль в репликации вирусной РНК, сборку вирусных и сложных взаимодействий с клеточными функциями. этот белок был вовлечен в модуляцию защитные силы организма, апоптоз, в клеточный цикл, и стресс-отзывчивый пути. однако, ее функции и структуру еще предстоит выяснить.
Белка ns5a, кажется, ключ в вызывать формирование перепончатой веб в отсутствии других подобных неструктурных белков. много белков внутри клетки-хозяина могут быть затронуты белка ns5a, например, фосфатидилинозитол-4-киназы Іііа (PI4KIIIa), а киназа требуется для репликации ВГС. Эта киназа участвует в биосинтезе из фосфатидилинозитол-4-фосфат (PI4P), взаимодействуя с белка ns5a, который стимулирует ее деятельность и достижения целостности мембранных интернете.[23][24]
Недавно, центральную роль белка ns5a в вирусное распространение сделало его мишенью для разработки лекарств. Как следствие, новые противовирусные препараты для лечения ВГС.
Механизм действия
Ингибиторы белка ns5a были разработаны для целевой белка ns5a белок. Эти ингибиторы добились значительного снижения РНК ВГС в крови и, следовательно, может рассматриваться как мощный антивирусный препарат. Механизм их действия считается разнообразным, но точный механизм не полностью понят.[25] большинство исследований предполагают, что белка ns5a ингибиторы действуют на двух основных этапах жизненного цикла ВГС; репликацию геномной РНК и сборки вириона. Другие исследования предложить изменения клеток-хозяев факторы, как возможный третий механизм.[26]

Структура белка ns5a ингибиторы характеризуется димерных симметрии. Это говорит о том что белка ns5a ингибиторы действуют на димеров белка ns5a.[27] ряд моделирования исследования показали, что даклатасвир, который является ингибитором белка ns5a, только связывает "спина к спине" белка ns5a димер и что привязка должна быть симметричной. Другие модельные исследования показали, что привязка к другим конформации белка ns5a возможно, а также асимметричный привязки. исследования показали, что даклатасвир работает скорее всего домена из белка ns5a. , хотя механизм не совсем понял, было продемонстрировано, что ингибиторы downregulate белка ns5a hyperphosphorylation, что приводит к подавлению репликации ВГС и его обработка polyproteins, а также в результате необычного протеина месте.[28] до сих пор, это торможение требует только белка ns5a домена, но не доменами II и III. однако, недавние исследования показали, что оба домена I и II относятся к этому нарушению репликации РНК.[29]
Ингибиторы белка ns5a кажется, кроме того препятствуют образованию новых replicase комплексов в результате постепенного замедления синтеза вирусной РНК. Влияние на ранее сформированные комплексы еще не проявилось.[30]
Имеющиеся данные свидетельствуют о том, что ингибиторы белка ns5a изменить расположение белка ns5a внутри клетки. Это может привести к нарушению сборки, ведущая к искаженной вирусов. некоторые исследования показали, что ингибирование вирусной сборка имеет более важную роль в сокращении вирусной репликации РНК, чем сокращение.[31]
Исследования показали, что белка ns5a ингибиторы блокируют формирование перепончатой веб, который защищает вирусного генома и особенности основных сайтов для вирусной репликации и сборки.[32] этот механизм считается независимой от репликации РНК, но, кажется, быть затронуты белка ns5a ингибиторы, блокирующие формирование PI4KIIIa-белка ns5a-комплекса, необходимые для синтеза PI4P, что приводит к снижению целостности перепончатого веб-и, следовательно, уменьшением репликации РНК ВГС.[33]
История
Исследования ВГС добилось больших успехов в последние годы, с открытием и началом клинической разработки множества новых препаратов для лечения ВГС. Среди этих препаратов являются Пппд которые включают белка ns5a ингибиторы.[34] Белка ns5a ингибиторы были найдены особенно эффективен при лечении гепатита, где они были использованы в сочетании с другими ингибиторами протеазы, такими как ингибиторы NS5B (например, софосбувир), пегилированные интерфероны (например, пегинтерферон Альфа-2а) и рибонуклеиновой аналоги (например, рибавирином).[35][36][37] всегда присутствует риск вирусных штаммов развивается иммунитет является главным фактором, почему они используются в комбинации с одним или более дополнительных лекарств.[38]
Побочных эффектов, а также обширным и сложным приема препаратов с сопровождающими низкий уровень соблюдения ставок, были помехой в развитии противовирусного лечения. Сочетание белка ns5a и NS5B ингибитора дала положительные результаты в этом отношении.[39]
Открытия и разработки лекарственных средств
Открытие

Обнаружение ингибитора белка ns5a состоялась в контексте преследования для лечения ВГС. Белка ns5a является одним из семи неструктурных белков, которые образуют комплекс с вирусной РНК в инфицированных клетках, чтобы инициировать репликацию ВГС.[40] ВГС исследования произвел несколько Даас, включая NS3A, NS4A и NS5B ингибитора, а также белка ns5a ингибиторы.[41]
Развитие
Разработка противовирусных препаратов, способных мешать белки, ответственные за репликацию вируса тесно связана с достижениями в области технологий для создания эффективной клеточной культуры систем, необходимых для экрана для них.
В 1999 году произошел прорыв, когда в полный рост консенсуса геном клонированной с РНК ВГС была обнаружена повторить на высоких уровнях, когда трансфицированных в гепатомы человека линии клеток.[42] этот метод был улучшен с использованием культуры клеток-адаптивных мутаций, которые повышают РНК репликации.[43]
Скрининг подготовила ряд ингибиторов белка ns5a, которые были включены в методы лечения HCV. Первым в этом новом классе препаратов даклатасвир, который получил УЛХ утверждения в 2015 году.[44] другие препараты были одобрены, среди них, в частности, ледипасвир, который, наряду с софосбувир составляют гепатита С препаратом Harvoni.[45][46]
Хотя белка ns5a ингибиторы доказали свою эффективность противовирусных препаратов, они должны быть использованы наряду с дополнительных противовирусных препаратов, так как они быстро приводят к развитию стойких мутаций , когда приведенный в качестве монопрепарата.[47] это из ингибитора ns5a развития, от которого асимметричные варианты, которые метаболизируют в аналоги с дополнительным сопротивлением профили появились, среди других открытий.[48]
Структура-активность взаимосвязь
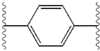
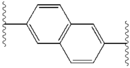
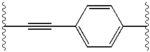
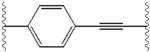
Структурное сходство между ингибиторами очевидны. придатков центрального ядра, как правило, симметричны и имеют имидазол-пролин структуры. естественный L-конфигурацию пролин производные оказалась критической для торможения с неестественно D-конфигурацию существенно слабее активность. В потенции ингибиторов, соответственно, чувствительны к изменениям в Амин покрывая элемент. Эти наблюдения показывают, что Амин регионе молекул играет важную роль в ингибиторной активности.[49]
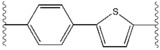
Благоприятные характеристики в качестве ингибитора ns5a включают высокую потенцию и длительный плазмы полувыведения для достижения один раз в день-дозировка. Слегка асимметричный придатки, как видно в ледипасвир, были обнаружены отличительные преимущества для оптимизации ингибиторной активности и фармакокинетики. структура центрального ядра изменения расстояния и проекции придатков, а также положение липофильности в Центральном ядре, которое влияет на ингибиторной активности в частности. Структуры с конденсированными центрального кольца последовательно показывают более ингибиторной активности, в то время как менее липофильные центрального ядра обеспечивают ослабление активности. симметричные бис-имидазол структурами, такими как даклатасвир, возникнуть потеря потенции, когда fluorene будет заменен на biaryl группы. Эта замена также приводит к ряду серьезных проблем со стабильностью.[50] однако, менее липофильные разъем, таких как difluoromethylene создает наиболее мощным ингибитором в асимметричную структуру. Кроме того, она обеспечивает улучшенную биодоступность и более благоприятный период полувыведения из плазмы. Существует также значительное увеличение потенции, когда фенил заменяется нафтил как центрального ядра. Интересно, этот рост значительно выше в асимметричную структуру, чем в симметричной структуре. В асимметричных структурах, разница в энергии между фенил-алкин ингибиторы демонстрирует важность позиции липофильностью. Более расположен в центре алкин, который является менее липофильные разъем, чем фенил, улучшает потенцию.
| Structure | Activity | |
|---|---|---|
| {{{3}}} | IC50 (nM) | Inhibitory activity |
| >44 | None | |
| >44 | None | |
| 11 | Very weak | |
| 1.7 | Weak | |
| 0.50 | Moderate | |
| 3.7 | Weak | |
| 0.11 | Moderate | |
| 0.20 | Moderate | |
| Structure | Activity | |
|---|---|---|
| {{{3}}} | IC50 (nM) | Inhibitory activity |
| >44 | None | |
| 0.071 | Moderate | |
| 2.5 | Weak | |
| 0.38 | Moderate | |
| 0.20 | Moderate | |
| 0.17 | Moderate | |
| 0.040 | Strong | |
| Структура | Деятельность | |
|---|---|---|
| {{{3}}} | СК50 (нм) | Ингибиторной активности |
| Ч2 | 0.094 | Сильный |
| Сотрудничество | 0.30 | Умеренный |
| С(СН3)2 | 1.2 | Слабый |
Сопротивление
Потенциал сопротивления против ВГС даа наркотиков является проблемой. среди ВГС квазивидов есть готовые варианты с потенциалом, чтобы сопротивляться белка ns5a ингибиторы, не имея никакого предыдущего воздействия этих наркотиков. Как правило, репликация этих вариантов происходит только в ничтожно малых количествах, что делает их невозможно обнаружить с помощью существующих методов. С другой стороны, можно выборочно растут иммунной вариантов в присутствии ингибитора белка ns5a. ВГС сопротивление характеризуется определенным побег узором. Этот шаблон часто связаны с аминокислотными заменами, которые возлагают на вирус надежной лекарственной устойчивости без ущерба вирусной пригодности.[51] было установлено, что белка ns5a ингибиторы обладают сравнительно низкий порог сопротивления, и варианты, связанные с белка ns5a сопротивления, как было показано, чтобы выдержать до шести месяцев у больных после прекращения лечения.[52] таким образом, комбинированная терапия производить более высокую эффективность и более короткие периоды обработки.
Будущее научных исследований и новые поколения ингибиторов белка ns5a
Разработчики даа лицо вероятные проблемы в будущем. Лечебная пробелы для людей, страдающих от осложняющих недугов, таких как хроническая болезнь почек и циррозом должны быть преодолены. Короче терапии при легких побочных эффектов, даст более широкое присоединение, и всегда присутствует спектра лекарственной устойчивости маячит. Высоко адаптивный ВГС превратился в целый ряд различных геномов, что все должны быть адекватное лечение, предпочтительно с пан-генотипические схемы.[53]
Некоторые из этих проблем уже есть возможные решения в поле зрения. Ингибитор протеазы АБТ-493 и следующего поколения ингибитора ns5a АБТ-530 считаются активных в отношении всех генотипов HCV, в том числе трудно поддающихся лечению Генотип 3. в пробирке, АБТ-530 показал эффективность против сопротивления связан вариантов, которые имеют иммунитет к первым поколениям белка ns5a ингибиторы, в том числе и ледипасвир, даклатасвир и омбитасвир. поскольку этот препарат комбинация имеет дополнительное качество бытия в печени очищается, он обещает, что пациенты, страдающие хроническими заболеваниями почек и гепатитом могут получить безопасный, Non-софосбувир-лечение в ближайшем будущем.
Не менее трех комбинаций препаратов для лечения гепатита С находятся в стадии разработки и будет утвержден в 2016-2017: Софосбувир в сочетании с velpatasvir, АБТ-493 в комбинации с abt-530, и grazoprevir в сочетании с сегодня компания открывает, разрабатывает, которых velpatasvir, АБТ-530 и сегодня компания открывает, разрабатывает не белка ns5a ингибиторы.
См. также
Ссылки
- ↑ Gogela, Neliswa A.; Lin, Ming V.; Wisocky, Jessica L.; Chung, Raymond T. (12 March 2015). "Enhancing Our Understanding of Current Therapies for Hepatitis C Virus (HCV)". Current HIV/AIDS Reports. 12 (1): 68—78. doi:10.1007/s11904-014-0243-7. PMC 4373591. PMID 25761432.
- ↑ Pawlotsky, Jean-Michel (August 2013). "NS5A inhibitors in the treatment of hepatitis C". Journal of Hepatology. 59 (2): 375—382. doi:10.1016/j.jhep.2013.03.030.
- ↑ Do, Albert; Mittal, Yash; Liapakis, AnnMarie; Cohen, Elizabeth; Chau, Hong; Bertuccio, Claudia; Sapir, Dana; Wright, Jessica; Eggers, Carol; Drozd, Kristine; Ciarleglio, Maria; Deng, Yanhong; Lim, Joseph K.; Jhaveri, Ravi (27 August 2015). "Drug Authorization for Sofosbuvir/Ledipasvir (Harvoni) for Chronic HCV Infection in a Real-World Cohort: A New Barrier in the HCV Care Cascade". PLOS ONE. 10 (8): e0135645. doi:10.1371/journal.pone.0135645. PMC 4552165. PMID 26312999.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Tong, Ling; Yu, Wensheng; Coburn, Craig A.; Meinke, Peter T.; Nair, Anilkumar G.; Dwyer, Michael P.; Chen, Lei; Selyutin, Oleg; Rosenblum, Stuart B.; Jiang, Yueheng; Fells, James; Hu, Bin; Zhong, Bin; Soll, Richard M.; Liu, Rong; Agrawal, Sony; Xia, Ellen; Zhai, Ying; Kong, Rong; Ingravallo, Paul; Nomeir, Amin; Asante-Appiah, Ernest; Kozlowski, Joseph A. (July 2016). "Alternative core development around the tetracyclic indole class of HCV NS5A inhibitors". Bioorganic & Medicinal Chemistry Letters. 26: 5132—5137. doi:10.1016/j.bmcl.2016.07.057. PMID 27634194.
- ↑ Lemm, J. A.; Leet, J. E.; O'Boyle, D. R.; Romine, J. L.; Huang, X. S.; Schroeder, D. R.; Alberts, J.; Cantone, J. L.; Sun, J.-H.; Nower, P. T.; Martin, S. W.; Serrano-Wu, M. H.; Meanwell, N. A.; Snyder, L. B.; Gao, M. (16 May 2011). "Discovery of Potent Hepatitis C Virus NS5A Inhibitors with Dimeric Structures". Antimicrobial Agents and Chemotherapy. 55 (8): 3795—3802. doi:10.1128/AAC.00146-11. PMC 3147613. PMID 21576451.
- ↑ Fridell, R. A.; Qiu, D.; Wang, C.; Valera, L.; Gao, M. (28 June 2010). "Resistance Analysis of the Hepatitis C Virus NS5A Inhibitor BMS-790052 in an In Vitro Replicon System". Antimicrobial Agents and Chemotherapy. 54 (9): 3641—3650. doi:10.1128/AAC.00556-10. PMC 2935007. PMID 20585111.
- ↑ Asselah, Tarik; Boyer, Nathalie; Saadoun, David; Martinot-Peignoux, Michele; Marcellin, Patrick (January 2016). "Direct-acting antivirals for the treatment of hepatitis C virus infection: optimizing current IFN-free treatment and future perspectives". Liver International. 36: 47—57. doi:10.1111/liv.13027.
- ↑ Halliday, John (9 January 2014). "Vaccination for hepatitis C virus: closing in on an evasive target". Expert Review of Vaccines. 10 (5): 659—672. doi:10.1586/erv.11.55. PMID 21604986.
- ↑ Grakoui, A (1 March 1993). "Expression and identification of hepatitis C virus polyprotein cleavage products". Journal of Virology. 67 (3): 1385—1395. ISSN 0022-538X. PMID 7679746.
- ↑ Chan, Juliana (May 2014). "Hepatitis C". Disease-a-Month. 60 (5): 201—212. doi:10.1016/j.disamonth.2014.04.002.
- ↑ Seeff, Leonard B. (November 2002). "Natural history of chronic hepatitis C". Hepatology. 36 (5): s35—s46. doi:10.1053/jhep.2002.36806.
- ↑ Liang, T. Jake (15 February 2000). "Pathogenesis, Natural History, Treatment, and Prevention of Hepatitis C". Annals of Internal Medicine. 132 (4): 296. doi:10.7326/0003-4819-132-4-200002150-00008.
- ↑ Pybus, O. G. (29 October 2008). "Genetic History of Hepatitis C Virus in East Asia". Journal of Virology. 83 (2): 1071—1082. doi:10.1128/JVI.01501-08. PMID 18971279.
- ↑ Tellinghuisen, T. L. (21 November 2007). "Identification of Residues Required for RNA Replication in Domains II and III of the Hepatitis C Virus NS5A Protein". Journal of Virology. 82 (3): 1073—1083. doi:10.1128/JVI.00328-07. PMID 18032500.
- ↑ Reghellin, V. (15 September 2014). "NS5A Inhibitors Impair NS5A-Phosphatidylinositol 4-Kinase III Complex Formation and Cause a Decrease of Phosphatidylinositol 4-Phosphate and Cholesterol Levels in Hepatitis C Virus-Associated Membranes". Antimicrobial Agents and Chemotherapy. 58 (12): 7128—7140. doi:10.1128/AAC.03293-14.
- ↑ Yamasaki, Lilian HT (2012). "New insights regarding HCV-NS5A structure/function and indication of genotypic differences". Virology Journal. 9 (1): 14. doi:10.1186/1743-422X-9-14.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Masaki, T. (23 April 2014). "Involvement of Hepatitis C Virus NS5A Hyperphosphorylation Mediated by Casein Kinase I- in Infectious Virus Production". Journal of Virology. 88 (13): 7541—7555. doi:10.1128/JVI.03170-13. PMID 24760886.
- ↑ Ross-Thriepland, D. (20 November 2013). "Insights into the Complexity and Functionality of Hepatitis C Virus NS5A Phosphorylation". Journal of Virology. 88 (3): 1421—1432. doi:10.1128/JVI.03017-13. PMID 24257600.
- ↑ Foster, T. L. (30 June 2010). "All Three Domains of the Hepatitis C Virus Nonstructural NS5A Protein Contribute to RNA Binding". Journal of Virology. 84 (18): 9267—9277. doi:10.1128/JVI.00616-10. PMID 20592076.
- ↑ Fridell, R. A. (18 May 2011). "Distinct Functions of NS5A in Hepatitis C Virus RNA Replication Uncovered by Studies with the NS5A Inhibitor BMS-790052". Journal of Virology. 85 (14): 7312—7320. doi:10.1128/JVI.00253-11. PMID 21593143.
- ↑ Ascher, David B. (23 April 2014). "Potent hepatitis C inhibitors bind directly to NS5A and reduce its affinity for RNA". Scientific Reports. 4. doi:10.1038/srep04765. PMID 24755925.
- ↑ Xiong, Wei (15 July 2015). "Vinexin β Interacts with Hepatitis C Virus NS5A, Modulating Its Hyperphosphorylation To Regulate Viral Propagation". Journal of Virology. 89 (14): 7385—7400. doi:10.1128/JVI.00567-15.
- ↑ Reiss, Simon (January 2011). "Recruitment and Activation of a Lipid Kinase by Hepatitis C Virus NS5A Is Essential for Integrity of the Membranous Replication Compartment". Cell Host & Microbe. 9 (1): 32—45. doi:10.1016/j.chom.2010.12.002. PMID 21238945.
- ↑ Lim, Y.-S. (5 February 2011). "Hepatitis C Virus NS5A Protein Interacts with Phosphatidylinositol 4-Kinase Type III and Regulates Viral Propagation". Journal of Biological Chemistry. 286 (13): 11290—11298. doi:10.1074/jbc.M110.194472.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Ahmed, Marawan (3 August 2016). "A Comprehensive Computational Analysis for the Binding Modes of Hepatitis C Virus NS5A Inhibitors: The Question of Symmetry". ACS Infectious Diseases. 2: 872—881. doi:10.1021/acsinfecdis.6b00113.
- ↑ Issur, Moheshwarnath (6 November 2014). "Resistance Patterns Associated with HCV NS5A Inhibitors Provide Limited Insight into Drug Binding". Viruses. 6 (11): 4227—4241. doi:10.3390/v6114227.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Lambert, Sebastian M. (June 2014). "The crystal structure of NS5A domain 1 from genotype 1a reveals new clues to the mechanism of action for dimeric HCV inhibitors". Protein Science. 23 (6): 723—734. doi:10.1002/pro.2456. PMID 24639329.
- ↑ Qiu, D. (27 July 2011). "The effects of NS5A inhibitors on NS5A phosphorylation, polyprotein processing and localization". Journal of General Virology. 92 (11): 2502—2511. doi:10.1099/vir.0.034801-0.
- ↑ Belema, Makonen (13 March 2014). "Discovery and Development of Hepatitis C Virus NS5A Replication Complex Inhibitors". Journal of Medicinal Chemistry. 57 (5): 1643—1672. doi:10.1021/jm401793m.
- ↑ Guedj, J. (19 February 2013). "Modeling shows that the NS5A inhibitor daclatasvir has two modes of action and yields a shorter estimate of the hepatitis C virus half-life". Proceedings of the National Academy of Sciences. 110 (10): 3991—3996. doi:10.1073/pnas.1203110110. PMID 23431163.
- ↑ McGivern, David R. (August 2014). "Kinetic Analyses Reveal Potent and Early Blockade of Hepatitis C Virus Assembly by NS5A Inhibitors". Gastroenterology. 147 (2): 453—462.e7. doi:10.1053/j.gastro.2014.04.021. PMID 24768676.
- ↑ Neufeldt, Christopher J. (10 February 2016). "The Hepatitis C Virus-Induced Membranous Web and Associated Nuclear Transport Machinery Limit Access of Pattern Recognition Receptors to Viral Replication Sites". PLOS Pathogens. 12 (2): e1005428. doi:10.1371/journal.ppat.1005428.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Berger, Carola (November 2014). "Daclatasvir-Like Inhibitors of NS5A Block Early Biogenesis of Hepatitis C Virus–Induced Membranous Replication Factories, Independent of RNA Replication". Gastroenterology. 147 (5): 1094—1105.e25. doi:10.1053/j.gastro.2014.07.019. PMID 25046163.
- ↑ Zhang, Xingquan (January 2016). "Direct anti-HCV agents". Acta Pharmaceutica Sinica B. 6 (1): 26—31. doi:10.1016/j.apsb.2015.09.008.
- ↑ Fung, A. (14 April 2014). "Efficiency of Incorporation and Chain Termination Determines the Inhibition Potency of 2'-Modified Nucleotide Analogs against Hepatitis C Virus Polymerase". Antimicrobial Agents and Chemotherapy. 58 (7): 3636—3645. doi:10.1128/AAC.02666-14. PMID 24733478.
- ↑ Bruder Costa, Juliana (27 June 2016). "Pegylated Interferon α-2a Triggers NK-Cell Functionality and Specific T-Cell Responses in Patients with Chronic HBV Infection without HBsAg Seroconversion". PLOS ONE. 11 (6): e0158297. doi:10.1371/journal.pone.0158297.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Poordad, Fred (August 2016). "High antiviral activity of NS5A inhibitor ABT-530 with paritaprevir/ritonavir and ribavirin against hepatitis C virus genotype 3 infection". Liver International. 36 (8): 1125—1132. doi:10.1111/liv.13067.
- ↑ Gaudieri, Silvana (April 2009). "Hepatitis C virus drug resistance and immune-driven adaptations: Relevance to new antiviral therapy". Hepatology. 49 (4): 1069—1082. doi:10.1002/hep.22773. PMID 19263475.
- ↑ Archer, Melissa UPDATE: New Hepatitis C Combination Agents. Utah Department of Health. Дата обращения: 8 сентября 2016.
- ↑ Blight, K. J. (8 December 2000). "Efficient Initiation of HCV RNA Replication in Cell Culture". Science. 290 (5498): 1972—1974. doi:10.1126/science.290.5498.1972. PMID 11110665.
- ↑ Conte, Immacolata (March 2009). "Synthesis and SAR of piperazinyl-N-phenylbenzamides as inhibitors of hepatitis C virus RNA replication in cell culture". Bioorganic & Medicinal Chemistry Letters. 19 (6): 1779—1783. doi:10.1016/j.bmcl.2009.01.066. PMID 19216075.
- ↑ Lohmann, V. (2 July 1999). "Replication of Subgenomic Hepatitis C Virus RNAs in a Hepatoma Cell Line". Science. 285 (5424): 110—113. doi:10.1126/science.285.5424.110.
- ↑ Lohmann, V. (1 March 2003). "Viral and Cellular Determinants of Hepatitis C Virus RNA Replication in Cell Culture". Journal of Virology. 77 (5): 3007—3019. doi:10.1128/JVI.77.5.3007-3019.2003.
- ↑ "FDA approves new treatment for chronic hepatitis C genotype 3 infections". FDA. 27 July 2015. Дата обращения: 29 сентября 2016.
- ↑ Link, John O. (13 March 2014). "Discovery of Ledipasvir (GS-5885): A Potent, Once-Daily Oral NS5A Inhibitor for the Treatment of Hepatitis C Virus Infection". Journal of Medicinal Chemistry. 57 (5): 2033—2046. doi:10.1021/jm401499g.
- ↑ Keating, Gillian M. (3 April 2015). "Ledipasvir/Sofosbuvir: A Review of Its Use in Chronic Hepatitis C". Drugs. 75 (6): 675—685. doi:10.1007/s40265-015-0381-2. PMID 25837989.
- ↑ Nakamoto, Shingo (2014). "Hepatitis C virus NS5A inhibitors and drug resistance mutations". World Journal of Gastroenterology. 20 (11): 2902. doi:10.3748/wjg.v20.i11.2902. PMID 24659881.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Boucle, Sebastien (September 2015). "Design, synthesis and evaluation of novel anti-HCV molecules that deliver intracellularly three highly potent NS5A inhibitors". Bioorganic & Medicinal Chemistry Letters. 25 (17): 3711—3715. doi:10.1016/j.bmcl.2015.06.031. PMID 26099532.
- ↑ Romine, Jeffrey L. (10 March 2011). "Inhibitors of HCV NS5A: From Iminothiazolidinones to Symmetrical Stilbenes". ACS Medicinal Chemistry Letters. 2 (3): 224—229. doi:10.1021/ml1002647.
- ↑ Shi, Junxing (May 2012). "Synthesis and biological evaluation of new potent and selective HCV NS5A inhibitors". Bioorganic & Medicinal Chemistry Letters. 22 (10): 3488—3491. doi:10.1016/j.bmcl.2012.03.089. PMID 22507961.
- ↑ Strahotin, Cristina Simona (2012). "Hepatitis C Variability, Patterns of Resistance, and Impact on Therapy". Advances in Virology. 2012: 1—10. doi:10.1155/2012/267483.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Owens, Christopher M. (October 2016). "Preclinical and Clinical Resistance Profile of EDP-239, a Novel Hepatitis C Virus NS5A Inhibitor". Antimicrobial Agents and Chemotherapy. 60 (10): 6216—6226. doi:10.1128/AAC.00815-16. PMID 27503644.
- ↑ Feld, Jordan J. (October 2016). "Second generation direct-acting antivirals – Do we expect major improvements?". Journal of Hepatology. 65 (1): S130—S142. doi:10.1016/j.jhep.2016.07.007.