Ментол
| Ментол | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
(5R)-метил-(2S)-(2-пропил)-(1R)-циклогексанол | ||
| Традиционные названия | 3-p-ментанол, гексагидротимол, мятная камфора, (-)-ментол | ||
| Хим. формула | C10H20O | ||
| Физические свойства | |||
| Состояние | кристаллическое | ||
| Молярная масса | 156,27 г/моль | ||
| Плотность | 0,890 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления |
36-38 °C (311 K), рацемат 42-45 °C (318 K), (−)-форма (α) 35-33-31 °C, (−)-изомер |
||
| • кипения | 212 °C | ||
| • вспышки | 93 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | малорастворим | ||
| • в этаноле, уксусной кислоте, гексане | растворим | ||
| • в эфире | растворим | ||
| • в ацетоне | растворим | ||
| • в хлороформе | растворим | ||
| Вращение | −50° | ||
| Классификация | |||
| Рег. номер CAS | 2216-51-5 | ||
| PubChem | 16666 | ||
| Рег. номер EINECS | 218-690-9 | ||
| SMILES | |||
| InChI | |||
| RTECS |
OT0350000, рацемат OT0700000, (−)-энантиомер |
||
| ChEBI | 15409 | ||
| ChemSpider | 15803 | ||
| Безопасность | |||
| Фразы риска (R) | R37/38, R41 | ||
| Фразы безопасности (S) | S26, S36 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Ментол (от лат. Mentha — мята) — органическое вещество, важный вторичный метаболит растений семейства яснотковые, получают синтетически или выделяют из мятного эфирного масла. Прозрачное кристаллическое вещество, при комнатной температуре легко плавится. Существует 8 изомеров с довольно близкими свойствами. Основной природный изомер (-)-ментол (1R,2S,5R) конфигурация. Обладает слабыми местноанестизирующими свойствами, стимулирует холодовые терморецепторы кожи и слизистых, слабый антисептик. Широко используется в пищевкусовой промышленности и в медицине. В частности, является основной составляющей рефлекторного сосудорасширяющего средства валидол.
История[править | править код]
Есть свидетельства[1], что ментол был известен в Японии более 2000 лет назад, но на Западе нет данных о его выделении до 1771 года (Gambius)[3]. (-)-Ментол (также называемый l-ментол или (1R,2S,5R)-ментол) выделен из эфирного масла мяты (вместе с примесью ментона, ментилацетата и др. соединений), он может быть получен и из др. видов — Mentha piperita L. Неочищенный японский ментол содержит небольшое количество 1-эпи, (+)-неоментола.
Структура молекулы[править | править код]
В природе чаще всего встречается один (1R,2S,5R)-энантиомер (см. внизу слева на рис.). Остальные 7 стереоизомеров:
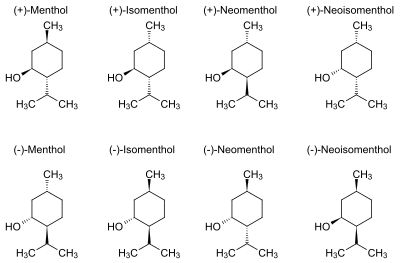
В соединениях природного происхождения изопропильная группа транс-ориентирована по отношению к метильной и спиртовой группе (см. рис.):

Все 3 объёмные группы в конформации «кресло» находятся в наиболее удалённых друг от друга экваториальных положениях, что делает (-)-ментол и его энантиомер — двумя наиболее стабильными изомерами из 8 возможных.
Существуют 2 кристаллические формы рацемического ментола с Тпл. 28 °C и 38 °C. Чистый (-)-ментол имеет 4 кристаллические формы, наиболее стабильна α форма.
Фармакология[править | править код]
Ментол является активатором TRPM8 холодового рецептора, а также TRPA1 потенциалзависимых ионных каналов, что обусловливает его анестезирующие свойства[1]. Действие ментола на TRPA1 отличается от такового на TRPM8. При низких концентрациях ментол активирует TRPA1, а при высоких – ингибирует[2]. Помимо этого ментол является аллостерическим модулятором ГАМК А рецепторов в том же α1β2γ2 сайте, в котором связывается анестетик пропофол. Однако активность ментола в 25 раз ниже по сравнению с пропофолом[3].

Применение[править | править код]
Ментол используется в фармацевтических препаратах безрецептурной группы, предназначенных для лечения простуды, ревматизма, для снятия мышечных болей от усталости и пр. В ряде средств для ухода за полостью рта и в косметических средствах применяют натуральный или синтетический ментол, или мятные эфирные масла, например, в средствах от кашля и в зубной пасте. Охлаждающее действие ментола на кожные рецепторы позволяет снизить раздражение и зуд, например, при аллергии. Ментол добавляют в сигареты для снижения раздражения, вызываемого дымом в лёгких. Добавка ментола в электронные сигареты вредна для лёгких[4].
В пищевой промышленности ментол и мятное масло используются в качестве ароматизаторов карамели, спиртных напитков, кондитерских изделий (пряники).
Используется для синтеза ментиловых эфиров, например, ментилацетат используется в парфюмерии для создания цветочной ноты (особенно в композициях для имитации розы).
В органической химии хиральность ментола применяют в стереоспецифичном (асимметричном) синтезе. Ментол используют в классической методике разделения хиральных карбоновых кислот через образование ментиловых эфиров.
Получение[править | править код]
В Викиучебнике имеется материал по теме Получение ментола
Выделение из природного сырья[править | править код]
Для выделения ментола из эфирного масла мяты перечной предварительно проводят щелочное омыление содержащихся в нём сложных эфиров, а затем переводят ментол в эфир борной кислоты. Летучие компоненты масла отгоняют в вакууме, а оставшийся борный эфир гидролизуют карбонатом натрия и отгоняют ментол с водяным паром. Эфирное масло содержит 50—70 % ментола[5].
Синтез[править | править код]
Количество натурального ментола существенно уступает потребностям пищевой и фармацевтической промышленности.
M. производят преимущественно в энантиомерночистом виде (94 % е. е.). Промышленный синтез включает в себя стадию асимметрического гидрирования, разработанную Рёдзи Ноёри с сотрудниками (Нобелевская премия по химии в 2001 году).
Рацемический Ментол может быть получен гидрированием тимола или пулегона. Для получения др. изомеров (неоментол и др.), см. Лит. 1.
Идентификация[править | править код]
Обнаружить ментол можно при помощи цветной реакции: водные растворы его с 1 % раствором ванилина и концентрированной серной кислотой дают желтую окраску, при добавлении воды переходящую в малиново-красную. Для идентификации по температуре плавления производных получают фенилуретан и α-нафтилуретан реакцией с избытком соответствующего изоцианата в петролейном эфире. Температура плавления фенилуретана (-)-ментола 112 °C, α-нафтилуретана (-)-ментола 120 °C[5].
Химические свойства[править | править код]
Многообразие реакций ментола обусловлено его строением вторичного спирта. Ментол окисляется до ментона хромовой кислотой, хотя при определённых условиях окисление может быть доведено до разрыва кольца. Ментол легко дегидратируется, преимущественно в 3-ментен под действием 2%-ной серной кислоты. PCl5 переводит ментол в ментилхлорид.
Примечания[править | править код]
- ↑ Boyi Liu, Lu Fan, Shrilatha Balakrishna, Aiwei Sui, John B. Morris, Sven-Eric Jordt. TRPM8 is the principal mediator of menthol-induced analgesia of acute and inflammatory pain (англ.) // PAIN. — 2013-10. — Т. 154, вып. 10. — С. 2169. — ISSN 0304-3959. — doi:10.1016/j.pain.2013.06.043. Архивировано 3 июня 2023 года.
- ↑ Joseph A. Farco, Oliver Grundmann. Menthol - Pharmacology of an Important Naturally Medicinal “Cool” // Mini Reviews in Medicinal Chemistry. — 2013-01-01. — Т. 13, вып. 1. — С. 124–131. — doi:10.2174/138955713804484686.
- ↑ Erin E. Watt, Brooke A. Betts, Francesca O. Kotey, Danielle J. Humbert, Theanne N. Griffith, Elizabeth W. Kelly, Kelley C. Veneskey, Nikhila Gill, Kathleen C. Rowan, Andrew Jenkins, Adam C. Hall. Menthol shares general anesthetic activity and sites of action on the GABAA receptor with the intravenous agent, propofol (англ.) // European Journal of Pharmacology. — 2008-08-20. — Vol. 590, iss. 1. — P. 120–126. — ISSN 0014-2999. — doi:10.1016/j.ejphar.2008.06.003.
- ↑ Electronic cigarette menthol flavoring is associated with increased inhaled micro and sub-micron particles and worse lung function in combustion cigarette smokers |... Дата обращения: 10 августа 2023. Архивировано 10 августа 2023 года.
- ↑ 1 2 Г. В. Лазурьевский, И. В. Терентьева, А. А. Шамшурин. Практические работы по химии природных соединений. Выпуск I. Методы выделения, разделения и идентификации. — М.: «Высшая школа», 1961. — С. 90—92.
Литература[править | править код]
- J. L. Simonsen, The Terpenes Volume I (2nd edition), Cambridge University Press, 1947, p. 230-249.
- E. E. Turner, M. M. Harris, Organic Chemistry, Longmans, Green & Co., London, 1952.
- Adversoriorum varii argumentii, Liber unus, Leiden, 1771, p. 99.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.


![{\displaystyle [\alpha ]_{D}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/429fc012b121ba581ec80c25ca5c4e5635452410)


