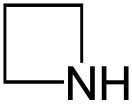
Азетидин
| Азетидин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
азетидин — предпочительное, также — азетан | ||
| Традиционные названия | азациклобутан, триметиленимин, 1,3-пропиленимин | ||
| Хим. формула | C3H7N | ||
| Физические свойства | |||
| Молярная масса | 57,09 г/моль | ||
| Плотность | 0,8436 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -83 °C | ||
| • кипения | 63 °C | ||
| Классификация | |||
| Рег. номер CAS | 503-29-7 | ||
| PubChem | 10422 | ||
| Рег. номер EINECS | 207-963-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30968 | ||
| ChemSpider | 9993 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Азетиди́н (1,3-пропиленими́н, азета́н, азациклобута́н, триметиленими́н, 1,3-пропиленимин) — насыщенный четырёхчленный гетероцикл с одним атомом азота.
При нормальных условиях — легкокипящая жидкость с аммиачным запахом, смешивается с водой и спиртами.
Методы синтеза
[править | править код]Из монопропаноламина и этилакрилата[1].
Из 1,3-дибромпропана и тозиламида[2].
Из 1,3-диаминпропана под действием соляной кислоты[3]:
Реакционная способность
[править | править код]Азетидин проявляет типичные для алифатических аминов свойства: является сильным основанием (рКа 11,29 при 25°С), алкилируется, ацилируется и нитруется по атому азота, реагирует с сероуглеродом с образованием дитиокарбамата:
- .
Вместе с тем, из-за напряжённости четырёхчленного кольца, при действии нуклеофилов для азетидина характерны реакции с раскрытием цикла. Так, под действием галогеноводородов он образует соответствующие γ-галогенпропиламины, а в кислой среде присоединяет воду с образованием γ-аминопропанола:
- ,
- — галоген или гидроксильная группа .
Азетидиновое кольцо может быть раскрыто другими нуклеофилами. В результате этой реакции возможен синтез веществ с амногруппами на концах молекулы. Например, реакция этилендиамина с азетидином на палладиевом катализатор с раскрытием цикла с получением триамина[4].
При взаимодействии азетидина с перекисью водорода образуются акролеин и аммиак:
- .
Биологическое значение производных
[править | править код]
2 — цефалоспорины.
β-лактамное кольцо выделено красным
Азетидин и его производные редко встречаются в природных биохимических соединениях. Наиболее часто в организмах находится азетидин-2-карбоновая кислота — ядовитый аналог аминокислоты пролина, содержащаяся в существенной концентрации в корнях и листьях некоторых растений семейства спаржевых, например, в майском ландыше, чем в основном и обусловлены ядовитые свойства этих растений, особенно для животных семейства кошачьих. Следы азетидин-2-карбоновой кислоты также находятся в сахарной свёкле и в столовой свёкле[5].
2-Оксоазетидиновый фрагмент (β-лактамный цикл) входит в состав β-лактамных антибиотиков — пенициллинов, цефалоспоринов, карбапенемов и монобактамов.
Примечания
[править | править код]- ↑ Organic Syntheses, Coll. Vol. 6, p. 75, 1988 (Online (недоступная ссылка))
- ↑ 1 2 Химия. Справочное руководство. Пер. с нем. Л., Химия 1975, с. 359.
- ↑ Ladenburg, Sieber in: Chem. Ber. 1890, 23, 2727.
- ↑ S.-I. Murahashi, N. Yoshimura, T. Tsumiyama, T. Kojima in: J. Am. Chem. Soc. 1983, 105, 15, 5002-5011.
- ↑ Seigler, David S. Plant secondary metabolism (англ.). — Kluwer Academic, 1998. — P. 222. — ISBN 0-412-01981-7.
Ссылки
[править | править код]- Pubchem Архивная копия от 1 марта 2014 на Wayback Machine
- ChemSynthesis Архивная копия от 26 октября 2020 на Wayback Machine
Литература
[править | править код]Cromwell N. H., Phillips В. "Chem. Rev.", 1979, v. 79, № 4, p. 332; Comprehensive heterocyclic chemistry, pt. 5, v. 8, L., 1984, p. 238.