Опиоидные рецепторы

Опио́идные реце́пторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G-белком.[1][2][3] Основная их функция в организме — регулирование болевых ощущений. В настоящее время различают четыре основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептиновые (ORL1) рецепторы. Они связываются как с эндогенными (вырабатываемые в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах.
История
[править | править код]К середине 1960-х годов, анализируя результаты фармакологических исследований, учёные стали предполагать, что опиоиды, вероятно, действуют на специфические рецепторы.[4] Рецепторы были впервые определены как специфические молекулы при проведении исследований, в которых было обнаружено, что опиаты, меченные радиоизотопами, связываются с субклеточными фракциями головного мозга. Первое такое исследование было опубликовано в 1971 году с использованием 3H-леворфанола и его антагониста налоксона.[5] В 1973 году Кэндис Перт[англ.] и Соломон Снайдер опубликовали результаты первого подробного радиоизотопного исследования опиоидных рецепторов с использованием 3H-налоксона.[6] Это исследование было признано как первое точное обнаружение опиоидных рецепторов, хотя вскоре после него в этом же году были проведены два других подобных исследования.[7][8] В 1976 году Мартин и коллеги по результатам исследований in vivo на собаках пришли к выводам о существовании нескольких типов опиоидных рецепторов.[9] Для подтверждения их существования предпринимались попытки выделения очищенного белка опиоидных рецепторов,[10][11] но они были безуспешными.[12] В начале 1990-х годов в молекулярно-биологических исследованиях выяснили структуру и механизм действия опиоидных рецепторов. Четыре различные кДНК были выделены как представители семейства опиоидных рецепторов.[13] Три из них соответствуют µ-, δ- и κ-рецепторам, а четвёртая — новому типу рецепторов — ноцицептивным или ORL-1 (англ. opioid-receptor-like 1), который отнесён также к опиоидным, хотя он не обладает высоким сродством с опиоидными лигандами.[14]:198
Механизм действия
[править | править код]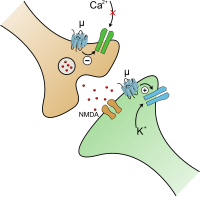
При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника цАМФ (cAMP), а также осуществляется регулирование ионных каналов. Закрытие потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам[15][16].
Виды опиоидных рецепторов
[править | править код]В настоящее время различают четыре основные группы опиоидных рецепторов, каждая из которых подразделяется ещё на несколько подтипов:[17]
| Рецептор | Подтип | Расположение [18][19] | Функция [18][19] |
|---|---|---|---|
| мю (μ) MOP |
μ1, μ2, μ3 |
|
μ1:
μ2:
μ3:
|
| дельта (δ) DOP |
δ1, δ2 |
|
|
| каппа (κ) KOP |
κ1, κ2, κ3 |
|
|
| Ноцицептиновый рецептор NOP (ORL1) |
- |
|
|
Эффект анальгезии наблюдается при стимуляции μ-, δ- и κ-рецепторов. Агонисты μ-рецепторов, кроме того, вызывают угнетение дыхания и седативный эффект, а агонисты κ-рецепторов — психотомиметические эффекты. Действие большинства опиоидных анальгетиков связано со стимуляцией рецепторов μ-типа[20].
Номенклатура
[править | править код]Опиоидные рецепторы были названы по первой букве лиганда, с которым впервые обнаружена их связь. Так, морфин был первым веществом, у которого была обнаружена способность связываться с μ-рецепторами, а κ-рецепторы названы в честь обнаружения их связывания с кетоциклазоцином.[21] Также рецептор с высоким сродством к энкефалинам был обнаружен в семявыносящих протоках мышей и назван δ-рецептором.[22] Позднее другой опиоидный рецептор был обнаружен и клонирован на основе гомологичности с кДНК. Этот рецептор известен как ноцицептиновый рецептор или ORL 1-рецептор.
Предположено существование отдельных подтипов опиоидных рецепторов в тканях человека, однако исследователям пока не удалось получить генетических или молекулярных доказательств их существования и считают, что они возникают в результате посттрансляционной модификации клонированных типов рецепторов или димеризации.[23]
Подкомитет IUPHAR[англ.] допускает применение общепринятой греческой классификации, но рекомендует 3 классических рецептора (μ-, δ-, κ-) и ноцицептиновый рецептор обозначать как MOP, DOP, KOP и NOP соответственно.[24][25]
Лиганды
[править | править код]Эндогенные
[править | править код]Эндогенные опиоидные пептиды вырабатываются в самом организме и реализуют свои опиоидные эффекты. Обнаружение опиоидных рецепторов привело к открытию их эндогенных лигандов. Вначале были обнаружены три семейства опиоидных пептидов (эндорфины, энкефалины и динорфины) в различных областях ЦНС, желудочно-кишечном тракте и других периферических тканях.[14]:200 Позднее были обнаружены ноцицептины, эндоморфины и другие опиоидные пептиды.[14]:200 При этом эндорфины, эндоморфины проявляют максимальное сродство к рецепторам типа μ, энкефалины — типа δ, динорфины — типа κ[20][26]:194
Экзогенные
[править | править код]Экзогенные опиоиды поступают в организм извне и связываются с опиоидными рецепторами. Первым открытым опиоидом был морфин, алкалоид опийного мака, выделенный Фридрихом Сертюрнером из опиума в 1804 г.[27] В настоящее время известно большое количество соединений (как производных морфина, так и веществ другой структуры), являющихся лигандами к опиоидным рецепторам. По происхождению различают естественные, синтетические и полусинтетические опиоиды.[12] Многие из них используются в медицине в качестве анальгетиков и средств против кашля.
Агонисты μ-опиоидных рецепторов обладают большим потенциалом злоупотребления, в краткосрочном периоде вызывая эйфорию, а при систематическом употреблении — сильную физическую и психическую зависимость. По этой причине оборот опиоидов в большинстве стран контролируется.
Некоторые экзогенные лиганды и их сродство к различным типам опиоидных рецепторов[28][29]:
| Вещество | Сродство к рецепторам | ||
|---|---|---|---|
| μ | δ | κ | |
| Морфин | + + | + | + |
| Героин*, Метадон, Фентанил | + + | ||
| Сальвинорин А | + | ||
| Кодеин, Оксикодон, Гидрокодон, Декстропропоксифен | ± | ||
| Буторфанол | − − | + + | |
| Пентазоцин | ± | + | |
| Бупренорфин | ± | − − | − − |
| Налорфин | − | + | |
| Нальбуфин | − − | + + | |
| Налоксон и Налтрексон | − − | − | − |
| Обозначения: ++: сильный агонист, +: агонист, ±: частичный агонист, −: антагонист, − −: сильный антагонист. | |||
*Сам героин обладает довольно слабым сродством к μ-рецепторам, но легко проникает через гемато-энцефалический барьер, где преобразуется в 6-моноацетилморфин — мощный агонист μ-рецепторов[30].
Другие рецепторы
[править | править код]σ-рецепторы ранее относили к опиоидным, так как считали, что противокашлевой эффект многих опиоидов реализуется через действие на эти рецепторы, а также первые селективные σ-агонисты были производными опиоидов (например, аллилнорметазоцин). Однако было обнаружено, что σ-рецепторы не активируются эндогенными опиоидными пептидами и сильно отличаются от других опиоидных рецепторов как по функции, так и по генетической структуре. Также они показали высокую чувствительность к фенциклидину и кетамину, которые являются специфическими антагонистами комплексу глутамат-N-метил-D-аспартат.[14]:198 Кроме того, они не подвергаются реверсии налоксоном и обладают стереоселективностью к правовращающим изомерам, а опиоидные рецепторы избирательны к левовращающим изомерам.[31]:125
Также предполагают существование других опиоидных рецепторов в связи с обнаружением эффектов эндогенных опиоидных пептидов, не опосредованных одним из четырёх известных опиоидных рецепторов.[32][33][34] Только один из таких рецепторов был обнаружен и назван дзета (ζ-) опиоидным рецептором, который проявил себя как модулятор фактора роста клеток при действии его эндогенного лиганда — мет-энкефалина. Этот рецептор в настоящее время чаще обозначают как опиоидный рецептор фактора роста (OGFr).[35][36]
Предполагают существование эпсилон (ε-) опиоидного рецептора. Такое предположение появилось после того, как у бета-эндорфина были обнаружены эффекты, которые не опосредованы каким-либо известным опиоидным рецептором.[37][38] Активация ε-рецептора вызывает выраженное обезболивание и выброс мет-энкефалина и было обнаружено, что ряд широко используемых опиоидных агонистов, таких как μ-агонист эторфин и κ-агонист бремазоцин, действуют как агонисты этих эффектов (даже в присутствии антагонистов к их более известным мишеням),[39] а бупренорфин действует как антагонист этого рецептора. В настоящее время доступны несколько селективных агонистов и антагонистов предполагаемых ε-рецепторов,[40][41] однако попытки обнаружить ген этих рецепторов были безуспешны.
Патология
[править | править код]Мутация A118G (замена аденина на гуанин в экзоне 1), которая приводит к замещению аспарагина в позиции 40 на аспартат (N40D) — наиболее частая мутация, приводящая к изменению генного продукта µ-опиоидного рецептора человека. Предполагают, что пациентам с онкологическими заболеваниями, гомозиготным по варианту A118G, требуется более высокая доза морфина при длительном лечении болевого синдрома.[42] Также внутривенное введение морфина, контролируемое пациентом, после тотальной гистерэктомии было значительно больше у женщин, гомозиготных по варианту A118G, чем у других пациенток.[43] Некоторые формы мутаций δ-опиоидных рецепторов приводят к постоянной активации рецептора.[44]
Примечания
[править | править код]- ↑ Dhawan B. N., Cesselin F., Raghubir R., Reisine T., Bradley P. B., Portoghese P. S., Hamon M. International Union of Pharmacology. XII. Classification of opioid receptors (англ.) // Pharmacol. Rev.[англ.] : journal. — 1996. — December (vol. 48, no. 4). — P. 567—592. — PMID 8981566.
- ↑ Janecka A., Fichna J., Janecki T. Opioid receptors and their ligands (англ.) // Curr Top Med Chem[англ.] : journal. — 2004. — Vol. 4, no. 1. — P. 1—17. — PMID 14754373.
- ↑ Waldhoer M., Bartlett S. E., Whistler J. L. Opioid receptors (англ.) // Annu. Rev. Biochem.[англ.] : journal. — 2004. — Vol. 73. — P. 953—990. — doi:10.1146/annurev.biochem.73.011303.073940. — PMID 15189164.
- ↑ Martin W. R. Opioid antagonists (англ.) // Pharmacol. Rev.[англ.] : journal. — 1967. — December (vol. 19, no. 4). — P. 463—521. — PMID 4867058.
- ↑ Goldstein A., Lowney L. I., Pal B. K. Stereospecific and nonspecific interactions of the morphine congener levorphanol in subcellular fractions of mouse brain (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1971. — August (vol. 68, no. 8). — P. 1742—1747. — doi:10.1073/pnas.68.8.1742. — PMID 5288759. — PMC 389284.
- ↑ Pert C. B., Snyder S. H. Opiate receptor: demonstration in nervous tissue (англ.) // Science : journal. — 1973. — March (vol. 179, no. 77). — P. 1011—1014. — doi:10.1126/science.179.4077.1011. — PMID 4687585.
- ↑ Terenius L. Stereospecific interaction between narcotic analgesics and a synaptic plasm a membrane fraction of rat cerebral cortex (англ.) // Acta Pharmacol. Toxicol. (Copenh.) : journal. — 1973. — Vol. 32, no. 3. — P. 317—320. — PMID 4801733.
- ↑ Simon E. J., Hiller J. M., Edelman I. Stereospecific binding of the potent narcotic analgesic (3H) Etorphine to rat-brain homogenate (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1973. — July (vol. 70, no. 7). — P. 1947—1949. — doi:10.1073/pnas.70.7.1947. — PMID 4516196. — PMC 433639.
- ↑ Bjorn Knollmann; Laurence Brunton; Chabner, Bruce. Goodman and Gilman's Pharmacological Basis of Therapeutics, Twelfth Edition (SET2) (Pharmacologic Basis of Therapeutics (Goodman & Gilman)) Chapter 21. Opioid Analgesics (англ.). — McGraw-Hill Education, 2010. — ISBN 0-07-162442-2.
- ↑ Caruso T. P., AE Takemori, DL Larson, PS Portoghese. Chloroxymorphamine, an opioid receptor site-directed alkylating agent having narcotic agonist activity (англ.) // Science : journal. — 1979. — April (vol. 204, no. 4390). — P. 316—318. — doi:10.1126/science.86208. — PMID 86208.
- ↑ Caruso T. P., DL Larson, PS Portoghese, AE Takemori. Isolation of selective 3H-chlornaltrexamine-bound complexes, possible opioid receptor components in brains of mice (англ.) // Life Sciences : journal. — 1980. — December (vol. 27, no. 22). — P. 2063—2069. — doi:10.1016/0024-3205(80)90485-3. — PMID 6259471. Архивировано 8 сентября 2017 года.
- ↑ 1 2 Ronald D. Miller MD, Lars I. Eriksson, Lee A. Fleisher MD, Jeanine P. Wiener-Kronish MD, William L. Young. Miller's Anesthesia. Глава "Opioids". — Churchill Livingstone, 2009. — 3312 с. — ISBN 978-0443069598.
- ↑ Minami M., Satoh M. Molecular biology of the opioid receptors: structures, functions and distributions (англ.) // Neurosci. Res. : journal. — 1995. — September (vol. 23, no. 2). — P. 121—145. — PMID 8532211.
- ↑ 1 2 3 4 Norton Williams; Norman Calvey. Principles and Practice of Pharmacology for Anaesthetists. — Wiley-Blackwell, 2008. — 357 с. — ISBN 978-0632056057.
- ↑ Alan F. Schatzberg,Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — С. 32. — 1648 с. — ISBN 9781585623099.
- ↑ Bertram G. Katzung. Basic & clinical pharmacology. 10th edition. — McGraw-Hill Medical, 2007. — С. 492. — 1200 с. — ISBN 0071604057.
- ↑ Corbett A. D., Henderson G., McKnight A. T., Paterson S. J. 75 years of opioid research: the exciting but vain quest for the Holy Grail (англ.) // Br. J. Pharmacol.[англ.] : journal. — 2006. — Vol. 147 Suppl 1. — P. S153—62. — doi:10.1038/sj.bjp.0706435. — PMID 16402099. — PMC 1760732.
- ↑ 1 2 Stein C, Schäfer M, Machelska H (2003) Attacking pain at its source: new perspectives on opioids. Nature Med;9(8):1003-1008. doi:10.1038/nm908.
- ↑ 1 2 Fine, Perry G.; Russell K. Portenoy. Chapter 2: The Endogenous Opioid System // A Clinical Guide to Opioid Analgesia (неопр.). — McGraw-Hill Education, 2004.
- ↑ 1 2 Bertram G. Katzung. Basic & clinical pharmacology. 10th edition. — McGraw-Hill Medical, 2007. — С. 489—490. — 1200 с. — ISBN 0071604057.
- ↑ Anil Aggrawal. Opium: the king of narcotics. BLTC Research (1 мая 1995). Дата обращения: 21 марта 2008. Архивировано 10 апреля 2012 года.
- ↑ Lord JA, Waterfield AA, Hughes J, Kosterlitz HW. Nature. 1977; 267:495-499.
- ↑ Lemke, Thomas L.; Williams, David H.; Foye, William O. Opioid Analgesics; Fries, DS // Foye's principles of medicinal chemistry (неопр.). — Hagerstown, MD: Lippincott Williams & Wilkins[англ.], 2002. — ISBN 0-683-30737-1.
- ↑ Girdlestone, D. Opioid receptors; Cox BM, Chavkin C, Christie MJ, Civelli O, Evans C, Hamon MD, et al. // The IUPHAR Compendium of Receptor Characterization and Classification (англ.). — 2nd. — London: IUPHAR Media, 2000. — P. 321—333.
- ↑ «Opioid receptors». IUPHAR Database. International Union of Pharmacology (2008-08-01). Дата обращения: 25 марта 2011. Архивировано 3 марта 2016 года.
- ↑ Харкевич Д.А. Фармакология. — Москва: ГЭОТАР-Медиа, 2006. — 736 с. — ISBN 5-9704-0264-8.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 313. — 414 с. — ISBN 978-3-906390-24-6.
- ↑ Bertram G. Katzung. Basic & clinical pharmacology. 11th edition. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057.
- ↑ Brian E. Leonard. Fundamentals of psychopharmacology. 3rd ed. — Wiley, 2003. — С. 393. — 527 с. — ISBN 0471521787.
- ↑ David A. Williams, William O. Foye, Thomas L. Lemke. Foye's principles of medicinal chemistry. — Lippincott, 2002. — С. 463. — 1114 с. — ISBN 0683307374.
- ↑ Бунятян, Мизиков. Рациональная фармакоанестезиология. — Москва: Литтерра, 2003. — 795 с. — 7000 экз. — ISBN 5-98216-040-7.
- ↑ Grevel J., Yu V., Sadée W. Characterization of a labile naloxone binding site (lambda site) in rat brain (англ.) // J. Neurochem.[англ.] : journal. — 1985. — May (vol. 44, no. 5). — P. 1647—1656. — doi:10.1111/j.1471-4159.1985.tb08808.x. — PMID 2985759.
- ↑ Mizoguchi H., Narita M., Nagase H., Tseng L. F. Activation of G-proteins in the mouse pons/medulla by beta-endorphin is mediated by the stimulation of mu- and putative epsilon-receptors (англ.) // Life Sci.[англ.] : journal. — 2000. — October (vol. 67, no. 22). — P. 2733—2743. — doi:10.1016/S0024-3205(00)00852-3. — PMID 11105989.
- ↑ Wollemann M., Benyhe S. Non-opioid actions of opioid peptides (англ.) // Life Sci.[англ.] : journal. — 2004. — June (vol. 75, no. 3). — P. 257—270. — doi:10.1016/j.lfs.2003.12.005. — PMID 15135648.
- ↑ Zagon I. S., Verderame M. F., Allen S. S., McLaughlin P. J. Cloning, sequencing, chromosomal location, and function of cDNAs encoding an opioid growth factor receptor (OGFr) in humans (англ.) // Brain Res.[англ.] : journal. — 2000. — February (vol. 856, no. 1—2). — P. 75—83. — doi:10.1016/S0006-8993(99)02330-6. — PMID 10677613.
- ↑ Zagon I. S., Verderame M. F., McLaughlin P. J. The biology of the opioid growth factor receptor (OGFr) (англ.) // Brain Res. Brain Res. Rev.[англ.] : journal. — 2002. — February (vol. 38, no. 3). — P. 351—376. — doi:10.1016/S0165-0173(01)00160-6. — PMID 11890982.
- ↑ Wüster M., Schulz R., Herz A. Specificity of opioids towards the mu-, delta- and epsilon-opiate receptors (англ.) // Neurosci. Lett.[англ.] : journal. — 1979. — December (vol. 15, no. 2—3). — P. 193—198. — doi:10.1016/0304-3940(79)96112-3. — PMID 231238.
- ↑ Schulz R., Wüster M., Herz A. Pharmacological characterization of the epsilon-opiate receptor (англ.) // J. Pharmacol. Exp. Ther.[англ.] : journal. — 1981. — March (vol. 216, no. 3). — P. 604—606. — PMID 6259326.
- ↑ Narita M., Tseng L. F. Evidence for the existence of the beta-endorphin-sensitive "epsilon-opioid receptor" in the brain: the mechanisms of epsilon-mediated antinociception (англ.) // Jpn. J. Pharmacol. : journal. — 1998. — March (vol. 76, no. 3). — P. 233—253. — doi:10.1254/jjp.76.233. — PMID 9593217.
- ↑ Fujii H., Narita M., Mizoguchi H., Murachi M., Tanaka T., Kawai K., Tseng L. F., Nagase H. Drug design and synthesis of epsilon opioid receptor agonist: 17-(cyclopropylmethyl)-4,5alpha-epoxy-3,6beta-dihydroxy-6,14-endoethenomorphinan-7alpha-(N-methyl-N-phenethyl)carboxamide (TAN-821) inducing antinociception mediated by putative epsilon opioid receptor (англ.) // Bioorg. Med. Chem.[англ.] : journal. — 2004. — August (vol. 12, no. 15). — P. 4133—4145. — doi:10.1016/j.bmc.2004.05.024. — PMID 15246090.
- ↑ Fujii H., Nagase H. Rational drug design of selective epsilon opioid receptor agonist TAN-821 and antagonist TAN-1014 (англ.) // Curr. Med. Chem.[англ.] : journal. — 2006. — Vol. 13, no. 10. — P. 1109—1118. — doi:10.2174/092986706776360851. — PMID 16719773.
- ↑ Klepstad P., Rakvåg T. T., Kaasa S., et al. The 118 A > G polymorphism in the human mu-opioid receptor gene may increase morphine requirements in patients with pain caused by malignant disease (англ.) // Acta Anaesthesiol Scand[англ.] : journal. — 2004. — November (vol. 48, no. 10). — P. 1232—1239. — doi:10.1111/j.1399-6576.2004.00517.x. — PMID 15504181.
- ↑ Chou W. Y., Wang C. H., Liu P. H., Liu C. C., Tseng C. C., Jawan B. Human opioid receptor A118G polymorphism affects intravenous patient-controlled analgesia morphine consumption after total abdominal hysterectomy (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2006. — August (vol. 105, no. 2). — P. 334—337. — PMID 16871067.
- ↑ Befort K., Zilliox C., Filliol D., Yue S., Kieffer B. L. Constitutive activation of the delta opioid receptor by mutations in transmembrane domains III and VII (англ.) // J. Biol. Chem. : journal. — 1999. — June (vol. 274, no. 26). — P. 18574—18581. — doi:10.1074/jbc.274.26.18574. — PMID 10373467.
Литература
[править | править код]- Alan F. Schatzberg,Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — 1648 с. — ISBN 9781585623099.
- Bertram G. Katzung. Basic & clinical pharmacology. — McGraw-Hill Medical, 2009. — 1200 с. — ISBN 0071604057. (недоступная ссылка)
- Brian E. Leonard. Fundamentals of psychopharmacology. 3rd ed. — Wiley, 2003. — 527 с. — ISBN 0471521787.