Графит
| Графит | |
|---|---|
 | |
| Формула | C (углерод) |
| Статус IMA | унаследованный минерал[2] |
| Физические свойства | |
| Цвет | Серый, чёрный стальной |
| Цвет черты | Чёрная |
| Блеск | Металловидный |
| Прозрачность | Непрозрачный |
| Твёрдость | 1–2 |
| Спайность | Весьма совершенная по (0001)[1] |
| Плотность | 2,09–2,23 г/см³ |
| Кристаллографические свойства | |
| Сингония | Гексагональная[1] |
| Графит |
|---|
| Фазы железоуглеродистых сплавов |
|
| Структуры железоуглеродистых сплавов |
|
| Стали |
| Чугуны |
|
Графи́т (от др.-греч. γράφω «записывать, писать») — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический). Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые. Образует листоватые и округлые радиально-лучистые агрегаты, реже — агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто треугольная штриховка на плоскостях (0001). Природный графит имеет разновидности: плотнокристаллический (жильный), кристаллический (чешуйчатый), скрытокристаллический (аморфный, микрокристаллический) и различается по размерам кристаллов.
История
[править | править код]Графит известен с древних времён, однако точных сведений об истории его использования получить не удаётся из-за сходства красящих свойств с другими минералами, например, молибденитом. Одним из наиболее ранних свидетельств применения графита является глиняная посуда культуры Боян-Марица (4000 лет до н. э.), раскрашенная с помощью этого минерала[3]. Название «графит» предложено в 1789 году Абраамом Вернером, встречаются также названия «чёрный свинец» (англ. black lead), «карбидное железо», «серебристый свинец»[4].
Физические свойства
[править | править код]Хорошо проводит электрический ток. Обладает низкой твёрдостью (1 по шкале Мооса). Относительно мягкий. После воздействия высоких температур становится немного более твёрдым и очень хрупким. Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и оксидов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Теплопроводность графита от 100 до 354,1 Вт/(м·К), зависит от марки графита, от направления относительно базисных плоскостей и от температуры[5].
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше. Минимальное значение проводимости наблюдается в интервале 300—1300 К, причём положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Теплоёмкость графита в диапазоне температур 300÷3000 К хорошо согласуется с дебаевской моделью[6]. В высокотемпературной области после Т>3500K наблюдается аномальное поведение теплоёмкости графита аналогично алмазу: экспериментальные данные по теплоёмкости резко отклоняются вверх от нормальной (дебаевской) кривой и аппроксимируются экспоненциальной функцией[7][8][9], что обуславливается больцмановской компонентой поглощения тепла кристаллической решеткой[10].
Пределы температуры плавления — 3845—3890 °C, кипение начинается при 4200 °C[источник не указан 1970 дней]. Во время сжигания 1 кг графита выделяется 7832 ккал тепла.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициент Холла меняется с положительного на отрицательный при 2400 К.
Химические свойства
[править | править код]Со многими веществами (щелочными металлами, солями) образует соединения включения.
Реагирует при высокой температуре с кислородом, сгорая до углекислого газа. Фторированием в контролируемых условиях можно получить (CF)x.
В неокисляющих кислотах не растворяется.
Структура
[править | править код]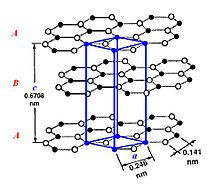

Каждый атом углерода ковалентно связан с тремя другими окружающими его атомами углерода.
Различают две модификации графита: α-графит (гексагональный P63/mmc) и β-графит (ромбоэдрический R(-3)m). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако, в природных графитах содержание ромбоэдрической фазы может достигать 30 %. При температуре 2500—3300 К ромбоэдрический графит полностью переходит в гексагональный.
Условия нахождения в природе
[править | править код]Сопутствующие минералы: биотит, волластонит, диопсид, каолин, кварц, ортоклаз, скаполит, шпинель[1]. Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн, Курейское месторождение скрытокристаллического (аморфного) графита, Ногинское месторождение (в настоящее время не разрабатывается). Акцессорный минерал метеоритов.
Применение
[править | править код]
Использование графита основано на ряде его уникальных свойств.
- для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов.
- электродов, нагревательных элементов — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
- Для получения химически активных металлов методом электролиза расплавленных соединений. В частности, при получении алюминия используются сразу два свойства графита:
- Хорошая электропроводность, и как следствие — его пригодность для изготовления электрода
- Газообразность продукта реакции, протекающей на электроде — это углекислый газ. Газообразность продукта означает, что он выходит из электролизёра сам, и не требует специальных мер по его удалению из зоны реакции. Это свойство существенно упрощает технологию производства алюминия.
- твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках.
- наполнитель пластмасс.
- замедлитель нейтронов в ядерных реакторах.
- компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином).
- для получения синтетических алмазов.
- в качестве эталона длины нанометрового диапазона для калибровки сканеров сканирующего туннельного микроскопа и атомно-силового микроскопа[11][12].
- для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов, а также прочих устройств, где требуется надёжный подвижный электрический контакт (см. коллектор, щетки).
- для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических аппаратов.
- как токопроводящий компонент высокоомных токопроводящих клеёв.
Добыча и переработка
[править | править код]Крупнейшим в мире производителем и поставщиком графита является Китай; в стране также находятся самые большие перерабатывающие этот материал предприятия, без которых пока не может существовать мировая отрасль электротранспорта (применяется для создания современных аккумуляторов для них)[13]
Товарные сорта графита получают обогащением графитовых руд.
В зависимости от степени очистки графитовые концентраты классифицируют на промышленные марки по областям применения, каждая из которых выдвигает специфические требования к физико-химическим и технологическим свойствам графитов.
Переработкой графита получают различные марки графита и изделия из них.
Переработка графита в терморасширенный графит
[править | править код]На первом этапе исходный кристаллический графит окисляют. Окисление сводится к внедрению молекул и ионов серной или азотной кислоты в присутствии окислителя (пероксид водорода, перманганат калия, бихромат калия и др.) между слоями кристаллической решетки графита. Окисленный графит отмывают и сушат, и далее подвергают термообработке до Т = 1000 °C со скоростью 400—600 °C/с. Благодаря чрезвычайно высокой скорости нагрева происходит резкое выделение из кристаллической решетки графита газообразных продуктов разложения внедренной серной кислоты и кислородсодержаших фрагментов, возникших в структуре окисленного графита вследствие окисления . Газообразные продукты создают большое (до 300—400 атм) расклинивающее давление в межкристаллитном пространстве, при этом образуется терморасширенный графит, отличающийся высокой удельной поверхностью и низкой насыпной плотностью. В полученном материале остается некоторое количество серы при применении сернокислой технологии. Далее полученный терморасширенный графит прокатывают, иногда армируют, добавляют присадки и прессуют для получения изделий.
Переработка графита для получения различных марок искусственного графита
[править | править код]Для производства искусственного графита используют в основном нефтяной кокс как наполнитель и каменноугольный пек как связующее. Для конструкционных марок графита в качестве добавок к наполнителю применяют природный графит и сажу. Вместо каменноугольного пека как связующего или пропитывающего вещества используют некоторые синтетические смолы, например, фурановые или фенольные.
Производство искусственного графита складывается из следующих основных технологических этапов:
- подготовки кокса к производству (предварительного дробления, прокаливания, размола и рассева кокса по фракциям);
- подготовки связующего;
- приготовления углеродной массы (дозировки и смешивания кокса со связующим);
- формования так называемых «зелёных» (необожжённых) заготовок в глухую матрицу или через мундштук прошивного пресса;
- обжига заготовок;
- графитации заготовок;
- механической обработки заготовок до размеров изделий.
Кокс дробят до кусков размером 30—40 мм, затем прокаливают в специальных прокалочных печах при 1300 °C. При прокаливании достигается термическая стабильность кокса, уменьшается содержание в нём летучих веществ, увеличиваются его плотность, электро- и теплопроводность. После прокаливания кокс размалывают до необходимой крупности. Порошки кокса дозируют и смешивают с пеком в смесильных машинах при 90—130 °C.
В смесильную машину вначале загружают сухие компоненты, а затем добавляют жидкий пек. После смешивания массу равномерно охлаждают до температуры прессования (80—100 °C). Заготовки прессуют или методом выдавливания массы через мундштук, или в пресс-форме. При прессовании холодных порошков изменяют технологию подготовки помола и смешения.
Для карбонизации связующего и скрепления отдельных зёрен в монолитный материал заготовки обжигают в многокамерных газовых печах при температуре 800—1200 °C. Продолжительность цикла обжига (нагрев и охлаждение) составляет 3—5 недель в зависимости от размера и плотности заготовок. Графитация — окончательная термическая обработка — превращает углеродный материал в графит. Графитацию проводят в печах сопротивления Ачесона или в печах прямого нагрева Кастнера при температурах 2400—3000 °C. При графитировании углеродистых нефтяных заготовок идет процесс укрупнения кристаллов углерода. Из мелкокристаллического «аморфного» углерода получается крупнокристаллический графит, атомная решетка которого ничем не отличается от атомной решетки природного графита.
Некоторые изменения технологического процесса получения искусственного графита зависят от требуемых свойств конечного материала. Так, для получения более плотного материала углеродные заготовки пропитывают (после обжига) в автоклавах один или несколько раз пеком с последующим обжигом после каждой пропитки и графитацией в конце всего технологического процесса. Для получения особо чистых материалов графитацию проводят одновременно с газовой очисткой в атмосфере хлора.
Переработка графита для получения композиционных материалов
[править | править код]Антифрикционные углеродные материалы изготавливают следующих марок: обожженный антифрикционный материал марки АО, графитированный антифрикционный материал марки АГ, антифрикционные материалы, пропитанные баббитом, оловом и свинцом марок АО-1500Б83, АО 1500СО5, АГ-1500Б83, АГ-1500СО5, Нигран, Химанит и графитопластовые материалы марок АФГМ, АФГ-80ВС, 7В-2А, КВ, КМ, АМС.
Антифрикционные углеродные материалы изготавливают из непрокаленного нефтяного кокса, каменноугольного пека с добавкой природного графита. Для получения плотного непроницаемого антифрикционного материала применяют пропитку его металлами. Таким методом получают антифрикционные материалы марок АГ-1500 83, АГ-1500СО5 АМГ-600Б83, АМГ-600СО5 и им подобные. Допустимая рабочая температура на воздухе и в газовых средах, содержащих кислород для АО — 250—300 °C, для АГ — 300 °C (в восстановительных и нейтральных средах 1500 и 2500 °C соответственно). Углеродные антифрикционные материалы химически стойки во многих агрессивных газовых и жидких средах. Они стойки почти во всех кислотах (до температуры кипения кислоты), в растворах солей, во всех органических растворителях и ограниченно стойки в концентрированных растворах едких щелочей[3].
Графит как золотосодержащее сырьё
[править | править код]Существует мнение[14], что графитсодержащие руды могут обладать высоким содержанием золота. По даннымм ионной масс-спектрометрии, атомно-абсорбционной спектроскопии, содержание золота в графитовых рудах может достигать 5—30 г/т[15], что сопоставимо с содержанием золота в руде богатых месторождений. При этом, согласно данным других методов химического анализа, содержания золота в графитовой руде находится на крайне низком уровне 0,021-3,57 г/т[14].
Синтетические графиты
[править | править код]Искусственный графит получают разными способами:
- Ачесоновский графит: нагреванием смеси кокса и пека до 2800 °C;
- Рекристаллизованный графит: термомеханической обработкой смеси, содержащей кокс, пек, природный графит и карбидообразующие элементы.
- Пиролитический графит: пиролизом из газообразных углеводородов при температуре 1400—1500 °C в вакууме с последующим нагреванием образовавшегося пироуглерода до температуры 2500—3000 °C при давлении 50 МПа (образовавшийся продукт — пирографит; в электротехнической промышленности применяется наименование «электрографит»).
- Доменный графит: выделяется при медленном охлаждении больших масс чугуна.
- Карбидный графит: образуется при термическом разложении карбидов.
Примечания
[править | править код]- ↑ 1 2 3 Смольянинов, 1972.
- ↑ Nickel E. H., Nichols M. C. IMA/CNMNC List of Mineral Names (March 2007) — 2007.
- ↑ 1 2 Архивированная копия. Дата обращения: 16 июня 2018. Архивировано 24 декабря 2013 года.Архивированная копия. Дата обращения: 16 июня 2018. Архивировано 24 декабря 2013 года.
- ↑ Углерод — статья из энциклопедии «Кругосвет»
- ↑ Графит. Справочный материал. Дата обращения: 7 июля 2012. Архивировано 28 декабря 2011 года.
- ↑ Малик В. Р., Ефимович Л. П. Термодинамические функции алмаза и графита в интервале температур 300÷3000 К.//Сверхтвёрдые материалы, 1983, № 3, с. 27—30.
- ↑ Hove J. E. Some physical properties of graphite as affected by high temperature and irradiation.//in: Proc.First SCI Conf. on Indastrial Carbons and Graphites (Soc.Chem.Ind.,London.,1958, p.501-507)
- ↑ Rasor N. S., Mc Clelland J. D. J. //J.Phys.Chem.Solids, 1960, v.15, № 1—2, p. 17—20
- ↑ Шейндлин А. Е., Белевич И. С., Кожевников И. Г. «Энтальпия и теплоемкость графита в интервале температур 273-3650 K». Теплофизика высоких температур. 1972. Т. 10. № 5. С. 997—1001 (перев. Sheindlin A. Ye., Belevich I. S., Kozhevnikov I. G.//Physics of Heat at High Temperatures, 1972, 10, p.907) http://mi.mathnet.ru/tvt10631
- ↑ Андреев В. Д. Избранные проблемы теоретической физики. — Киев: Аванпост-Прим,. — 2012. Архивировано 3 декабря 2013 года.
- ↑ R. V. Lapshin. Automatic lateral calibration of tunneling microscope scanners (итал.) // Review of Scientific Instruments[англ.] : diario. — USA: AIP, 1998. — V. 69, n. 9. — P. 3268—3276. — ISSN 0034-6748. — doi:10.1063/1.1149091. Архивировано 17 декабря 2018 года.
- ↑ R. V. Lapshin. Drift-insensitive distributed calibration of probe microscope scanner in nanometer range: Real mode (англ.) // Applied Surface Science : journal. — Netherlands: Elsevier B. V., 2019. — Vol. 470. — P. 1122—1129. — ISSN 0169-4332. — doi:10.1016/j.apsusc.2018.10.149. Архивировано 15 июня 2023 года.
- ↑ Китай приостанавливает экспорт необходимого для создания аккумуляторов графита Архивная копия от 21 октября 2023 на Wayback Machine // 20 октября 2023
- ↑ 1 2 Нам нано золото: российские учёные открыли новый вид месторождений золота. Nanonewsnet.ru - Нанотехнологии. Дата обращения: 1 декабря 2015. Архивировано 8 декабря 2015 года.
- ↑ Liam A. Bullock, Owen J. Morgan. A New Occurrence of (Gold-Bearing) Graphite in the Assosa Region, Benishangul-Gumuz State, W Ethiopia // Journal of Earth Science and Engineering. — 2015-07-28. — Т. 5, вып. 7. — doi:10.17265/2159-581X/2015.07.003. Архивировано 3 июня 2018 года.
Литература
[править | править код]- Графит / Р. В. Лобзова // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Смольянинов Н. А. Практическое руководство по минералогии. — 2-е изд., испр. и доп. — М.: Недра, 1972. — С. 40, 41. — 27 000 экз.
- Яковлев В. А. Графит // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Klein, Cornelis and Cornelius S. Hurlbut, Jr. (1985) Manual of Mineralogy: after Dana 20th ed. ISBN 0-471-80580-7
- Бетехтин А. Г. Группа углерода // Курс минералогии: учебное пособие. — М.: КДУ, 2007. — С. 185. — 721 с.
- Веселовский В. С. Графит. — 2 изд.. — М.: Металлургия, 1960. — 180 с.
Ссылки
[править | править код]- о минерале графит на «Каталоге Минералов» / Архивная копия от 3 октября 2015 на Wayback Machine
- The Graphite Page (англ.) Архивная копия от 9 декабря 2013 на Wayback Machine
- Mineral galleries (англ.)
- Графит в базе webmineral.com
- Mindat w/ locations Архивная копия от 17 января 2008 на Wayback Machine (англ.)
- Manufacturing artificial graphite (англ.)
