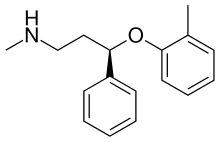
Атомоксетин
| Атомоксетин | |
|---|---|
| Atomoxetinum | |
 | |
 | |
| Химическое соединение | |
| ИЮПАК |
(3R)-N-метил-3-(2-метилфенокси)-3-фенилпропан-1-амин; |
| Брутто-формула | C17H21NO |
| Молярная масса | 255,36 г/моль |
| CAS | 83015-26-3 |
| PubChem | 54841 |
| DrugBank | DB00289 |
| Состав | |
| Классификация | |
| Фармакол. группа | Адрено- и симпатомиметики (альфа-, бета-) |
| АТХ | N06BA09 |
| Фармакокинетика | |
| Биодоступн. | 63–94% |
| Метаболизм | печёночный (CYP2D6) |
| Период полувывед. | 5 часов |
| Экскреция | с мочой >80%, с фекалиями <17% |
| Лекарственные формы | |
| капсулы | |
| Способы введения | |
| перорально (капсулы: 10, 18, 25, 40 и 60 мг; в некоторых странах также доступны 5, 80 и 100 мг) | |
| Другие названия | |
| Страттера, Атомоксетин Канон, Когниттера | |
Атомоксети́н ((3R)-N-метил-3-(2-метилфенокси)-3-фенилпропан-1-амин, (R)-N-метил-3-фенил-3-(o-толокси)пропан-1-амин, торговое название — «Страттера») — лекарственное средство, предназначенное для лечения синдрома дефицита внимания и гиперактивности (СДВ, СДВГ). По механизму действия атомоксетин является ингибитором обратного захвата норадреналина (непрямым симпатомиметиком центрального действия).
Название[править | править код]
Изначально атомоксетин был известен как «томоксетин». Однако, Управление по контролю качества пищевых продуктов и лекарственных средств США потребовало изменить название из-за его схожести с названием противоопухолевого препарата «тамоксифен», что могло бы привести к ошибкам при отпуске лекарств в аптеках.
Показания[править | править код]

Атомоксетин одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) для использования при синдроме дефицита внимания/гиперактивности у детей от 6 до 12 лет. Его эффективность не была исследована у детей до 6 лет. Для подростков более 12 лет используются другие препараты. В отличие от психостимуляторов, традиционно назначаемых при СДВГ, атомоксетин не является наркотическим средством и не обладает присущим им потенциалом злоупотребления.[1][2] В клинических испытаниях было показано, что атомоксетин потенциально способен обеспечивать устойчивый круглосуточный контроль симптомов СДВГ у некоторых взрослых и детей.[3]
Атомоксетин также используется для терапии резистентной депрессии в качестве самостоятельного средства или как компонент комплексной терапии вместе с СИОЗС или другими препаратами.[4]
Терапевтические эффекты атомоксетина развиваются постепенно в течение, по крайней мере, одной недели. Длительность курсового применения препарата должна составлять 6—8 недель перед решением о его уровне эффективности. Некоторые пациенты с СДВГ, чьё расстройство не поддаётся коррекции психостимуляторами, отвечают на применение атомоксетина. Атомоксетин также более предпочтителен для людей с разнообразными психическими расстройствами, у тех, кто плохо переносит психостимуляторы, а также у больных со злоупотреблением психоактивными веществами в анамнезе. Психостимуляторы на основе амфетамина (смешанные соли амфетамина и декстроамфетамина), чистый декстроамфетамин, лиздексамфетамин и др.) не рекомендуются к применению у людей, страдающих от нервных расстройств (таких, как лицевые тики, спазмы и др.).
Терапию атомоксетином обычно начинают, постепенно увеличивая дозу для минимизации побочных эффектов. Тем не менее, некоторые пациенты достаточно чувствительны даже к низким дозам. Если пациент одновременно получает лечение психостимуляторами, для предотвращения побочных эффектов может потребоваться постепенное снижение дозы психостимулятора.[5][6]
Мета-анализ от 2013 года показал крайне низкую эффективность атомоксетина в отношении СДВГ у взрослых. Во время исследований 50 % (865 из 1796) испытуемых прекратили приём атомоксетина до завершения клинических испытаний. Авторы мета-анализа предполагают, что такое большое количество людей, отказавшихся от приёма препарата, связано с тем, что они чувствовали от него мало полезных эффектов, но при этом им мешали неприятные побочные действия. По результатам мета-анализа был сделан вывод, что соотношение пользы и вреда в случае атомоксетина слишком неубедительное, чтобы рекомендовать этот препарат взрослым[7].
Фармакокинетика[править | править код]
- Всасывание
После приёма внутрь атомоксетин быстро и практически полностью всасывается, достигая максимальной концентрации в плазме (Cmax) примерно через 1-2 ч. Атомоксетин назначают независимо от приёма пищи.
- Распределение
Атомоксетин хорошо распределяется в организме. Обладает высоким сродством к белкам плазмы, в первую очередь, к альбумину.
- Метаболизм
Атомоксетин подвергается первичному метаболизму при участии изофермента CYP2D6. Основной образующийся окисленный метаболит (4-гидроксиатомоксетин) быстро глюкуронизируется. По фармакологической активности 4-гидроксиатомоксетин эквивалентен атомоксетину, но циркулирует в плазме в гораздо более низких концентрациях. Хотя 4-гидроксиатомоксетин первично образуется при участии CYP2D6, у людей с недостаточной активностью CYP2D6 4-гидроксиатомоксетин может образовываться некоторыми другими изоферментами цитохрома Р450, но более медленно. Атомоксетин не ингибирует и не индуцирует собственный цикл CYP2D6.
- Выведение
Средний период полувыведения (T1/2) атомоксетина после приёма внутрь составляет 3,6 ч у больных с выраженным метаболизмом и 21 ч у больных с пониженным метаболизмом. Атомоксетин в основном выделяется с мочой в виде 4-гидроксиатомоксетин-О-глюкуронида.
- Фармакокинетика в особых клинических случаях
Фармакокинетика у детей и подростков схожа с фармакокинетикой у взрослых. Фармакокинетика атомоксетина у детей до 6 лет не изучалась.
Фармакодинамика[править | править код]
Атомоксетин мощно и высокоселективно ингибирует белки-переносчики пресинаптической мембраны, осуществляющие обратный захват норадреналина, серотонина и дофамина. Константы связывания (Ki) равны, соответственно, 5, 77 и 1451 нМ. В исследованиях тканевого микродиализа было показано, что атомоксетин троекратно увеличивает уровни норадреналина и дофамина в префронтальной коре, но не изменяет уровень дофамина в полосатом теле и прилежащем ядре.[8] Также атомоксетин в терапевтических дозах действует как антагонист NMDA-рецепторов.[9] Роль такого антагонизма в терапевтическом профиле атомоксетина ещё предстоит уточнить, однако, свежие источники литературы подразумевают, что в этиологии и патогенезе СДВГ может играть роль дисфункция глутаматергической системы.
Атомоксетин не обладает клинически значимым сродством к серотониновым, ацетилхолиновым и адренорецепторам.[10]
Побочные эффекты[править | править код]
Побочные эффекты включают сухость во рту, усталость, раздражительность, тошнота, снижение аппетита, запор, головокружение, потливость, расстройство мочеиспускания, сексуальные проблемы, снижение либидо, задержка мочи, изменения веса, замедление роста у детей, увеличение частоты сердечных сокращений и артериального давления[11][12][13], агрессивность, манию, гипоманию[14].
Противопоказания[править | править код]
- одновременный приём с ингибиторами моноаминоксидазы
- закрытоугольная глаукома
- период лактации
- возраст до 6 лет
- пороки сердца
Передозировка[править | править код]
Сонливость является наиболее распространённым симптомом при острой или хронической передозировке. Другие симптомы могут включать: возбуждение, гиперактивность, нарушение поведения и симптомы со стороны ЖКТ. Также передозировка иногда вызывает мидриаз, по причине которого зрение становится затуманено, тахикардию, сухость во рту. В некоторых случаях отмечались судороги. Лечение передозировки включает промывание желудка (если прошло немного времени после приёма препарата) и употребление сорбентов (напр., активированного угля). Атомоксетин на 98 % связывается с белками плазмы, так что диализ вряд ли будет полезен.[5]
Потенциал злоупотребления[править | править код]
К настоящему дню, потенциал злоупотребления атомоксетином не изучался широко. Два проведённых исследования показали, что атомоксетин имеет потенциал злоупотребления от низкого до среднего, поскольку имеет долгое время титрования (что означает, что эффект от применения может быть не заметен, пока не пройдёт достаточно долгий период ежедневного приёма препарата). Атомоксетин не вызывает значительного психостимулирующего эффекта, как большинство других средств против СДВГ. Исследуемые макаки не вводили себе атомоксетин самостоятельно.[1][2] Однако, исследования на крысах, голубях и мартышках, наученных отличать кокаин или метамфетамин от физраствора показывают, что атомоксетин вызывает эффекты, неотличимые от низких доз кокаина или метамфетамина, но не такие, как высокие дозы кокаина.[15][16]
В США атомоксетин не входит в списки Закона о контролируемых веществах (англ. Controlled Substances Act), в которые обычно включены вещества, имеющие потенциал злоупотребления и способные вызывать психологическую или физическую зависимость.[17]
Использование по незарегистрированным показаниям (off-label)[править | править код]
Атомоксетин изначально исследовался как препарат для лечения депрессии, но не показал благоприятного соотношения риск/польза в клинических испытаниях. В последующем, компания-производитель Eli Lilly and Company исследовала атомоксетин для лечения СДВГ. Многие пациенты наблюдают выраженный антидепрессивный эффект атомоксетина (при использовании с другими антидепрессантами).[18][19][20][21]
В 2007 г. в Journal of Clinical Psychiatry сообщалось о двойном слепом плацебо-контролируемом рандомизированном исследовании с 40 участниками, проходившем в течение 10 недель. Исследовалась эффективность атомоксетина в лечении психогенного переедания. Средняя доза атомоксетина составляла 106 мг/сут. Исследование показало, что «применение атомоксетина было связано со значительно большей скоростью уменьшения эпизодов переедания, снижения массы тела и ИМТ». Авторы исследования сделали вывод, что атомоксетин может быть эффективным при кратковременном лечении психогенного переедания.[22]
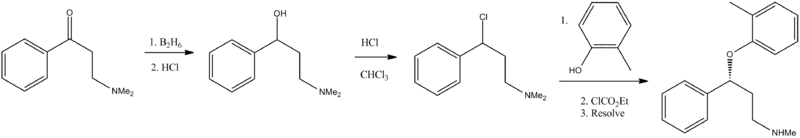
Синтез[править | править код]
Примечания[править | править код]
- ↑ 1 2 Wee S., Woolverton W.L. Evaluation of the reinforcing effects of atomoxetine in monkeys: comparison to methylphenidate and desipramine (англ.) // Drug and Alcohol Dependence : journal. — 2004. — September (vol. 75, no. 3). — P. 271—276. — doi:10.1016/j.drugalcdep.2004.03.010. — PMID 15283948.
- ↑ 1 2 Gasior M., Bergman J., Kallman M.J., Paronis C.A. Evaluation of the reinforcing effects of monoamine reuptake inhibitors under a concurrent schedule of food and i.v. drug delivery in rhesus monkeys (англ.) // Neuropsychopharmacology : journal. — Nature Publishing Group, 2005. — April (vol. 30, no. 4). — P. 758—764. — doi:10.1038/sj.npp.1300593. — PMID 15526000.
- ↑ Velásquez-Tirado J.D., Peña J.A. Evidencia actual sobre la atomoxetina. Alternativa terapéutica para el trastorno por déficit de atención e hiperactividad (исп.) // Revista de Neurología. — 2005. — V. 41, no 8. — P. 493—500. — PMID 16224736. Архивировано 22 мая 2013 года.
- ↑ Stahl, S. Stahl’s Essential Psychopharmacology: The Prescriber’s Guide. Cambridge University Press. New York, NY. 2009. pp.31
- ↑ 1 2 Unni J.C. Atomoxetine // Indian Pediatrics. — 2006. — Июль (т. 43, № 7). — С. 603—606. — PMID 16891679. Архивировано 27 марта 2013 года.
- ↑ Prasad S., Steer C. Switching from neurostimulant therapy to atomoxetine in children and adolescents with attention-deficit hyperactivity disorder : clinical approaches and review of current available evidence (англ.) // Paediatric Drugs : journal. — 2008. — Vol. 10, no. 1. — P. 39—47. — doi:10.2165/00148581-200810010-00005. — PMID 18162007.
- ↑ Cunill R., Castells X., Tobias A., Capellà D. Atomoxetine for attention deficit hyperactivity disorder in the adulthood: a meta-analysis and meta-regression. (англ.) // Pharmacoepidemiology And Drug Safety. — 2013. — September (vol. 22, no. 9). — P. 961—969. — doi:10.1002/pds.3473. — PMID 23813665.
- ↑ Atomoxetine Increases Extracellular Levels of Norepinephrine and Dopamine in Prefrontal Cortex of Rat: A Potential Mechanism for Efficacy in Attention Deficit/Hyperactivity Disorder. Дата обращения: 9 июля 2011. Архивировано 10 июля 2013 года.
- ↑ Atomoxetine acts as an NMDA receptor blocker in clinically relevant concentrations.
- ↑ Atomoxetine: The First Nonstimulant for the Management of ADHD: Pharmacology. Дата обращения: 9 июля 2011. Архивировано 10 июля 2013 года.
- ↑ Simpson D., Plosker G.L. Spotlight on atomoxetine in adults with attention-deficit hyperactivity disorder (англ.) // Drugs : journal. — Adis International, 2004. — Vol. 18, no. 6. — P. 397—401. — doi:10.2165/00023210-200418060-00011. — PMID 15089111. (англ.)
- ↑ Drug Library. Strattera — Side Effects & Drug Interactions Архивировано 18 мая 2012 года. (англ.)
- ↑ ADHD Drugs and Side Effects in Children. Дата обращения: 31 декабря 2012. Архивировано 8 июля 2013 года. (англ.)
- ↑ Henderson TA, Hartman K. Aggression, Mania, and Hypomania Induction Associated With Atomoxetine (англ.) // Pediatrics. — American Academy of Pediatrics, 2004. — Vol. 114, no. 3.
- ↑ Spealman R.D. Noradrenergic involvement in the discriminative stimulus effects of cocaine in squirrel monkeys (англ.) // The Journal of Pharmacology and Experimental Therapeutics : journal. — 1995. — October (vol. 275, no. 1). — P. 53—62. — PMID 7562595.
- ↑ Sasaki J.E., Tatham T.A., Barrett J.E. The discriminative stimulus effects of methamphetamine in pigeons (англ.) // Psychopharmacology : journal. — Springer, 1995. — August (vol. 120, no. 3). — P. 303—310. — doi:10.1007/BF02311178. — PMID 8524978.
- ↑ «STRATTERA® (atomoxetine hydrochloride) CAPSULES for Oral Use, Full Prescribing Information». Eli Lilly and Company, 2002. Revised August 22, 2012. [1] Архивная копия от 9 июля 2014 на Wayback Machine
- ↑ Spencer T.J., Faraone S.V., Michelson D., et al. Atomoxetine and adult attention-deficit/hyperactivity disorder: the effects of comorbidity (англ.) // The Journal of Clinical Psychiatry : journal. — 2006. — March (vol. 67, no. 3). — P. 415—420. — doi:10.4088/JCP.v67n0312. — PMID 16649828.
- ↑ Pilhatsch M.K., Burghardt R., Wandinger K.P., Bauer M., Adli M. Augmentation with atomoxetine in treatment-resistant depression with psychotic features. A case report (англ.) // Pharmacopsychiatry : journal. — 2006. — March (vol. 39, no. 2). — P. 79—80. — doi:10.1055/s-2006-931547. — PMID 16555170.
- ↑ Carpenter L.L., Milosavljevic N., Schecter J.M., Tyrka A.R., Price L.H. Augmentation with open-label atomoxetine for partial or nonresponse to antidepressants (англ.) // The Journal of Clinical Psychiatry : journal. — 2005. — October (vol. 66, no. 10). — P. 1234—1238. — doi:10.4088/JCP.v66n1005. — PMID 16259536.
- ↑ Kratochvil C.J., Newcorn J.H., Arnold L.E., et al. Atomoxetine alone or combined with fluoxetine for treating ADHD with comorbid depressive or anxiety symptoms (англ.) // Journal of the American Academy of Child and Adolescent Psychiatry : journal. — 2005. — September (vol. 44, no. 9). — P. 915—924. — doi:10.1097/01.chi.0000169012.81536.38. — PMID 16113620.
- ↑ McElroy S.L., Guerdjikova A., Kotwal R., et al. Atomoxetine in the treatment of binge-eating disorder: a randomized placebo-controlled trial (англ.) // The Journal of Clinical Psychiatry : journal. — 2007. — March (vol. 68, no. 3). — P. 390—398. — doi:10.4088/JCP.v68n0306. — PMID 17388708.