Гексафтороалюминат натрия
Перейти к навигации
Перейти к поиску
| Гексафтороалюминат натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Гексафтороалюминат натрия |
| Традиционные названия | Фтористый алюминий-натрий |
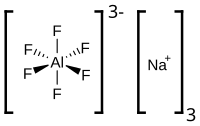
| Хим. формула | Na3[AlF6] |
| Физические свойства | |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 209,94 г/моль |
| Плотность | 2,89; 2,90; 2,97 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1000; 1011 °C |
| Мол. теплоёмк. | 216 Дж/(моль·К) |
| Энтальпия | |
| • образования | -3312 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,04 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,3389 |
| Классификация | |
| Рег. номер CAS | 13775-53-6 |
| PubChem | 16693908 |
| Рег. номер EINECS | 237-410-6 |
| SMILES | |
| InChI | |
| RTECS | WA9625000 |
| ChEBI | 39289 |
| ChemSpider | 11431435 и 140411 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гексафтороалюминат натрия — неорганическое вещество, смешанная соль плавиковой кислоты и металлов алюминия и натрия, с формулой Na3[AlF6]. Бесцветные кристаллы, плохо растворимые в воде.
Получение[править | править код]
- В природе встречается редкий минерал криолит из группы природных фторидов, химический состав Na3[AlF6] с незначительными примесями.
- Из насыщенных растворов фторидов натрия и алюминия:
- Действием плавиковой кислоты на гидроксид алюминия и фторид натрия:
- Обменными реакциями:
Физические свойства[править | править код]
Гексафтороалюминат натрия образует бесцветные кристаллы моноклинной сингонии, пространственная группа P 21/n, параметры ячейки a = 0,780 нм, b = 0,561 нм, c = 0,546 нм, β = 90,18°, Z = 2.
Расплав гексафтороалюмината натрия является электролитом и проводит электрический ток.
Химические свойства[править | править код]
- В расплаве диссоциирует:
- При дальнейшем нагревании начинает разлагаться:
- Разлагается концентрированными кислотами:
- и щелочами:
Применение[править | править код]
- Компонент электролита при производстве алюминия.
- Металлургический флюс.
- Компонент стёкол и эмалей.
- Наполнитель для резины.
- Относится к многотоннажному производству, цена технического продукта ~1000$/т, чистого ~6$/кг.
Примечания[править | править код]
Литература[править | править код]
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |
![{\displaystyle {\mathsf {3NaF+AlF_{3}\ {\xrightarrow {}}\ Na_{3}[AlF_{6}]\downarrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50b569eff1ebe788b29b8fe6d3adc496ac028fe7)
![{\displaystyle {\mathsf {3NaF+Al(OH)_{3}+3HF\ {\xrightarrow {}}\ Na_{3}[AlF_{6}]\downarrow +3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8fa5fd0719817c5c8f0a3cb76f1447f026d6785)
![{\displaystyle {\mathsf {AlF_{3}+3NH_{4}F+3NaNO_{3}\ {\xrightarrow {}}\ Na_{3}[AlF_{6}]\downarrow +3NH_{4}NO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/088fbf9621bee41f022abe7ca846b2996e5cae5d)
![{\displaystyle {\mathsf {Al_{2}(SO_{4})_{3}+12NaF\ {\xrightarrow {}}\ 2Na_{3}[AlF_{6}]\downarrow +3Na_{2}SO_{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50eee6d803ecee06eff516de53a01a77fb3acfde)
![{\displaystyle {\mathsf {Na_{3}[AlF_{6}]\ {\stackrel {\xrightarrow {1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ }]{}}}\ 3Na^{+}+[AlF_{6}]^{3-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a81f2e5a00e293166511bb86ab5103912565a03f)
![{\displaystyle {\mathsf {[AlF_{6}]^{3-}\ {\stackrel {\xrightarrow {>1000^{o}C}}{\xleftarrow[{\ \ \ \ \ \ \ \ }]{}}}\ [AlF_{4}]^{-}+2F^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fcf621cad4b9e84ae775afe4611e64e9846baad4)
![{\displaystyle {\mathsf {2Na_{3}[AlF_{6}]+9H_{2}SO_{4}\ {\xrightarrow {\ }}\ 6NaHSO_{4}+Al_{2}(SO_{4})_{3}+12HF\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e0f8553a4c7bf942de75bb51ff7a129e9207e05)
![{\displaystyle {\mathsf {Na_{3}[AlF_{6}]+4NaOH\ {\xrightarrow {\ }}\ Na[Al(OH)_{4}]+6NaF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f6e3c1b2e17299c2153d9ea6e7ddd03ecfae4af)