Теории эволюции старения
Эволюционное развитие старения — предмет множества исследований и ряда научных теорий. Они направлены в том числе на объяснение большой разницы продолжительности жизни разных организмов. Из теорий, посвящённых теме, можно выделить теории накопления мутаций, антагонистической плейотропии и одноразовой сомы[1][2][3]. Они предполагают, что генетические изменения, способствующие долголетию, почти не поддерживаются естественным отбором, потому что в естественных условиях почти не могут проявиться: организмы обычно не доживают до старости из-за факторов окружающей среды (хищники, несчастные случаи, болезни, голод). Вместо этого отбор отдаёт предпочтение генам, обеспечивающим раннее взросление и размножение. Отбор генетических признаков, которые способствуют поддержанию молекул и клеток в работоспособном состоянии, у большинства видов слабеет с возрастом[4].
Теории и гипотезы[править | править код]
Необходимо проверить качество перевода, исправить содержательные и стилистические ошибки. |
Начало[править | править код]
Август Вейсман был ответственен за интерпретацию и формализацию механизмов дарвиновской эволюции в теоретических рамках. В 1889 году Август выдвинул гипотезу о том, что старение является частью жизненной программы, позволяющей освободить место для следующего поколения с целью поддержания изменчивости, необходимой для эволюции. Идея о том, что характеристика старения была адаптирована в связи с её пагубным воздействием, в значительной степени была проигнорирована в течение большей части 20-го века, однако его теоретическая модель полагает, что альтруистическое старение может возникнуть, в случае если между популяциями будет сохраняться небольшая миграция.[5] Чуть позже Вейсманн всё же отказался от своей теории и через некоторое время основал новую теорию «запрограммированной смерти».
Естественный отбор — это процесс, позволяющий видам адаптироваться к окружающей среде. Более приспособленные особи оставляют в среднем больше потомков. Естественный отбор на различные признаки организмов приводит к увеличению их репродуктивного успеха и приспособленности. Приспособленность в этом контексте означает то, насколько вероятно, что организм выживет и будет воспроизводиться. Она различна у разных особей в популяции, а для каждой особи различна в разной окружающей среде. Примеры признаков, на которые может влиять отбор, — возраст и размер при первом размножении, размер и количество произведённых потомков, а также период репродуктивной жизни. Соотношение энергии, которая тратится организмами на рост, размножение и поддержание своих функций, меняется на протяжении их жизни. Размножение может требовать значительных ресурсов, а откладывание размножения сохраняет их. По мере снижения с возрастом репродуктивной активности снижается и эффективность естественного отбора. Накопление мутаций (НМ) и антагонистическая плейотропия (АП) — два фактора, способствующих старению.[6] И НМ, и AП способствуют возрастному снижению приспособленности и пригодности.[7] Накопление случайных, связанных с возрастом мутировавших аллелей зародышевой линии известно как накопление мутаций. Обратите внимание, что соматические мутации не передаются по наследству, они являются лишь источником вариаций в развитии. Исследования, проведенные на Drosophila melanogaster, показали, что накопление мутаций приводит к комбинации аллелей, которые имеют «возрастные аддитивные эффекты», вызывающие снижение реакции на стресс и, в конечном счете, возрастное снижение приспособленности.[6] Число делений зародышевых клеток на поколение варьируется среди клонов и зависит от размера генома; у человека на одно поколение у мужчин происходит 401 деление половых клеток, а у женщин — всего 31.[8]
Накопление мутаций[править | править код]
Линия зародыша[править | править код]
Первую современную теорию старения млекопитающих сформулировал Питер Медавар в 1952 году. Данная теория формировалась в предыдущее десятилетие вместе с Дж. Б. С. Холдейном и его концепцией тени отбора. Развитие человеческой цивилизации избавилось от тени отбора, поскольку условия, в которых сейчас живут люди, включают улучшенное качество продуктов питания, условий жизни и здравоохранения. Это улучшенное здравоохранение включает современную медицину, такую как антибиотики и новые медицинские технологии.[9] Несколько исследований у дрозофилы показали, что возраст экспрессии новых вредных мутаций определяет их влияние на смертность. В целом, однако; хотя их частота увеличивается, их эффекты и вариабельность уменьшаются с возрастом.
Не существует теории, объясняющей, как эти вредные мутации могут влиять на приспособленность в разном возрасте и на эволюцию старения.[10][11] Их идея заключалась в том, что старение — это скорее вопрос пренебрежения, поскольку природа всегда являлась местом крайне высокой конкуренции. Почти все животные умирают в дикой природе от хищников, болезней или несчастных случаев, что может способствовать снижению средней продолжительности жизни. Следовательно, не существует особых причин, по которым тело должно оставаться в форме в течение длительного времени, потому что давление отбора низкое для признаков, которые сохраняли бы жизнеспособность после того времени, когда большинство животных все равно бы умерло. Метаболические заболевания возникают из-за низкой потребности в физической активности в современной цивилизации по сравнению с теми временами, когда людям приходилось добывать пищу в дикой природе для выживания.[9] Теперь, когда селективная тень сместилась, люди должны справляться с новыми селективными проблемами и вызовами
Старение считается побочным продуктом физиологии, поскольку метаболизм наших клеток создает токсичные продукты, мы получаем мутации с возрастом и у нас не хватает регенеративных стволовых клеток. Почему же отбор не нашел мутации, позволяющие нам, например, регенерировать клетки или не производить токсичный метаболизм? Почему развилась менопауза? Потому что отбор более эффективен в отношении признаков, проявляющихся на ранних этапах жизни. Мутации, которые оказывают влияние на ранних стадиях жизни, повышают приспособленность гораздо больше, чем мутации, проявляющиеся поздно. Большинство людей уже размножились до того, как проявилась какая-либо болезнь; это означает, что родители передадут свои аллели потомству до того, как у них появятся проблемы с приспособленностью, и, следовательно, для отбора будет «слишком поздно».
Две теории; неадаптивные и адаптивные, используются для объяснения эволюции старения, то есть снижения репродуктивной способности с возрастом.[7] Неадаптивная теория предполагает то, что эволюционное ухудшение возраста человека происходит в результате накопления вредных мутаций ещё в зародышевой линии.[7] Эти вредные мутации начинают проявляться ближе к концу жизни, в то время, когда мы уже породили потомство и стали слабее. Это означает, что естественный отбор не может воздействовать на данные особи, поскольку их размножение уже закончилось. Исследования, проведенные на Drosophila melanogaster, показали обратную зависимость между средним оптимальным возрастом зрелости и частотой мутаций на один ген.[12] Накопление мутаций влияет на распределение времени и энергии, направляющихся на рост и размножение в течение всей жизни организма, особенно в период репродуктивной продолжительности, поскольку накопление мутаций может способствовать росту старения. Это означает лишь то, что организмы должны достичь наиболее оптимального возраста зрелости в молодом возрасте, поскольку продолжительность их репродуктивной жизни сокращается в связи с возможным накоплением мутаций.[12]
Мутации случаются совершенно случайно по отношению к потребности в окружающей среде и приспособленности. Они могут быть либо полезными, когда они повышают приспособленность организма, либо нейтральными, когда не влияют на приспособленность организма, либо вредными, когда негативно влияют на приспособленность организма. Ранее проведенные эксперименты показали, что большинство мутаций вредны, и лишь некоторые — полезны. Мутации генов, взаимодействующих друг с другом в процессе развития, создают биологическое и, следовательно, фенотипическое разнообразие. Мутации — это генетическая информация, выражаемая среди организмов посредством экспрессии генов, что представляет собой перевод генетической информации в фенотипический характер.[13] Эволюция — это изменение наследуемого признака в популяции в ряду поколений, поскольку мутации порождают вариации наследуемых признаков; они считаются сырьем для эволюции. Поэтому накопление полезных мутаций в процессе развития может порождать больше фенотипических вариаций, что увеличивает частоту их генов и влияет на способность фенотипической эволюции[14]
Соматические клетки[править | править код]
Популярной идеей, не получившей значительной экспериментальной поддержки, является представление о том, что мутации в соматических клетках, являются основной причиной старения. У мышей, дефектных по гомологу mutL Pms2, частота мутаций во всех тканях повышена примерно в 100 раз, но старение не происходит быстрее.[15] Эти мыши демонстрируют в основном нормальное развитие и жизнь, за исключением раннего начала канцерогенеза и мужского бесплодия. Хотя зародышевые мутации и могут влиять на течение процесса старения в течение многих поколений (как обсуждалось выше), соматические мутации, происходящие в течение жизни организма, по-видимому, оказывают незначительное влияние на процесс старения, если вообще оказывают.
Антагонистическая плейотропия[править | править код]
Теория Медавара была подвергнута критике и позже развита Джорджем К. Уильямсом в 1957 году. Уильямс отметил, что старение может быть причиной многих смертей, даже если животные не «умирают от старости».[1] Он начал свою гипотезу с идеи о том, что старение может привести к более ранней гибели из-за конкурентной природы биоты. Даже небольшая степень старения может быть фатальной; следовательно, естественный отбор действительно влияет на это, и за старение придётся расплачиваться.[16]
В конце концов Уильямс предложил свою собственную гипотезу, назвав её антагонистической плейотропией . Сама по себе плейотропия означает одну мутацию, оказывающую множественное влияние нафенотип. С другой стороны, антагонистическая плейотропия имеет дело с одним геном, который создает две черты, одна из которых полезна, а другая — вредна. По сути, это относится к генам, приносящим пользу ещё в раннем возрасте, но накапливающим вредные черты чуть позже.[1] Другими словами, антагонистическая плейотропия — это отрицательность резюмирующей взаимосвязи между двумя чертами, а также условия, в которых один фенотипический признак положительно влияет на текущее воспроизводство за счет ускоренного старения, роста и последующего поддержания. Антагонистическая плейотропия константна, в случае, если не происходит мутация, изменяющая эффекты первичного локуса.[12]
Хоть антагонистическая плейотропия сегодня и является преобладающей теорией, она лишь принята на веру, но не подвергалась особым проверкам на свою истинность. Исследования показали, что это верно не для всех генов и может рассматриваться как частичное подтверждение теории, но это противоречит основной посылке: генетические компромиссы являются основной причиной старения.
В экспериментах по разведению, Майкл Р. Роуз отбирал плодовых мух с долгой продолжительностью жизни. Основываясь на антагонистической плейотропии, Роуз ожидал, что это обязательно снизит их плодовитость . Его же команда обнаружила, что они могут разводить мух, которые живут более чем в два раза дольше, чем мухи, с которыми они начали, но, к их удивлению, долгоживущие мухи на самом деле откладывают больше яиц, чем недолговечные. Это стало ещё одной неудачей для теории плейотропии, хотя Роуз также утверждает, что это может быть лишь особенность поставленного им эксперимента.[17]
Теория одноразовой сомы[править | править код]
Третья основная теория, предложенная Томасом Кирквудом в 1977 году, постулирует, что организм должен учитывать доступные ему ресурсы. Он использует их, получая их из окружающей среды, для метаболизма, воспроизводства, восстановления и поддержания, и организм вынужден идти на компромисс, в случае ограниченности запасов ресурсов. Теория утверждает, что этот компромисс заставляет организм перераспределять энергию на функцию восстановления, что приводит к постепенному ухудшению состояния организма с возрастом.[2]
Оговорка в этой теории предполагает, что это перераспределение энергии основано на времени, а не на ограничении ресурсов. Эта концепция фокусируется на эволюционном давлении, направленном на воспроизводство в определенный, оптимальный период времени, который диктуется возрастом и экологической нишей. Это происходит за счет выделения времени и энергии на восстановление повреждений на клеточном уровне, что приводит к накоплению повреждений и сокращению продолжительности жизни по сравнению с организмами с более длительным сроком беременности . Данная концепция берёт своё начало в сравнительном анализе стабильности генома в клетках млекопитающих.[18][19]
Один противоположный аргумент основан на эффекте ограничения калорийности, который продлевает жизнь.[20][21][22] Однако не было доказано, что ограничение питания повышает репродуктивный успех (приспособленность) на протяжении всей жизни, поскольку, когда доступность пищи ниже, репродуктивная производительность также ниже. Более того, калории — это не единственный ресурс, который может быть ограничен в организме и который может влиять на множество параметров приспособленности.
Теория повреждений / ошибок ДНК[править | править код]
Как мутация и экспрессия ДНК оказывают фенотипическое воздействие на организмы, так и повреждение ДНК и накопление мутаций также имеют фенотипические последствия у пожилых людей. Повреждение макромолекул, таких как ДНК, РНК и белки, а также разрушение тканей и органов являются основой старения. Видоспецифические темпы старения обусловлены пагубными изменениями, которые проявляются после репродуктивной фазы. Митохондриальная ДНК (мтДНК) регулирует клеточный метаболизм, апоптоз и контроль окислительного стресса.[23] Следовательно, повреждение мтДНК является еще одним фактором, способствующим фенотипам, связанным со старением . Нейродегенерация и рак — два фактора, проявляющиеся уникальным повреждением ДНК; потому людям необходимо понимать изменение связи между повреждением ДНК и репарацией ДНК по мере старения, дабы знать о возрастных заболеваниях и развивать образ жизни, что сможет поспособствовать продлению здоровой жизни.[24]
Теория старения с повреждением ДНК постулирует, что повреждение ДНК повсеместно в биологическом мире и является основной причиной старения.[25] В основе теории лежит идея о том, что старение происходит со временем из-за повреждения ДНК. Например, исследования мозга и мышц млекопитающих показали, что способность к восстановлению ДНК относительно высока на ранних стадиях развития, когда клетки делятся митотически, но значительно снижается, когда клетки переходят в постмитотическое состояние[26][27][28]
Эффект снижения экспрессии способности к репарации ДНК заключается в увеличении накопления повреждений ДНК. Это нарушает транскрипцию генов и вызывает прогрессирующую потерю клеточных и тканевых функций, что определяют старение. В ответ на повреждение ДНК одним из ответов, запускаемых окислительным стрессом, является активация p53 .[29] Белок p53 связывается непосредственно с ДНК, а затем стимулирует выработку белка p21, также известного в качестве ингибитора 1 циклин-зависимой киназы. Это способно гарантировать неспособность клетки перейти на следующую стадию деления, повреждённое ДНК не будет восстановлено. Однако клетки p21 в силах запускать апоптоз . Апоптоз или же запрограммированная гибель клеток связан с постепенной деградацией иммунной системы, мышц скелета и нарушениями в работе организма, вызванными старением.[30]

Теломерная теория старения[править | править код]
Теломеры — это повторяющиеся нуклеотидные последовательности, которые защищают концы наших хромосом; они чувствительны к окислительному стрессу и разрушаются во время репликации хромосом. Теломераза — это рибонуклеотидный белок, который помогает восстанавливать и заменять разрушенные теломеры . Однако с возрастом теломераза подводит нас; она становится менее способной восстанавливать теломеры, и все наше тело начинает разрушаться. Это означает, что наши клетки больше не могут делиться или делятся с ошибками, что и является основой старения. Новые исследования также показали, что существует связь между укорочением теломер и дисфункцией митохондрий.[31] Тем не менее, чрезмерная экспрессия теломеразы увеличивает вероятность развития рака. Если теломеры остаются в состоянии ремонта, увеличивается вероятность долголетия, но при этом увеличивается число делений клеток и повышается вероятность мутаций, которые могут привести к раку. Таким образом, долгоживущая клетка — это просто бомба замедленного действия. Поэтому усиление активности теломеразы не является решением проблемы; оно лишь позволяет клеткам жить дольше.. Однако голый землекоп обладают высокой теломеразной активностью; они живут долго и никогда не болеют раком; поэтому они являются исключением из этой гипотезы.[32]
Теории запрограммированного обслуживания[править | править код]
Теории, такие как теория «запрограммированной смерти» Вайсмана, предполагают, что ухудшение состояния и смерть в результате старения являются целенаправленным результатом эволюционного дизайна организма, и называются теориями запрограммированного старения или адаптивного старения.
Теория запрограммированного поддержания, основанная на эволюционируемости[33] предполагает, что механизмы восстановления контролируются общим механизмом управления, способным воспринимать условия, такие как ограничение калорийности, и могут отвечать за продолжительность жизни у конкретных видов. В этой теории методы выживания основаны на механизмах контроля вместо индивидуального механизма поддержания, который заметен в незапрограммированной теории старения млекопитающих.
Непрограммируемая теория старения млекопитающих[34] утверждает, что разные виды обладают разными способностями к поддержанию и восстановлению. Более долгоживущие виды обладают многими механизмами для компенсации повреждений, вызванных такими причинами, как окисление, укорочение теломер и другие разрушительные процессы. Более короткоживущие виды, у которых половая зрелость наступает раньше, меньше нуждаются в долголетии и поэтому не развили или не сохранили более эффективные механизмы восстановления. Поэтому повреждения накапливаются быстрее, что приводит к более ранним проявлениям и сокращению продолжительности жизни. Поскольку существует большое разнообразие проявлений старения, которые, по-видимому, имеют совершенно разные причины, вероятно, существует множество различных функций поддержания и восстановления.
Избирательная тень[править | править код]
Селективное затенение — одна из эволюционных теорий старения, основанная на предположении, что отбор индивидуума обычно снижается, как только он по существу проходит фазу половой зрелости. В результате образуется тень без учета половой пригодности, которая перестает учитываться по мере старения особи. Это подтверждает идею о том, что сила естественного отбора снижается в зависимости от возраста, которая была впервые представлена Питером Б. Медеваром и Дж. Б.С. Холдейном.
«Ключевая концептуальная идея, которая позволила Медавару, Уильямсу и другим разработать эволюционную теорию старения, основана на представлении о том, что сила естественного отбора, мера того, насколько эффективно отбор действует на выживаемость или плодовитость в зависимости от возраста, снижается с прогрессирующим возрастом».[35]
Медевар разработал модель, которая подчеркивает это, показывая снижение выживаемости популяции по мере старения особи, однако уровень воспроизводства остается постоянным. Вероятность размножения обычно достигает пика в период половой зрелости и снижается по мере старения особи, в то время как у остальных особей популяции она снижается с возрастом, поскольку они входят в тень отбора. Модель также подтверждает теорию Медеварса о том, что из-за опасных и непредсказуемых условий окружающей среды, таких как болезни, изменения климата и хищники, многие особи погибают вскоре после полового созревания. Следовательно, вероятность того, что особь выживет и будет страдать от возрастных эффектов, относительно низка.
Таким же образом, многие полезные мутации отсеиваются, если они оказывают положительное влияние на особь на более поздних этапах жизни. Например, если полезная или вредная мутация возникает только после репродуктивной фазы особи, то она не влияет на приспособленность и поэтому не может быть отсеяна. Впоследствии эти поздние мутации и эффекты считаются находящимися в «теневой области» отбора.[36]
Естественный отбор[править | править код]
Групповой отбор[править | править код]
Групповой отбор идёт в том случае, если некоторая группа особей преуспевает или терпит неудачу как единое целое. При таком механизме генетический дрейф происходит коллективно для всех членов группы и отличает их от других групп своего вида. Этот механизм отличается от индивидуального отбора тем, что идёт на уровне групп, а не отдельных особей[37].
Часто люди, уже пережившие период репродуктивной жизни, также переходят из поколения в поколение: афалины и киты-пилоты охраняют своих внуков. Существует совместное размножение у некоторых млекопитающих, многих насекомых и около 200 видов птиц; половые различия в выживании антропоидных приматов, как правило, коррелируют с заботой о потомстве; или ребенка Efe часто посещают более 10 человек. Ли разработал формальную теорию, объединяющую отбор по переселенцам (в любом возрасте) с отбором по рождаемости.[38]
Эволюционируемость[править | править код]
Эволюционируемость основана на идее того, что организм способен генетически приспособиться к окружающей среде.
Скулачев (1997)[39] предполагал, что запрограммированное старение способно помочь процессу эволюции, постепенно создавая увеличивающуюся проблему или препятствие на пути к выживанию и воспроизводству и, следовательно, улучшая выборку полезных и пригодных характеристик.
Голдсмит (2008)[40] выдвинул гипотезу того, что, хотя увеличение скорости генерации и скорости эволюции полезно для вида, также крайне важно ограничить продолжительность жизни, дабы пожилые люди не преобладали в генофонде .
Модель Янга (2013)[5] также основана на идее о том, что старение способно ускорить накопление новых адаптивных генов в локальных популяциях. Но, в своей статье Ян изменил терминологию «эволюционируемость» на «генетическую креативность», дабы облегчить понимание того, что старение может иметь более краткосрочные преимущества, чем подразумевает слово «эволюционируемость».
Ленарт и Вашку (2016)[41] также ссылались на эволюционируемость как на главный механизм, способный привести к эволюции старения. Однако они предполагали, что, даже если фактическая скорость старения способна быть адаптивной, само старение остаётся неизбежным. Другими словами, эволюция может изменить скорость старения, но какое-то старение, независимо от того, насколько оно будет медленно, всегда будет происходить.
Смертность[править | править код]
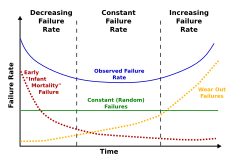
Смертность — это количество смертей в определенной группе за определенный период времени.[42] Выделяют два типа смертности: внутренняя и внешняя смертность . Считается, что внутренняя смертность является результатом старения, вызванного внутренними факторами, тогда как внешняя смертность представляет собой прямой результат факторов окружающей среды. Примером может служить то, что у летучих мышей меньше потенциальных хищников, а потому они выделяются низкой внешней смертностью. Птицы — теплокровные и по размеру похожи на многих мелких млекопитающих, но часто живут в 5-10 раз дольше. Они испытывают меньшее давление хищников, чем наземные млекопитающие, и имеют более низкую внешнюю смертность.
При изучении зависимости между размером тела и продолжительностью жизни можно также заметить, что хищные млекопитающие, как правило, живут дольше, чем хищные млекопитающие в контролируемой среде, например, в зоопарке или заповеднике. Объяснение долгой жизни приматов (таких как люди, обезьяны и мартышки) по отношению к размеру тела заключается в их интеллекте и более низкой внутренней смертности.
Возможное бессмертие зародышевой линии[править | править код]
Отдельные организмы смертны; им свойственно стареть и умирать, в то время как зародышевые линии, связывающие последующие поколения, потенциально могут оставаться бессмертны. В основе этого различия и лежит фундаментальный вопрос биологии. Российский историк и биолог, Жорес А. Медведев,[43] считал, что точность репликативных геномных и других синтетических систем сама по себе не не способна объяснить бессмертие, так называемых, зародышевых линий . Скорее Медведев был склонен полагать, что особенности биохимии и генетики полового размножения указывают на наличие своеобразных процессов поддержания и восстановления информации на разных этапах гаметогенеза . В частности, Медведев считал, что наиболее важные возможности для информационного обеспечения половых клеток создаются рекомбинацией во время мейоза и репарации ДНК; он видел в них процессы внутри половых клеток, способные восстанавливать целостность ДНК и хромосом от типов повреждений, вызывающих необратимое старение соматических клеток .
Болезни[править | править код]
Другие прогероидные синдромы[править | править код]
Прогероидные синдромы — это генетические заболевания, связанные с преждевременным старением. Прогероидные синдромы характеризуются признаками, схожими с признаками физиологического старения особи, например, выпадение волос и сердечно-сосудистые заболевания.[44]
Прогерия[править | править код]
Прогерия — это генетическое заболевание с одним геном, вызывающее ускорение многих или большинства симптомов старения ещё в раннем детстве. Страдают таким заболеванием 1 из 4-8 миллионов рождённых.[45] Поражённые этим заболеванием выделяются неспособность к развитию и имеют ряд симптомов, вызывающих нарушения в суставах, волосах, коже, глазах и лице.[46] Большинство из них доживают всего до 13 лет.[47] Хотя термин прогерия применяется, грубо говоря, ко всем заболеваниям, характеризующимся симптомами преждевременного старения, он также часто используется в отношении синдрома прогерии Хатчинсона — Гилфорда (HGPS). У детей с диагнозом HGPS развиваются ярко выраженные черты лица, такие как маленькое лицо, тонкие губы, маленький подбородок и оттопыренные уши. Хотя прогерия может вызывать физические аномалии у ребенка, она не влияет на его двигательные навыки или интеллектуальное развитие.[48] Страдающие HGPS склонны к сердечно-сосудистым и неврологическим расстройствам.[49] HGPS вызван точечной мутацией в гене, кодирующем белок ламина А. Этот белок способствует генетической стабильности, поддерживая уровни белков, играющих важную роль в негомологичном соединении концов и гомологичной рекомбинации .[50] Клетки мыши, дефицитные для созревания преламина А, демонстрируют повышенное повреждение ДНК и всяческие хромосомные аберрации, а, кроме того, также обладают повышенной чувствительностью к вещствам, повреждающим ДНК.[51] В HGPS невозможность адекватно репарации повреждений ДНК из-за дефектного ламина А-типа может вызвать преждевременное старение, связанное с ламинопатией.[51]
Синдром Вернера[править | править код]
Синдром Вернера, также известный под термином «взрослая прогерия», является еще одним генетическим заболеванием одного гена. Оно вызвано мутацией в гене WRN.[49] Им страдает примерно 1 из 200 000 граждан США[52]. Этот синдром начинает поражать людей ещё в подростковом возрасте, не позволяя детям расти в период полового созревания. Есть четыре общих черты синдрома Вернера: катаракта обоих глаз, изменения кожи, похожие на склеродермию, низкий рост, а также раннее поседение и выпадение волос.[49] При достижении человеком двадцати лет обычно меняются цвет волос, кожа и голос. Средняя продолжительность жизни человека с таким заболеванием составляет около 40-46 лет.[53] Это состояние также может повлиять на пропорции тела и распределение веса по нему.[54] Страдающие синдромом Вернера подвержены повышенному риску развития катаракты глаз, диабета 2 типа, различных типов рака и атеросклероза.[52] Тот факт, что белок взаимодействует с ДНК-PKcs и белковым Ku-комплексом, в сочетании с доказательством того, что WRN-дефицитные клетки производят обширные делеции в местах присоединений негомологичных концов ДНК, указывает на роль белка WRN в процессе репарации ДНК негомологичного соединения концов.[55] Белок WRN также, судя по всему, играет роль в разрешении рекомбинационных промежуточных структур во время гомологичной рекомбинационной репарации двухцепочечных разрывов ДНК.[55]
Синдром Блума — крайне редкое аутосомно-рецессивное заболевание, характеризующееся низким ростом его носителя, хромосомной нестабильностью, предрасположенностью к раку и даже чувствительностью к солнцу.[56] Заболевшие таким синдромом могут иметь проблемы с обучаемостью и обучением, а также повышенный риск развития хронической обструктивной болезни легких (ХОБЛ) и иных заболеваний.[57]
Синдром Кокейна — это гомозиготная или гетерозиготная мутация, приводящая к появлению низкого роста и отклонениям в размере черепа, а так же медленному умственному и физическому развитию.[58]
Синдром Ротмунда-Томсона является крайне редким аутосомно-рецессивное заболеванием, поражающим кожу его носителя. Для данного заболевания характерно наличие следующих симптомов: ювенильная катаракта, редкие волосы, задержка роста и аномалии в строении скелета.[59]
Биогеронтология[править | править код]
Теории старения помогают учёным понять и найти методы лечения возрастных состояний:
- Те, кто верит в идею, что старение является неизбежным побочным эффектом некоторой необходимой функции (антагонистическая плейотропия или теории одноразовой сомы), логически склонны полагать, что попытки замедлить старение приведут к неприемлемым побочным эффектам для необходимых функций. Поэтому изменить старение «невозможно»[1] а изучение механизмов старения представляет только академический интерес.
- Те, кто верит в теории множественных механизмов обслуживания по умолчанию, склонны полагать, что можно найти способы улучшить работу некоторых из этих механизмов. Возможно, им могут помочь антиоксиданты или другие агенты.
- Те, кто верит в запрограммированное старение, полагают, что можно найти способы вмешаться в работу той части механизма старения, которая, по-видимому, является общей для множества симптомов, по существу «замедляя часы» и задерживая множественные проявления. Такой эффект можно получить, обманывая смысловую функцию. Одна из таких попыток — попытка найти «миметик», который «имитировал бы» антивозрастной эффект ограничения калорий без необходимости радикального ограничения диеты.[60].
Критика[править | править код]
Теория эволюционного возникновения старения как результата накопления вредных мутаций, которые могут быть фенотипически реализованы только в поздние периоды жизни, построена на взгляде на старение как на продолжительность существования сомы. Учёные противопоставляют этой теории ряд серьёзных возражений[61]:
- согласно теории сомы, смертность после того, как тот или иной вид достигает зрелости, должна быть постоянной вплоть до того возраста, когда она резко повышается. Лабораторные исследования и показатели в человеческих популяциях показывают, что смертность растёт сразу после того, как особь достигает взрослого состояния, в графиках роста популяций нет никаких особых точек вплоть до предельных возрастов, которые в естественных условиях для организмов недостижимы;
- каким образом естественный отбор может привести к настройке механизма, который ограничивает жизнь? Например, мыши могут прожить около трех лет в лабораторных условиях, тогда как в естественной среде они, как правило, погибают от хищников и других причин гораздо раньше. Эволюционный процесс оказывается исключённым из теории.
- всё, что относится к поздним периодам жизни, достичь которых в природе особи не могут, выносится за рамки естественного отбора, действующего в природной среде.
- чрезмерное упрощение допущения независимости биологических функций друг от друга без учёта «множества регуляторных обратных связей между функциями».
См. также[править | править код]
Ссылки[править | править код]
- Evolutionary Theories of Aging and Longevity
- The Evolutionary Theory of Aging от João Pedro de Magalhães.
- Programmed-Aging.Org Сайт предоставляет полную информацию о запрограммированном старении, противоречиях между запрограммированным и незапрограммированным старением, а также о противоречиях, лежащих в основе эволюции.
- How Evolutionary Thinking Affects People’s Ideas About Aging Interventions
- AnAge Animal Ageing and Longevity Database Предоставляет максимальный наблюдаемый возраст и возраст половой зрелости для многих животных.
- The Case for Programmed Mammal Aging Описываются эмпирические данные, эволюционное обоснование и историческая перспектива, поддерживающие программированное старение у млекопитающих.
- Life Table for USA 2005 Вероятность смерти в зависимости от возраста
Литература[править | править код]
- Human Sociobiology and Group Selection Theory // On Human Nature Biology, Psychology, Ethics, Politics, and Religion. — Elsevier, 2017. — P. 383–396. — ISBN 978-0-12-420190-3. — doi:10.1016/b978-0-12-420190-3.00023-5.
- Jin K (October 2010). "Modern Biological Theories of Aging". Aging and Disease. 1 (2): 72—74. PMC 2995895. PMID 21132086.
- Gavrilova NS, Gavrilov LA, Semyonova VG, Evdokushkina GN (June 2004). "Does exceptional human longevity come with a high cost of infertility? Testing the evolutionary theories of aging". Annals of the New York Academy of Sciences. 1019 (1): 513—7. Bibcode:2004NYASA1019..513G. CiteSeerX 10.1.1.10.7390. doi:10.1196/annals.1297.095. PMID 15247077.
- Human longevity and reproduction: An evolutionary perspective. // Grandmotherhood - The Evolutionary Significance of the Second Half of Female Life.. — New Brunswick, NJ, USA : Rutgers University Press, 2005. — P. 59–80.
- Evolution of Aging // Encyclopedia of Aging. — New York : Macmillan Reference USA, 2002. — Vol. 2. — P. 458–467.
- Gavrilov LA, Gavrilova NS (February 2002). "Evolutionary theories of aging and longevity". TheScientificWorldJournal. 2: 339—56. doi:10.1100/tsw.2002.96. PMC 6009642. PMID 12806021.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - Gavrilova NS, Gavrilov LA, Evdokushkina GN, Semyonova VG, Gavrilova AL, Evdokushkina NN, Kushnareva YE, Kroutko VN (August 1998). "Evolution, mutations, and human longevity: European royal and noble families". Human Biology. 70 (4): 799—804. PMID 9686488.
Примечания[править | править код]
- ↑ 1 2 3 4 Williams, George C. (December 1957). "Pleiotropy, Natural Selection, and the Evolution of Senescence". Evolution. 11 (4): 398—411. doi:10.1111/j.1558-5646.1957.tb02911.x.
- ↑ 1 2 Kirkwood, T. B. L. (November 1977). "Evolution of ageing". Nature. 270 (5635): 301—4. Bibcode:1977Natur.270..301K. doi:10.1038/270301a0. PMID 593350.
- ↑ Medawar P.B. (1952). An Unsolved Problem of Biology. Published for the college by H. K. Lewis, London
- ↑ Johnson, Adiv A. (2019-11-01). "Revamping the evolutionary theories of aging". Ageing Research Reviews (англ.). 55: 100947. doi:10.1016/j.arr.2019.100947. ISSN 1568-1637. PMID 31449890.
- ↑ 1 2 Yang, Jiang-Nan (2013). "Viscous populations evolve altruistic programmed ageing in ability conflict in a changing environment". Evolutionary Ecology Research. 15: 527—543. Архивировано из оригинала 11 августа 2017. Дата обращения: 26 ноября 2021.
- ↑ 1 2 Everman, Elizabeth R. (2018-01-10). "Antagonistic pleiotropy and mutation accumulation contribute to age‐related decline in stress response". Evolution. 72 (2): 303—317. doi:10.1111/evo.13408. ISSN 0014-3820. PMID 29214647.
- ↑ 1 2 3 Charlesworth, B. (2001-05-07). "Patterns of age-specific means and genetic variances of mortality rates predicted by the mutation-accumulation theory of ageing". Journal of Theoretical Biology. 210 (1): 47—65. doi:10.1006/jtbi.2001.2296. ISSN 0022-5193. PMID 11343430.
- ↑ Drost, J. B. (1995). "Biological basis of germline mutation: comparisons of spontaneous germline mutation rates among drosophila, mouse, and human". Environmental and Molecular Mutagenesis. 25 Suppl 26: 48—64. doi:10.1002/em.2850250609. ISSN 0893-6692. PMID 7789362.
- ↑ 1 2 Flatt, Thomas (2018-08-20). "Horizons in the evolution of aging". BMC Biology. 16 (1): 93. doi:10.1186/s12915-018-0562-z. ISSN 1741-7007. PMID 30124168.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Moorad, Jacob A. (2008-07-27). "A Theory of Age-Dependent Mutation and Senescence". Genetics. 179 (4): 2061—2073. doi:10.1534/genetics.108.088526. ISSN 0016-6731. PMID 18660535.
- ↑ Kraemer, Susanne A. (December 2017). "Fitness change in relation to mutation number in spontaneous mutation accumulation lines of Chlamydomonas reinhardtii". Evolution; International Journal of Organic Evolution. 71 (12): 2918—2929. doi:10.1111/evo.13360. ISSN 0014-3820. PMID 28884790.
- ↑ 1 2 3 Dańko, Maciej Jan (2012-04-06). "Mutation Accumulation May Be a Minor Force in Shaping Life History Traits". PLOS ONE. 7 (4): e34146. Bibcode:2012PLoSO...734146D. doi:10.1371/journal.pone.0034146. ISSN 1932-6203. PMID 22493680.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ Rifkin, Scott A. (November 2005). "A mutation accumulation assay reveals a broad capacity for rapid evolution of gene expression". Nature (англ.). 438 (7065): 220—223. Bibcode:2005Natur.438..220R. doi:10.1038/nature04114. ISSN 1476-4687. PMID 16281035. Архивировано из оригинала 25 ноября 2021. Дата обращения: 26 ноября 2021.
- ↑ Nei, Masatoshi (2007-07-24). "The new mutation theory of phenotypic evolution". Proceedings of the National Academy of Sciences (англ.). 104 (30): 12235—12242. Bibcode:2007PNAS..10412235N. doi:10.1073/pnas.0703349104. ISSN 0027-8424. PMID 17640887.
- ↑ "Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2". Proceedings of the National Academy of Sciences of the United States of America. 94 (7): 3122—7. April 1997. doi:10.1073/pnas.94.7.3122. PMID 9096356.
- ↑ "Antagonistic pleiotropy as a widespread mechanism for the maintenance of polymorphic disease alleles". BMC Medical Genetics. 12: 160. December 2011. doi:10.1186/1471-2350-12-160. PMID 22151998.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Long-term laboratory evolution of a genetic life-history tradeoff in Drosophila melanogaster. 1. The role of genotype-by-environment interaction". Evolution; International Journal of Organic Evolution. 48 (4): 1244—1257. August 1994. doi:10.1111/j.1558-5646.1994.tb05309.x. PMID 28564485.
- ↑ "The disposable soma theory revisited: time as a resource in the theories of aging". Cell Cycle. 10 (22): 3853—6. November 2011. doi:10.4161/cc.10.22.18302. PMID 22071624.
- ↑ "Disposable Soma Theory and the Evolution of Maternal Effects on Ageing". PLOS ONE. 11 (1): e0145544. 2016-01-11. Bibcode:2016PLoSO..1145544V. doi:10.1371/journal.pone.0145544. PMID 26752635.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ The Retardation of Aging and Disease by Dietary Restriction.
- ↑ "The retardation of aging by caloric restriction: studies in rodents and primates". Toxicologic Pathology. 24 (6): 742—5. 1996. doi:10.1177/019262339602400618. PMID 8994305.
- ↑ "Overview of caloric restriction and ageing". Mechanisms of Ageing and Development. 126 (9): 913—22. September 2005. doi:10.1016/j.mad.2005.03.012. PMID 15885745. Overview of caloric restriction and aging.
- ↑ Atig, R. Kefi-Ben (2009). "[Mitochondrial DNA: properties and applications]". Archives de l'Institut Pasteur de Tunis. 86 (1—4): 3—14. ISSN 0020-2509. PMID 20707216.
- ↑ Maynard, Scott (October 2015). "DNA Damage, DNA Repair, Aging, and Neurodegeneration". Cold Spring Harbor Perspectives in Medicine. 5 (10): a025130. doi:10.1101/cshperspect.a025130. ISSN 2157-1422. PMID 26385091.
- ↑ "DNA damage as the primary cause of aging". The Quarterly Review of Biology. 56 (3): 279—303. September 1981. doi:10.1086/412317. PMID 7031747.
- ↑ "Low level of U.V.-induced unscheduled DNA synthesis in postmitotic brain cells of hamsters: possible relevance to aging". Experimental Gerontology. 16 (2): 199—207. 1981. doi:10.1016/0531-5565(81)90046-2. PMID 7286098.
- ↑ "Developmental decline in DNA repair in neural retina cells of chick embryos. Persistent deficiency of repair competence in a cell line derived from late embryos". The Journal of Cell Biology. 74 (1): 274—86. July 1977. doi:10.1083/jcb.74.1.274. PMID 559680.
- ↑ "Age-related loss of DNA repair synthesis in isolated rat myocardial cells". Experimental Cell Research. 96 (2): 412—6. December 1975. doi:10.1016/0014-4827(75)90276-1. PMID 1193184.
- ↑ Rodier, Francis (2007-12-15). "Two faces of p53: aging and tumor suppression". Nucleic Acids Research (англ.). 35 (22): 7475—7484. doi:10.1093/nar/gkm744. ISSN 0305-1048. PMID 17942417.
- ↑ Tower, John (September 2015). "Programmed cell death in aging". Ageing Research Reviews. 23 (Pt A): 90—100. doi:10.1016/j.arr.2015.04.002. ISSN 1568-1637. PMID 25862945.
- ↑ Sahin, Ergün (2011-02-17). "Telomere dysfunction induces metabolic and mitochondrial compromise". Nature. 470 (7334): 359—365. Bibcode:2011Natur.470..359S. doi:10.1038/nature09787. ISSN 1476-4687. PMID 21307849.
- ↑ Petruseva, I. O. (2017). "Genome Stability Maintenance in Naked Mole-Rat". Acta Naturae. 9 (4): 31—41. doi:10.32607/20758251-2017-9-4-31-41. ISSN 2075-8251. PMID 29340215.
- ↑ "Mammal aging: active and passive mechanisms". Journal of Bioscience Hypotheses. 2 (2): 59—64. 2009. doi:10.1016/j.bihy.2008.12.002. Article compares programmed and non-programmed maintenance theories of ageing in light of empirical evidence.
- ↑ "Aging is no longer an unsolved problem in biology". Annals of the New York Academy of Sciences. 1067 (1): 1—9. May 2006. Bibcode:2006NYASA1067....1H. doi:10.1196/annals.1354.002. PMID 16803964.
- ↑ Hamilton, W.D. (September 1966). "The moulding of senescence by natural selection". Journal of Theoretical Biology. 12 (1): 12—45. doi:10.1016/0022-5193(66)90184-6. ISSN 0022-5193. PMID 6015424.
- ↑ Flatt, Thomas (October 2009). "Integrating evolutionary and molecular genetics of aging". Biochimica et Biophysica Acta (BBA) - General Subjects. 1790 (10): 951—962. doi:10.1016/j.bbagen.2009.07.010. ISSN 0304-4165. PMID 19619612.
- ↑ Mitteldorf J (2006). "Chaotic population dynamics and the evolution of ageing: proposing a demographic theory of senescence". Evolutionary Ecology Research. 8: 561—74. Архивировано из оригинала 16 мая 2021. Дата обращения: 26 ноября 2021. On population dynamics as a mechanism for the evolution of ageing.
- ↑ "Rethinking the evolutionary theory of aging: transfers, not births, shape senescence in social species". Proceedings of the National Academy of Sciences of the United States of America. 100 (16): 9637—42. August 2003. Bibcode:2003PNAS..100.9637L. doi:10.1073/pnas.1530303100. PMID 12878733.
- ↑ "Aging is a specific biological function rather than the result of a disorder in complex living systems: biochemical evidence in support of Weismann's hypothesis". Biochemistry. Biokhimiia. 62 (11): 1191—5. November 1997. PMID 9467841.
- ↑ "Aging, evolvability, and the individual benefit requirement; medical implications of aging theory controversies". Journal of Theoretical Biology. 252 (4): 764—8. June 2008. doi:10.1016/j.jtbi.2008.02.035. PMID 18396295.
- ↑ "Keeping up with the Red Queen: the pace of aging as an adaptation". Biogerontology. 18 (4): 693—709. August 2017. doi:10.1007/s10522-016-9674-4. PMID 28013399.
- ↑ NCI Dictionary of Cancer Terms (англ.). National Cancer Institute (2 февраля 2011). Дата обращения: 11 апреля 2020. Архивировано 13 августа 2020 года.
- ↑ Medvedev, Zhores A. (1981). "On the immortality of the germ line: Genetic and biochemical mechanisms. A review". Mechanisms of Ageing and Development. 17 (4): 331—359. doi:10.1016/0047-6374(81)90052-X. ISSN 0047-6374. PMID 6173551.
- ↑ Carrero, Dido (2016-07-01). "Hallmarks of progeroid syndromes: lessons from mice and reprogrammed cells". Disease Models & Mechanisms (англ.). 9 (7): 719—735. doi:10.1242/dmm.024711. ISSN 1754-8403. PMID 27482812.
- ↑ Progeria (англ.). WebMD. Дата обращения: 11 апреля 2020. Архивировано 11 апреля 2020 года.
- ↑ Hutchinson-Gilford progeria syndrome. Genetics Home Reference. Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ King RC. A dictionary of genetics. — 2013. — ISBN 978-0-19-937686-5.
- ↑ Reference. Hutchinson-Gilford progeria syndrome (англ.). Genetics Home Reference. Дата обращения: 11 апреля 2020. Архивировано 10 апреля 2020 года.
- ↑ 1 2 3 McDonald RB. Biology of aging. — ISBN 978-0-8153-4567-1.
- ↑ Redwood AB, Perkins SM, Vanderwaal RP, Feng Z, Biehl KJ, Gonzalez-Suarez I, Morgado-Palacin L, Shi W, Sage J, Roti-Roti JL, Stewart CL, Zhang J, Gonzalo S (27 October 2014). "A dual role for A-type lamins in DNA double-strand break repair". Cell Cycle. 10 (15): 2549—2560. doi:10.4161/cc.10.15.16531. PMC 3180193. PMID 21701264
- ↑ 1 2 Liu B, Wang J, Chan KM, Tjia WM, Deng W, Guan X, Huang J-d, Li KM, Chau PY, Chen DJ, Pei D, Pendas AM, Cadiñanos J, López-Otín C, Tse HF, Hutchison C, Chen J, Cao Y, Cheah KSE, Tryggvason K, Zhou Z (26 June 2005). "Genomic instability in laminopathy-based premature aging". Nature Medicine. 11 (7): 780—785. doi:10.1038/nm1266. PMID 15980864. S2CID 11798376
- ↑ 1 2 Werner syndrome (англ.). Genetics Home Reference. Дата обращения: 11 апреля 2020. Архивировано 20 февраля 2018 года.
- ↑ Yamamoto, K. (December 2003). "A report of two cases of Werner's syndrome and review of the literature". Journal of Orthopaedic Surgery (Hong Kong). 11 (2): 224—233. doi:10.1177/230949900301100222. ISSN 1022-5536. PMID 14676353.
- ↑ "Molecular bases of progeroid syndromes". Human Molecular Genetics. 15 (suppl_2): R151—61. October 2006. doi:10.1093/hmg/ddl214. PMID 16987878.
- ↑ 1 2 Thompson LH, Schild D. Recombinational DNA repair and human disease. Mutat Res. 2002 Nov 30;509(1-2):49-78. doi: 10.1016/s0027-5107(02)00224-5. PMID 12427531
- ↑ OMIM Entry - # 210900 - BLOOM SYNDROME; BLM. omim.org. Дата обращения: 11 апреля 2020.
- ↑ Bloom syndrome (англ.). Genetics Home Reference. Дата обращения: 11 апреля 2020. Архивировано 11 апреля 2020 года.
- ↑ OMIM Entry - # 216400 - COCKAYNE SYNDROME A; CSA. omim.org. Дата обращения: 11 апреля 2020.
- ↑ Rothmund-Thomson syndrome (англ.). Genetics Home Reference. Дата обращения: 11 апреля 2020. Архивировано 11 апреля 2020 года.
- ↑ "SIR2: a potential target for calorie restriction mimetics". Trends in Molecular Medicine. 13 (2): 64—71. February 2007. doi:10.1016/j.molmed.2006.12.004. PMID 17207661.
- ↑ А. Г. Голубев. Эволюция продолжительности жизни и старения // «Биосфера» : Междисциплинарный научный и прикладной журнал. — 2011. — Т. 3, № 3. — С. 336-368. — ISSN 2077-1460. Архивировано 26 декабря 2021 года.
