Карбид кремния
| Карбид кремния | |
|---|---|
 | |
| Общие | |
| Хим. формула | SiC |
| Физические свойства | |
| Состояние | кристаллы, друзы или кристаллические порошки от прозрачного белого, жёлтого, зелёного или тёмно-синего до чёрного цветов, в зависимости от чистоты, дисперсности, аллотропных и политипных модификаций. |
| Молярная масса | 40,0962 г/моль |
| Плотность | 3,21 г/см³[1] |
| Твёрдость | 9,5 |
| Энергия ионизации | 9,3 ± 0,1 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | (с разл.) 2730 °C |
| • сублимации | 4892 ± 1 ℉[2] |
| Давление пара | 0 ± 1 мм рт.ст.[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| • в кислотах | нерастворим |
| Оптические свойства | |
| Показатель преломления | 2,55[3] |
| Классификация | |
| Рег. номер CAS | 409-21-2 |
| PubChem | 9863 |
| Рег. номер EINECS | 206-991-8 |
| SMILES | |
| InChI | |
| RTECS | VW0450000 |
| ChEBI | 29390 |
| ChemSpider | 9479 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, в микроэлектронике (в силовых установках электроавтомобилей), для имитирующих алмаз вставок в ювелирные украшения.
Открытие и начало производства[править | править код]

О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (фр. César Despretz; 1849), Марсден (англ. Robert Sydney Marsden; 1880) и Колсон (англ. Robert Sydney Marsden; 1882 год)[4]. Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893 году. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893 года[5]. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива[6].
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках[7]. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году[8].
Формы нахождения в природе[править | править код]

Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в виде небольших шестиугольных пластинчатых включений в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был назван минерал в 1905 году[9]. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество)[10].
Хоть карбид кремния и является редким веществом на Земле, он широко распространён в космосе. Это вещество встречается в пылевых облаках вокруг богатых углеродом звёзд, также его много в первозданных, не подвергшихся изменениям, метеоритах (почти исключительно в форме бета-полиморфа). Анализ зёрен карбида кремния, найденных в углеродистом хондритовом метеорите Мёрчисон, показал аномальное изотопное соотношение углерода и кремния, что указывает на происхождение данного вещества за пределами Солнечной системы: 99 % зёрен SiC образовалось около богатых углеродом звёзд, принадлежащих к асимптотической ветви гигантов[11]. Карбид кремния можно часто обнаружить вокруг таких звёзд по их ИК-спектрам[12].
Производство[править | править код]
Из-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:

Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала[13].

Чистый карбид кремния можно получить с помощью так называемого процесса Лели[14], в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2 см × 2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре[15]. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров[13][16].
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику[17][18][19][20].
Структура и свойства[править | править код]
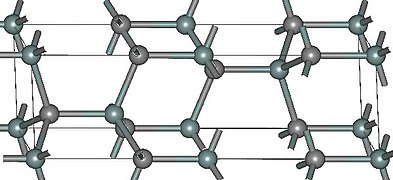
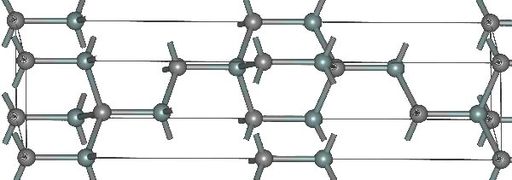
- Структуры основных политипов SiC
-
(β)3C-SiC
-
4H-SiC
-
(α)6H-SiC
Известно примерно 250 кристаллических форм карбида кремния[21]. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности[22].
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C[23]. До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается. Нагревание бета-формы до температур свыше 1700 °C способно приводить к постепенному переходу кубической бета-формы в гексагональную (2Н, 4Н, 6Н, 8Н) и ромбичеcкую (15R).[24] При повышении температуры и времени процесса все образующиеся формы переходят в конечном итоге в гексагональный альфа-политип 6Н.[25]
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристаллическая структура | Кубическая | Гексагональная | Гексагональная |
| Пространственная группа | |||
| Символ Пирсона | cF8 | hP8 | hP12 |
| Постоянные решётки (Å) | 4,3596 | 3,0730; 10,053 | 3,0810; 15,12 |
| Плотность (г/см3) | 3,21 | 3,21 | 3,21 |
| Ширина запрещённой зоны (эВ) | 2,36 | 3,23 | 3,05 |
| МОС (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт/(см·К)) | 3,6 | 3,7 | 4,9 |
Чистый карбид кремния бесцветен. Его оттенки от коричневого до чёрного цвета связаны с примесями железа. Радужный блеск кристаллов обусловливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя.
Карбид кремния является весьма инертным химическим веществом: практически не взаимодействует с большинством кислот, кроме концентрированных фтористоводородной (плавиковой), азотной и ортофосфорной кислот. Способен выдерживать нагревание на открытом воздухе до температур порядка 1500 °C. Карбид кремния не плавится при любом известном давлении, но способен сублимировать при температурах свыше 1700 °C. Высокая термическая устойчивость карбида кремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей.
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где высокая теплопроводность, высокое электрическое напряжение пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств[28], в том числе при создании сверхмощных светодиодов. Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0⋅10−6 K−1) и в достаточно широком температурном диапазоне эксплуатации не испытывает фазовых переходов (в том числе фазовых переходов второго рода), из-за которых может произойти разрушение монокристаллов[13].
Электропроводность[править | править код]
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей. Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия[3]. Металлическая проводимость была достигнута за счёт сильного легирования бором, алюминием и азотом.
Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К[29].
Физические свойства[править | править код]
Карбид кремния является твёрдым, тугоплавким веществом. Кристаллическая решётка аналогична решётке алмаза. Является полупроводником.[30]
- Стандартная энтальпия образования (298 К): −66,1 кДж/моль[31].
- Стандартная энергия Гиббса образования (298 К): −63,7 кДж/моль[31].
- Стандартная энтропия образования (298 К): 16,61 Дж/(моль·K)[31].
- Стандартная мольная теплоемкость (298 К): 26,86 Дж/(моль·K)[31].
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/(г·форм[прояснить])[32].
Химические свойства[править | править код]
По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленной некоторым различием в электроотрицательностях атомов Si и C, не превышает 10—12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твёрдостью. В инертной атмосфере карбид кремния разлагается только при очень высокой температуре:
- .
Сильно перегретый пар разлагает карбид кремния:
- .
Концентрированные кислоты и их смеси растворяют карбид кремния:
- .
В присутствии кислорода щёлочи растворяют карбид кремния:
- .
При нагревании реагирует с кислородом:
с галогенами:
с азотом, образуя нитрид кремния:
с активными металлами:
и их пероксидами:
- .
Применение[править | править код]
Абразивные и режущие инструменты[править | править код]

В современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости. В обрабатывающей промышленности из-за его высокой твёрдости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки[33].
Суспензии мелкодисперсных порошков карбида кремния в масле, глицерине или этиленгликоле используются в процессе проволочной резки полупроводниковых монокристаллов на пластины.
В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей[34].
Конструкционные материалы[править | править код]

Карбид кремния наряду с карбидом вольфрама и другими износостойкими материалами применяется для создания торцевых механических уплотнений.
В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе. Планировалось, что разработанные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов. Тем не менее, ни один из этих проектов не привёл к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния[35].
Подобно другим высокотвёрдым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Шкура дракона», созданном компанией Pinnacle Armor, используются диски из карбида кремния[36].
Автомотодетали[править | править код]

Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод», становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе Porsche Carrera GT, Bugatti Veyron, Chevrolet Corvette ZR1, Bentley, Ferrari, Lamborghini[37]. Карбид кремния используется также в спечённых формах в дизельных фильтрах для очистки от твёрдых частиц[38][уточнить].
Электроника и электротехника[править | править код]
Первыми электрическими устройствами из SiC были нелинейные элементы варисторы и вентильные разрядники (см. также: тирит, вилит, лэтин, силит) для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита — смеси SiC и связующего. Варистор обладает высоким сопротивлением до тех пор, пока напряжение на нём не достигнет определённого порогового значения VT, после чего его сопротивление падает до более низкого уровня и поддерживает это значение, пока приложенное напряжение не упадёт ниже VT[39].
- Электронные приборы

Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, n-МОП транзисторах и в высокотемпературных тиристорах[40]. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества:
- в несколько раз большая ширина запрещённой зоны;
- в 10 раз большая электрическая прочность;
- высокие допустимые рабочие температуры (до 600 °C);
- теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия;
- устойчивость к воздействию радиации;
- стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени.
Из почти 250 модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC.
Проблемы с сопряжением элементов, основанных на диоксиде кремния, препятствуют развитию n-МОП транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро[прояснить][41].
История светодиодов из SiC весьма примечательна: впервые свечение в SiC было обнаружено Х. Роундом в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Жёлтые светодиоды из 3C-SiC были изготовлены в СССР в 1970-х годах[42], а синие (из 6H-SiC) по всему миру — в 1980-х годах[43]. Производство вскоре остановилось, потому что нитрид галлия показал в 10—100 раз более яркую эмиссию. Эта разница в эффективности связана с неблагоприятной непрямой запрещённой зоной SiC, в то время как нитрид галлия имеет прямую запрещённую зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по-прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах[43].
Астрономия и точная оптика[править | править код]
Жесткость, высокая теплопроводность и низкий коэффициент теплового расширения делают карбид кремния термостабильным материалом в широком диапазоне рабочих температур. Это обуславливает широкое применение карбидкремниевых матриц для изготовления зеркальных элементов в различных оптических системах, например, в астрономических телескопах или в системах передачи энергии с использованием лазерного излучения. Развитие технологий (химическое осаждение паров) позволяет создавать диски из поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркал могут формироваться различными методами, включая прессование чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов (например, Gaia) уже оснащены оптикой из карбида кремния, покрытого алюминием[44][45].
Пирометрия[править | править код]

Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K[46][47].
Нагревательные элементы[править | править код]
Первые упоминания об использовании карбида кремния для изготовления нагревательных элементов относятся к началу 20 века, когда они были изготовлены The Carborundum Company в США и EKL в Берлине[источник не указан 3657 дней].
В настоящее время карбид кремния является одним из типичных материалов для изготовления нагревательных элементов, способных работать при температурах до 1400 °C на воздухе и до 2000 °C в нейтральной или восстановительной среде[источник не указан 3657 дней], что заметно выше, чем доступно для многих металлических нагревателей[источник не указан 3657 дней].
Нагревательные элементы из карбида кремния используются при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т. д.[48]
Ядерная энергетика[править | править код]
Благодаря высокой устойчивости к воздействию внешних неблагоприятных факторов, включая природные, высокой прочности и твёрдости, низкому коэффициенту теплового расширения и низкому коэффициенту диффузии примесей и продуктов деления реакционноспечённый карбид кремния нашёл применение в ядерной энергетике[49].
Карбид кремния, наряду с другими материалами, используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных реакторах, в том числе в газоохлаждаемых реакторах[источник не указан 470 дней].
Из карбида кремния изготавливаются пеналы для длительного хранения и захоронения ядерных отходов[источник не указан 470 дней].
Ювелирные изделия[править | править код]

Как ювелирный камень карбид кремния используется в ювелирном деле под названием «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и твёрд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза).
Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление. Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях. По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления. Муассанит имеет более низкую плотность 3,21 г/см3 (против 3,53 г/см3 для алмаза) и гораздо более устойчив к теплу. В результате получается камень с большим блеском минерала, с чёткими гранями и хорошей устойчивостью к внешним воздействиям. В отличие от алмаза, который горит при температуре 800 °C, муассанит остаётся неповреждённым вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота). Муассанит стал популярен как заменитель алмаза и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зелёной или жёлтой флуоресценции в ультрафиолетовом свете[50].
Производство стали[править | править код]
Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище, чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом[51].
Катализатор[править | править код]
Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид[52][53].
Производство графена[править | править код]
Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений[54][55]. Высокая температура (2830 °C, как выше указано в реакции) приводит к разложению карбида кремния. Кремний как более летучий элемент уходит из приповерхностных слоёв, оставляя одно- или многослойный графен, нижние из которых сильно связаны с объёмным кристалом. В качестве исходного материала используют монокристаллы 6H-SiC(0001), на поверхности которых формировались террасы графена в результате термообработки с размерами около 1 мкм, разделённые областями с несколькими слоями[56].
Применение в строительстве[править | править код]
Может использоваться в качестве фибры в фибробетоне (аналогично базальтовому волокну)[57].
См. также[править | править код]
Примечания[править | править код]
- ↑ Patnaik, P. Handbook of Inorganic Chemicals (англ.). — McGraw-Hill Education, 2002. — ISBN 0070494398.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0555.html
- ↑ 1 2 Properties of Silicon Carbide (SiC) (англ.). Ioffe Institute. Архивировано 24 апреля 2012 года.
- ↑ Weimer, A. W. Carbide, nitride, and boride materials synthesis and processing (англ.). — Springer, 1997. — P. 115. — ISBN 0412540606.
- ↑ Acheson, G. (1893) U.S. Patent 492 767 «Production of artificial crystalline carbonaceous material» (англ.).
- ↑ "The Manufacture of Carborundum — a New Industry" (англ.). 1894-07-04. Архивировано из оригинала 23 января 2009.
- ↑ Dunwoody, Henry H. C. (1906) U.S. Patent 837 616 «Wireless telegraph system» (silicon carbide detector) (англ.).
- ↑ Hart, Jeffrey A.; Stefanie Ann Lenway, Thomas Murtha.: A History of Electroluminescent Displays (англ.). Архивировано 24 апреля 2012 года.
- ↑ Moissan, Henri. Nouvelles recherches sur la météorité de Cañon Diablo (фр.) // Comptes rendus : magazine. — 1904. — Vol. 139. — P. 773—786. Архивировано 2 декабря 2019 года.
- ↑ Di Pierro S. et al. Rock-forming moissanite (natural α-silicon carbide) (итал.) // American Mineralogist : diario. — 2003. — V. 88. — P. 1817—1821. Архивировано 24 сентября 2015 года.
- ↑ Alexander C. M. O'D. In situ measurement of interstellar silicon carbide in two CM chondrite meteorites (англ.) // Nature : journal. — 1990. — Vol. 348. — P. 715—717. — doi:10.1038/348715a0.
- ↑ Jim Kelly. The Astrophysical Nature of Silicon Carbide. Архивировано 4 мая 2017 года.
- ↑ 1 2 3 Harris, Gary Lynn. Properties of silicon carbide (англ.). — United Kingdom: IEE, 1995. — 282 с. — P. 19; 170—180. — ISBN 0852968701.
- ↑ Lely, Jan Anthony. Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen (нем.) // Berichte der Deutschen Keramischen Gesellschaft : Журнал. — 1955. — H. 32. — S. 229—236.
- ↑ N. Ohtani, T. Fujimoto, T. Aigo, M. Katsuno, H. Tsuge, H. Yashiro. Large high-quality silicon carbide substrates (англ.) // Nippon Steel Technical Report. — 2001. — No. 84. Архивировано 4 марта 2012 года.
- ↑ Byrappa, K.; Ohachi, T. Crystal growth technology (англ.). — Springer, 2003. — P. 180—200. — ISBN 3540003673.
- ↑ Pitcher, M. W.; Joray, S. J.; Bianconi, P. A. Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne) (англ.) // журнал Advanced Materials. — 2004. — P. 706. — doi:10.1002/adma.200306467.
- ↑ Park, Yoon-Soo. SiC materials and devices (англ.). — Academic Press, 1998. — P. 20—60. — ISBN 0127521607.
- ↑ Bunsell, A. R.; Piant, A. A review of the development of three generations of small diameter silicon carbide fibres (англ.) // Journal of Materials Science. — 2006. — P. 823. — doi:10.1007/s10853-006-6566-z.
- ↑ Laine, Richard M. Preceramic polymer routes to silicon carbide (англ.). — Babonneau, Florence: Chemistry of Materials, 1993. — P. 260. — doi:10.1021/cm00027a007.
- ↑ Cheung, Rebecca. Silicon carbide microelectromechanical systems for harsh environments (англ.). — Imperial College Press, 2006. — P. 3. — ISBN 1860946240.
- ↑ Morkoç, H.; Strite, S.; Gao, G. B.; Lin, M. E.; Sverdlov, B.; Burns, M. Large-band-gap SiC, III-V nitride, and II-VI ZnSe-based semiconductor device technologies (англ.). — Journal of Applied Physics, 1994. — P. 1363. — doi:10.1063/1.358463.
- ↑ Muranaka, T. Superconductivity in carrier-doped silicon carbide (англ.). — Sci. Technol. Adv. Mater., 2008. — doi:10.1088/1468-6996/9/4/044204.
- ↑ Карбид кремния / под ред. Г. Хенита и Р. Рол, пер. с англ. — М.: Мир, 1972. — 349 с., с ил. — С. 119—128.
- ↑ Г. Г. Гнесин. Карбидокремниевые материалы. — М.: Металлургия, 1977. — 216 с., с ил.
- ↑ Properties of Silicon Carbide (SiC) (англ.). Ioffe Institute. Дата обращения: 6 июня 2009. Архивировано 24 апреля 2012 года.
- ↑ Yoon-Soo Park, Willardson, Eicke R. Weber. SiC materials and devices (англ.). — Academic Press, 1998. — P. 1—18. — ISBN 0127521607.
- ↑ Bhatnagar, M.; Baliga, B. J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices (англ.). — IEEE Transactions on Electron Devices, 1993. — Iss. 3. — P. 645—655. — doi:10.1109/16.199372. Архивировано 1 сентября 2010 года.
- ↑ Kriener, M. Superconductivity in heavily boron-doped silicon carbide (англ.) // Sci. Technol. Adv. Mater. : журнал. — 2008. — Iss. 9. — P. 044205. — doi:10.1088/1468-6996/9/4/044205.
- ↑ Важнейшие соединения кремния. Дата обращения: 24 мая 2010. Архивировано 13 октября 2007 года.
- ↑ 1 2 3 4 Рабинович, В. А. Кремния карбид // Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. — Л. : Химия, 1977. — С. 74.
- ↑ А. М. Голуб. Общая и неорганическая химия = Загальна та неорганична хімія. — Вища школа, 1971. — С. 227. — 443 с. — 6700 экз.
- ↑ Fuster, Marco A. (1997) «Skateboard grip tape», U.S. Patent 5 622 759 (англ.).
- ↑ Bansal, Narottam P. Handbook of ceramic composites (англ.). — Springer, 2005. — P. 312. — ISBN 1402081332.
- ↑ "Ceramics for turbine engines" (англ.). Архивировано из оригинала 6 апреля 2009.
- ↑ Dragon Skin – Most Protective Body Armor – Lightweight (англ.). Future Firepower. Архивировано 24 апреля 2012 года.
- ↑ Top 10 Fast Cars (англ.). Архивировано из оригинала 26 августа 2009 года.
- ↑ O'Sullivan, D.; Pomeroy, M. J.; Hampshire, S.; Murtagh, M. J. Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits (англ.) // MRS proceedings. — 2004. — Iss. 19. — P. 2913—2921. — doi:10.1557/JMR.2004.0373.
- ↑ Whitaker, Jerry C. The electronics handbook (англ.). — CRC Press, 2005. — P. 1108. — ISBN 0849318890.
- ↑ Bhatnagar, M.; Baliga, B. J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices (англ.) // IEEE Transactions on Electron Devices. — 1993. — Iss. 3. — P. 645—655. — doi:10.1109/16.199372. Архивировано 1 сентября 2010 года.
- ↑ Madar, Roland. Materials science: Silicon carbide in contention (англ.) // Nature : Журнал. — 2004-08-26. — Iss. 430. — P. 974—975. — doi:10.1038/430974a.
- ↑ Yellow SiC LED (англ.). Архивировано 24 апреля 2012 года.
- ↑ 1 2 Stringfellow, Gerald B. High brightness light emitting diodes (англ.). — Academic Press, 1997. — P. 48, 57, 425. — ISBN 0127521569.
- ↑ "The largest telescope mirror ever put into space" (англ.). European Space Agency. Архивировано из оригинала 19 октября 2012. Дата обращения: 3 мая 2010.
- ↑ Petrovsky, G. T. 2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope (англ.) // Journal Proc. SPIE. — P. 263. Архивировано 1 октября 2017 года.
- ↑ "Thin-Filament Pyrometry Developed for Measuring Temperatures in Flames" (англ.). NASA. Архивировано из оригинала 15 марта 2012. Дата обращения: 3 мая 2010.
- ↑ Maun, Jignesh D.; Sunderland, P. B.; Urban, D. L. Thin-filament pyrometry with a digital still camera (англ.) // Applied Optics. — 2007. — Iss. 4. — P. 483. — doi:10.1364/AO.46.000483. — PMID 17230239.
- ↑ Yeshvant V. Deshmukh. Industrial heating: principles, techniques, materials, applications, and design. — CRC Press, 2005. — С. 383—393. — ISBN 0849334055.
- ↑ López-Honorato, E. TRISO coated fuel particles with enhanced SiC properties (англ.) // Journal of Nuclear Materials : журнал. — 2009. — P. 219. — doi:10.1016/j.jnucmat.2009.03.013.
- ↑ O'Donoghue, M. Gems (англ.). — Elsevier. — 2006. — P. 89. — ISBN 0-75-065856-8.
- ↑ Silicon carbide (steel industry) (англ.). Архивировано 24 апреля 2012 года.
- ↑ Rase, Howard F. Handbook of commercial catalysts : heterogeneous catalysts : [англ.]. — CRC Press, 2000. — P. 258. — ISBN 0849394171.
- ↑ Singh, S. K. High surface area silicon carbide from rice husk : A support material for catalysts : [англ.] / S. K. Singh, K. M. Parida, B. C. Mohanty … [et al.] // Reaction Kinetics and Catalysis Letters. — 1995. — Vol. 54. — P. 29–34. — doi:10.1007/BF02071177.
- ↑ de Heer, Walt A. Handbook of Nanophysics (англ.). — Epitaxial graphene: Taylor and Francis, 2010. — ISBN 1420075381. (недоступная ссылка)
- ↑ de Heer, Walt A. Epitaxial graphene (англ.) // Solid State Communications. — 2007. — P. 92. — doi:10.1016/j.ssc.2007.04.023. Архивировано 9 декабря 2008 года.
- ↑ Елецкий А. В., Искандарова И. М., Книжник А. А., Красиков Д. Н. Графен: методы получения и теплофизические свойства // Успехи физических наук. — Российская академия наук, 2011. — Т. 181. — С. 227—258. — doi:10.3367/UFNr.0181.201103a.0233. Архивировано 14 декабря 2012 года.
- ↑ 212. К. А. Сарайкина, В. А. Шаманов Дисперсное армирование бетонов // Вестник ПГТУ. Урбанистика. 2011. № 2.
Ссылки[править | править код]
- Kelly, Jim. A brief history of SiC : [арх. 19.01.2008] // Jim Kelly's filing cabinet. — Department of Chemistry, University College London, 2005. — 26 апреля. — Дата обращения: 23.06.2020.
- Карбид кремния: технология, свойства, применение / Под ред. Беляева А. Е., Конаковой Р. В. — Харьков: ИСМА, 2010. — 532 с. — ISBN 978-966-02-5445-9
- Дигонский С. В. Газофазные процессы синтеза и спекания тугоплавких веществ. — М.: ГЕОС, 2013. — 462 с.

![{\displaystyle {\ce {SiO2{}+3C->[1600{-}2500~^{\circ }{\text{C}}]SiC{}+2CO\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c850507c7e35d44f814a1f97b995ef265f9ea254)



![{\displaystyle {\ce {SiC->[2830~^{\circ }{\text{C}}]Si{}+C}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e962a9bb24019ce7eba51bd25e5768f049addb6)
![{\displaystyle {\ce {SiC{}+2H2O->[1300~^{\circ }{\text{C}}]SiO2{}+CH4\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/698716f5e973f973085bacf10da685ce1ba79412)

![{\displaystyle {\ce {3 SiC + 18 HF + 8 HNO3 -> 3 H2[SiF6] + 3 CO2 ^ + 8 NO ^ + 10 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3a9e94be5c8fffec5506ea3472b8df45a5a2e56)

![{\displaystyle {\ce {SiC{}+4NaOH{}+2O2->[>350~^{\circ }{\text{C}}]Na2SiO3{}+Na2CO3{}+2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/842b08daac26c236c68c248e0b9e26a029668c5e)
![{\displaystyle {\ce {2SiC{}+3O2->[950{-}1700~^{\circ }{\text{C}}]2SiO2{}+2CO\uparrow ,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/801156f136f9a480422a0e4281efbb1ee2716dad)
![{\displaystyle {\ce {SiC{}+2Cl2->[600{-}1200~^{\circ }{\text{C}}]SiCl4{}+C,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35446bc6497525a80837c011b87ac3e324ef5f51)
![{\displaystyle {\ce {6SiC{}+7N2->[1000{-}1400~^{\circ }{\text{C}}]2Si3N4{}+3C2N2,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6be86f43830f2c2ff0799faa2e6aa051d78f187)
![{\displaystyle {\ce {2SiC{}+5Mg->[700~^{\circ }{\text{C}}]2Mg2Si{}+MgC2,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7d6f86ead148db02b402da65767d1b6b147809e)
![{\displaystyle {\ce {SiC{}+4Na2O2->[700{-}800~^{\circ }{\text{C}}]Na2SiO3{}+Na2CO3+2Na2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/838b1a98710f596c16b509b638c319155d844fa8)