Пропанол-1
| Пропанол-1 | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
пропан-1-ол | ||
| Традиционные названия | пропиловый спирт, 1-пропанол, этилкарбинол | ||
| Хим. формула | C3H7OH | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 60,0952 г/моль | ||
| Плотность | 0,80 г/см³ | ||
| Динамическая вязкость | 2,256*10-3 Па·с | ||
| Энергия ионизации | 10,15 эВ[1] и 10,22 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −127 °C | ||
| • кипения | 97,4 °C | ||
| • вспышки | 22 °C | ||
| Пределы взрываемости | 2,2 об.%[1] | ||
| Мол. теплоёмк. | 147,2 (25°C) Дж/(моль·К) | ||
| Теплопроводность | 0,16 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -302 кДж/моль | ||
| • плавления | 89,43 кДж/моль | ||
| • кипения | 749,01 кДж/моль | ||
| Коэфф. тепл. расширения | 0,956 *10-3 K-1 | ||
| Давление пара | 1,928 (20°C), 6,986 (40°C), 20,292 (60°C), 50,750 (80°C) кПа | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 16 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Оптические свойства | |||
| Показатель преломления | 1,3850 | ||
| Структура | |||
| Дипольный момент | 1,68 D | ||
| Классификация | |||
| Рег. номер CAS | 71-23-8 | ||
| PubChem | 1031 | ||
| Рег. номер EINECS | 200-746-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | UH8225000 | ||
| ChEBI | 28831 | ||
| Номер ООН | 1274 | ||
| ChemSpider | 1004 | ||
| Безопасность | |||
| ЛД50 | 1870 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пропи́ловый спирт (пропан-1-ол, 1-пропано́л, химическая формула — C3H7OH) — органический одноатомный спирт. Встречается в природе в небольших количествах как продукт ферментации, а также, является компонентом сивушного масла. Существует изомер 1-пропанола — изопропиловый спирт (пропан-2-ол, 2-пропанол).
Физические свойства[править | править код]
Бесцветная жидкость со спиртовым запахом, смешивается с водой и образует с ней азеотропную смесь (т. кип. 87,5—88,0°С, 71,8 % по массе 1-пропанола). Растворим в этаноле, диэтиловом эфире, ацетоне, бензоле и других органических растворителях.
Химические свойства[править | править код]
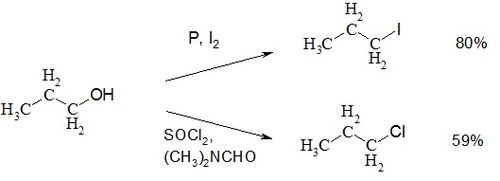
Пропиловый спирт обладает всеми химическими свойствами первичных одноатомных спиртов. Так он может быть превращён в галогеналканы: взаимодействие с йодом и красным фосфором даёт 1-йодпропан с 80 % выходом[3], тогда как взаимодействие хлорида фосфора (III) при катализе хлоридом цинка либо хлористого тионила при катализе ДМФА даёт 1-хлорпропан[4].
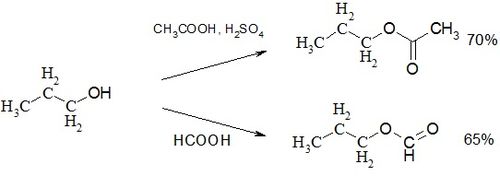
Взаимодействие 1-пропанола с уксусной кислотой в присутствии серной кислоты приводит к образованию пропилацетата[5]. Кипячение только с муравьиной кислотой в течение суток даёт пропилформиат с выходом 65 %.
.
Окисление бихроматом калия серной кислотой в условиях отгонки образующего пропаналя позволяет получать его с 50 % выходом[6]. Более глубокое окисление хромовым ангидридом даёт пропионовую кислоту.

Взаимодействие с щелочными металлами даёт соответствующие пропиолаты металлов. Причём реакция протекает менее интенсивно чем с этиловым спиртом и намного менее интенсивно, чем с водой.
Получение[править | править код]
Метод получения в промышленности — гидроформилирование этилена с последующим гидрированием образовавшегося пропаналя:
1-Пропанол получается в качестве побочного продукта при сбраживании зерна на этанол, однако данный способ получения не имеет особого промышленного значения.
Применение[править | править код]
1-Пропанол применяют в качестве растворителя для восков, полиамидных чернил, природных и синтетических смол, полиакрилонитрила; в производстве полиэтилена низкого давления; для получения карбометоксицеллюлозы; как обезжириватель металлов; сорастворитель поливинилхлоридных адгезивов; желатинирующий и пластифицирующий агент целлюлозноацетатных плёнок; алкилирующий агент. Его используют также для синтеза пропионовой кислоты, пропионового альдегида, пропилацетата, пропиламина, ПАВ, пестицидов, некоторых фармацевтических препаратов.
Топливо[править | править код]
1-Пропанол имеет высокое октановое число (118)[7]. Однако производство его слишком дорого для того, чтобы он стал широко применяемым топливом.
Токсикология[править | править код]
Употребление пропилового спирта, также как и этилового спирта, вызывает алкогольное опьянение. В организме человека пропиловый спирт окисляется до пропионовой кислоты, более едкой, чем уксусная кислота, в связи с чем токсичность пропилового спирта значительно выше, чем у этилового (ЛД50 для пропилового спирта 1870 мг/кг, для этилового спирта 7060 мг/кг). У метилового спирта, ЛД50 составляет 1500 мг/кг.
ПДК пропилового спирта в воздухе рабочей зоны 10 мг/м3 (среднесменная за 8 часов) и 30 мг/м3 (максимально разовая)[8], в атмосферном воздухе населенных пунктов — не более 0,3 мг/м3.
По данным[9] порог восприятия запаха мог достигать (среднее значение в группе) 540[10] и даже 25000 мг/м3; в работе[11] — 660 мг/м3 (то есть в 66 (22) раза выше ПДКрз).
На 2011 год был зафиксирован один смертельный случай отравления пропиловым спиртом[12].
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0533.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Органикум. Том 1. Москва, Мир, 1992, стр. 274
- ↑ Методы получения химических реактивов и препаратов. Москва, ИРЕА, Выпуск 2, 1961, стр. 45 (см. стр. 46)
- ↑ Органикум. Том 2. Москва, Мир, 1992, стр. 84 (см. табл. на стр. 85)
- ↑ Синтезы органических препаратов. Сборник 2.Москва, Иностранная Литература, 1949, стр. 424
- ↑ Bioalcohols. Biofuel.org.uk. Дата обращения: 16 апреля 2014. Архивировано 16 апреля 2014 года.
- ↑ (Роспотребнадзор). № 1794. Пропан-1-ол (пропиловый спирт) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 123. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года.
- ↑ Pliska V. and G. Janicek. Die Veranderungen der Wahrnehmungsschwellen - Konzentration der Riechstoffe in Einiger Homologischen Serien (нем.) // Heymans Institute of Pharmacology Archives internationales de pharmacodynamie. — 1965. — Vol. 156. — P. 211–216. — ISSN 0003-9780.
- ↑ Janicek G., V. Pliska, and J. Kubátová. Olfactometric Estimation of the Threshold of Perception of Odorous Substances by a Flow Olfactometer (чешск.) // Československá hygiena. — Praha, 1960. — Vol. 5. — P. 441–447. — ISSN 0009-0573.
- ↑ William S. Cain. Odor Intensity: Differences in the Exponent of the Psychophysical Function (англ.) // Perception & Psychophysics. — Springer-Verlag, 1969. — November (vol. 6 (iss. 6). — P. 349–354. — ISSN 1943-3921. — doi:10.3758/BF03212789. Архивировано 30 октября 2015 года.
- ↑ N-PROPANOL Health-Base Assessment and Recommendation for HEAC. Дата обращения: 31 июля 2012. Архивировано из оригинала 7 августа 2012 года.