Бутанол-2
| Бутанол-2 | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Бутанол-2 | ||
| Хим. формула | C4H10O | ||
| Рац. формула | CH3CH2CHOHCH3 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 74,122 г/моль | ||
| Плотность | 0,808 г/см³ | ||
| Энергия ионизации | 10,1 ± 0,1 эВ[1] и 9,88 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -115 °C | ||
| • кипения | от 98 до 100 °C | ||
| • вспышки | от 22 до 27 °C | ||
| • самовоспламенения | 405 °C | ||
| Пределы взрываемости | 1,7 ± 0,1 об.%[1] | ||
| Мол. теплоёмк. | 197,1 Дж/(моль·К) | ||
| Давление пара | 1,67кПа (при 20 °C) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 17,6 | ||
| Растворимость | |||
| • в воде | 22,5 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,3978 (при 20 °C) | ||
| Классификация | |||
| Рег. номер CAS |
78-92-2 14898-79-4(R) 4221-99-2(S) |
||
| PubChem |
6568 84682(R) 444683(S) |
||
| Рег. номер EINECS | 201-158-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | EO1750000 | ||
| ChEBI | 35687 | ||
| Номер ООН | 1120 | ||
| ChemSpider |
6320 76392(R) 392543(S) |
||
| Безопасность | |||
| ЛД50 | 4400 мг/кг (крысы, перорально) | ||
| Токсичность | Малотоксичен | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Бутанол-2 (втор-бутиловый спирт, метилэтилкарбинол, бутан-2-ол, 2-бутанол, вторичный бутиловый спирт) C4H9OH — органическое соединение, вторичный одноатомный спирт алифатического ряда.
Представляет собой легковоспламеняющуюся бесцветную жидкость, ограниченно растворимую в воде и неограниченно — в большинстве органических растворителях. Производится в больших масштабах, в основном в качестве прекурсора промышленного растворителя метилэтилкетона.
Свойства
[править | править код]Химические свойства
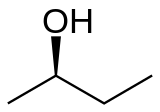
[править | править код]Бутанол-2 является хиральным соединением с одним асимметрическим центром (атом углерода при гидроксильной группе), и, следовательно, может существовать в виде любого из двух оптических изомеров, обозначаемых как (R)-(-)-бутанол-2 и (S)-(+)-бутанол-2. Свойства отдельных оптических изомеров бутанола-2 изучены плохо, поскольку из-за таутомерии достаточно быстро происходит их взаимная равновесная изомеризация. В данной статье под бутанолом-2 подразумевается его рацемат — смесь (R)- и (S)-изомеров в равном соотношении.
 |

|
 |

|
Получение
[править | править код]Бутанол-2 производится в промышленных масштабах путём гидратации бутилена-2:
В качестве катализатора обычно используется серная кислота. Бутилен-1 также может быть прекурсором в данной реакции для бутанола-2, однако из-за образования бутанола-1 как побочного продукта его используют гораздо реже.
В лаборатории его можно получить по реакции Гриньяра путём взаимодействия бромида этилмагния с ацетальдегидом в абсолютном диэтиловом эфире или тетрагидрофуране:
Применение
[править | править код]Хотя бутанол-1 иногда используется в качестве самостоятельного растворителя, в основном его применяют как сырьё для получения метилэтилкетона (бутанон, МЭК), более востребованный промышленный растворитель, который содержится во многих бытовых чистящих средствах и средствах для удаления краски.
Летучие эфиры бутанола-2 обладают приятным ароматом и используются в небольших количествах в качестве духов или искусственных ароматизаторов.
Безопасность
[править | править код]Как и бутанол-1, бутанол-2 обладает низкой острой токсичностью. ЛД50 составляет 4400 мг/кг (крысы, пероральное введение).
Сообщалось о нескольких взрывах во время перегонки бутанола-2[3], которые происходили, по-видимому, из-за накопления пероксидов с температурой кипения выше, чем у чистого спирта (и, следовательно, его концентрировании в перегонном кубе). Поскольку обычно считается, что спирты, в отличие от простых эфиров, не способны образовывать пероксиды при контакте с кислородом воздуха, эта опасность может быть недооценена. Бутанол-2 относится к химическим веществам, образующим перекиси класса B[4].
Интересные факты
[править | править код]В течение долгого времени растворимость бутанола-2 в воде неправильно цитировалась. Ошибка впервые появилась в достаточно авторитетном справочнике Бейльштейна, где правильное значение процитировали с опечаткой (12,5 г/100 мл воды вместо 22,5 г/100 мл воды)[5]. На эти данные позже стали ссылаться и другие справочники.
Примечания
[править | править код]- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0077.html
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Kenneth W. Watkins. Demonstration hazard (англ.) // Journal of Chemical Education. — 1984-05. — Vol. 61, iss. 5. — P. 476. — ISSN 1938-1328 0021-9584, 1938-1328. — doi:10.1021/ed061p476.3. Архивировано 5 декабря 2022 года.
- ↑ Classification List of Peroxide Forming Chemicals. ehs.ucsc.edu. Дата обращения: 5 декабря 2022. Архивировано 5 декабря 2022 года.
- ↑ Donald B. Alger. The water solubility of 2-butanol: A widespread error (англ.) // Journal of Chemical Education. — 1991-11. — Vol. 68, iss. 11. — P. 939. — ISSN 1938-1328 0021-9584, 1938-1328. — doi:10.1021/ed068p939.1. Архивировано 17 сентября 2020 года.