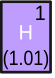
Первый период периодической системы
К пе́рвому пери́оду периоди́ческой систе́мы относятся элементы верхней строки (или периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) химических свойств элементов при увеличении атомного числа: новая строка начинается тогда, когда увеличивается количество энергетических уровней, что означает попадание элементов с аналогичными свойствами в тот же вертикальный столбец. Первый период содержит меньше всего элементов. Их всего два: водород и гелий. Данное положение объясняется современной теорией строения атома.
Периодические особенности
[править | править код]К каждому периоду в периодической таблице химических элементов относятся как минимум 8 элементов, и это позволяет найти определённый периодический закон периода. Однако 1-й период содержит только 2 элемента, что затрудняет процесс нахождения периодического закона.
Гелий является благородным газом и относится к 18-й группе, принадлежащей благородным газам. А водород, как сказано ниже, имеет уникальные свойства и поэтому его трудно распределить в какую-либо группу. Именно поэтому его часто изображают на разных позициях в периодической таблице.
Позиции элементов первого периода в таблице
[править | править код]Хотя и водород, и гелий, относятся к s-блоку, ни к одному из них невозможно найти элемент из этого же блока с похожими свойствами. Их химические свойства так сильно отличаются от других s-элементов, что порой возникают разногласия относительно положения элементов в периодической системе.
Водород в системе иногда размещают над литием[1], углеродом[2], фтором[2][3]. В некоторых вариантах таблицы символ водорода вообще появляется дважды — над литием и фтором[4]. Иногда же этот элемент размещают над всеми элементами ниже лежащих периодов таблицы, подчёркивая, что этот химический элемент не распределяется ни в одну из групп[4] периодической системы.
Гелий практически всегда располагают над неоном (относящемуся к р-элементам) в столбце, принадлежащему группе №18, где размещены благородные газы[1]. Однако время от времени гелий размещали над бериллием ввиду одинаковых конфигураций расположения электронов на внешнем уровне[5].
Элементы
[править | править код]| Химический элемент | Группа | Электронная конфигурация | ||
|---|---|---|---|---|
| 1 | H | Водород | Неметалл | 1s1 |
| 2 | He | Гелий | Благородный газ | 1s2 |
Водород
[править | править код]


Водород (Н) является химическим элементом с атомным номером 1. При нормальной температуре и давлении водород представляет собой легковоспламеняющийся двухатомный газ без цвета, запаха и вкуса. Неметалл, имеет молекулярную формулу H2. Водород является самым лёгким элементом, имея атомную массу, равную 1,00794 а.е.м.[6]
Водород является самым распространённым химическим элементом, составляя примерно 75 % от массы всех элементов во Вселенной[7]. Звёзды в главной последовательности в основном состоят из водорода в состояние плазмы. В элементарном состоянии водород является относительно редким элементом на Земле, поэтому в промышленных масштабах он производится из таких углеводородов, как метан. Большинство элементарного водорода используется «немедленно» (имеется в виду локально на производственной площадке), крупнейшими местами его сбыта является переработка ископаемого топлива, гидрокрекинг, производство аммиака, в основном для рынка удобрений,и т.д. Водород можно получить также из воды с помощью процесса электролиза, но при этом производство водорода получается коммерчески значительно дороже, чем из природного газа[8].
Наиболее распространенный изотоп водорода природного происхождения, известный как протий, имеет один протон и не имеет ни одного нейтрона[9]. В ионных соединениях он может либо получить положительный заряд, став катионом, состоящим из одного протона, либо приобрести отрицательный заряд, став анионом, известным как гидрид. Водород может вступать в соединения с большинством элементов, он присутствует в воде и в большинстве органических веществ[10]. Он играет особенно важную роль в химии кислот и оснований, в которой многие реакции представляют собой обмен протонами между молекулами раствора[11]. Поскольку только для нейтрального атома уравнение Шрёдингера может быть решено аналитически, изучение энергетики и спектра атома водорода играет ключевую роль в развитии квантовой механики[12].
Взаимодействие водорода с различными металлами очень важно в металлургии, так как многие металлы при реакции испытывают водородное охрупчивание[13], а на повестке дня стоит развивитие безопасных способов хранения водорода и его использование в качестве топлива[14]. Водород обладает высокой растворимостью во многих соединениях редкоземельных и переходных металлов[15], при этом он может растворяться как в кристаллических, так и в аморфных веществах. Растворимость водорода меняется при наличии локальных повреждений кристаллической решетки металла или при наличии примесей[16].
Гелий
[править | править код]
Гелий (He) является одноатомным инертным химическим элементом с атомным номером 2, без цвета, вкуса и запаха, нетоксичным, стоящим в начале группы благородных газов в периодической таблице[17]. Его температура кипения и плавления являются самыми низкими среди всех элементов, он существует только в виде газа, за исключением экстремальных условий[18].
Гелий был открыт в 1868 году французский астроном Пьером Жансеном, который первым обнаружил этот элемент по наличию неизвестной ранее жёлтой спектральной линии солнечного света во время солнечного затмения[19]. В 1903 году большие запасы гелия были найдены на месторождении природного газа в США, на сегодняшний день эта страна является крупнейшим поставщиком этого газа[20]. Гелий используется в криогенной технике[21], в системах глубоководного дыхания[22], для охлаждения сверхпроводящих магнитов, в гелиевом датировании[23], для надувания воздушных шариков[24], для подъёма дирижаблей[25], и в качестве защитного газа для промышленных целей, таких как электросварка и выращивание кремниевых пластин[26]. Вдыхая небольшой объём газа, можно на время изменить тембр и качество человеческого голоса[27]. Поведение жидкого гелия-4 в двух жидких фазах гелий I и гелий II имеет важное значение для исследователей, изучающих квантовую механику и явления сверхтекучести в частности[28], а также для тех, кто исследует эффекты при температурах, близких к абсолютному нулю, например, сверхпроводимость[29].
Гелий является вторым по лёгкости элементом и вторым по распространённости в доступной для наблюдения части Вселенной[30]. Большинство гелия образовалось во время Большого взрыва, но и новый гелий постоянно создаётся в результате слияния ядер водорода в звездах[31]. На Земле гелий относительно редок, он образуется в результате естественного распада некоторых радиоактивных элементов[32], потому что альфа-частицы, которые при этом испускаются, состоят из ядер гелия. Этот радиогенный гелий улавливается в составе природного газа в концентрациях до семи процентов от объема[33], из которого он добывается в коммерческих масштабах в процессе низкотемпературной сепарации, называемой фракционной перегонкой[34].
В традиционном изображении периодической таблицы гелий находится над неоном, что отражает его статус благородного газа, однако иногда, как, например, в таблице Менделеева Джанета, он находится над бериллием, что отражает строение его электронной конфигурации.
Примечания
[править | править код]- ↑ 1 2 International Union of Pure and Applied Chemistry > Periodic Table of the Elements. IUPAC. Дата обращения: 1 мая 2011. Архивировано 27 сентября 2018 года.
- ↑ 1 2 Cronyn, Marshall W. The Proper Place for Hydrogen in the Periodic Table (англ.) // Journal of Chemical Education[англ.] : journal. — 2003. — August (vol. 80, no. 8). — P. 947—951. — doi:10.1021/ed080p947. — .
- ↑ Vinson, Greg. Hydrogen is a Halogen. HydrogenTwo.com (2008). Дата обращения: 14 января 2012. Архивировано 10 января 2012 года.
- ↑ 1 2 Kaesz, Herb; Atkins, Peter. A Central Position for Hydrogen in the Periodic Table (англ.) // Chemistry International[англ.] : journal. — International Union of Pure and Applied Chemistry. — Vol. 25, no. 6. — P. 14. Архивировано 21 октября 2017 года.
- ↑ Winter, Mark. Janet periodic table. WebElements (1993–2011). Дата обращения: 19 января 2012. Архивировано из оригинала 6 апреля 2012 года.
- ↑ Hydrogen – Energy. Energy Information Administration. Дата обращения: 20 апреля 2011. Архивировано 5 февраля 2009 года.
- ↑ Palmer, David Hydrogen in the Universe. NASA (13 ноября 1997). Дата обращения: 20 апреля 2011. Архивировано 29 октября 2014 года.
- ↑ Staff. Hydrogen Basics — Production. Florida Solar Energy Center (2007). Дата обращения: 20 апреля 2011. Архивировано 22 октября 2018 года.
- ↑ Sullivan, Walter (1971-03-11). "Fusion Power Is Still Facing Formidable Difficulties". The New York Times.
- ↑ "hydrogen". Encyclopædia Britannica. 2008.
- ↑ Eustis, S. N.; Radisic, D; Bowen, KH; Bachorz, RA; Haranczyk, M; Schenter, GK; Gutowski, M. Electron-Driven Acid-Base Chemistry: Proton Transfer from Hydrogen Chloride to Ammonia (англ.) // Science : journal. — 2008. — 15 February (vol. 319, no. 5865). — P. 936—939. — doi:10.1126/science.1151614. — PMID 18276886.
- ↑ "Time-dependent Schrödinger equation". Encyclopædia Britannica. 2008.
- ↑ Rogers, H. C. Hydrogen Embrittlement of Metals (англ.) // Science. — 1999. — Vol. 159, no. 3819. — P. 1057—1064. — doi:10.1126/science.159.3819.1057. — PMID 17775040.
- ↑ Christensen, C. H. (2005-07-09). "Making society independent of fossil fuels — Danish researchers reveal new technology". Technical University of Denmark. Архивировано 7 января 2010.
{{cite news}}: Неизвестный параметр|coauthors=игнорируется (|author=предлагается) (справка) - ↑ Takeshita, T.; Wallace, W.E.; Craig, R.S. Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt (англ.) // Inorganic Chemistry : journal. — 1974. — Vol. 13, no. 9. — P. 2282—2283. — doi:10.1021/ic50139a050.
- ↑ Kirchheim, R. Hydrogen solubility and diffusivity in defective and amorphous metals (англ.) // Progress in Materials Science[англ.] : journal. — 1988. — Vol. 32, no. 4. — P. 262—325. — doi:10.1016/0079-6425(88)90010-2.
- ↑ Helium: the essentials. WebElements. Дата обращения: 20 апреля 2011. Архивировано 14 июля 2008 года.
- ↑ Helium: physical properties. WebElements. Дата обращения: 20 апреля 2011. Архивировано 25 ноября 2017 года.
- ↑ Pierre Janssen. MSN Encarta. Архивировано 29 октября 2009 года.
- ↑ Theiss, Leslie. Where Has All the Helium Gone? Bureau of Land Management (18 января 2007). Архивировано 25 июля 2008 года.
- ↑ Timmerhaus, Klaus D. Cryogenic Engineering: Fifty Years of Progress (англ.). — Springer[англ.], 2006. — ISBN 0-387-33324-X.
- ↑ Copel, M. Helium voice unscrambling (неопр.) // Audio and Electroacoustics. — 1966. — September (т. 14, № 3). — С. 122—126. — doi:10.1109/TAU.1966.1161862.
- ↑ "helium dating". Encyclopædia Britannica. 2008.
- ↑ Brain, Marshall. How Helium Balloons Work. How Stuff Works. Дата обращения: 20 апреля 2011. Архивировано 6 декабря 2015 года.
- ↑ Jiwatram, Jaya. The Return of the Blimp. Popular Science (10 июля 2008). Дата обращения: 20 апреля 2011. Архивировано 22 августа 2020 года.
- ↑ When good GTAW arcs drift; drafty conditions are bad for welders and their GTAW arcs (англ.) // Welding Design & Fabrication : journal. — 2005. — 1 February.
- ↑ Montgomery, Craig. Why does inhaling helium make one's voice sound strange? Scientific American (4 сентября 2006). Дата обращения: 20 апреля 2011. Архивировано 3 октября 2020 года.
- ↑ Probable Discovery Of A New, Supersolid, Phase Of Matter. Science Daily (3 сентября 2004). Дата обращения: 20 апреля 2011. Архивировано 14 октября 2012 года.
- ↑ Browne, Malcolm W. (1979-08-21). "Scientists See Peril In Wasting Helium; Scientists See Peril in Waste of Helium". The New York Times.
- ↑ Helium: geological information. WebElements. Дата обращения: 20 апреля 2011. Архивировано 4 августа 2020 года.
- ↑ Cox, Tony. Origin of the chemical elements. New Scientist (3 февраля 1990). Дата обращения: 2 октября 2017. Архивировано 21 октября 2014 года.
- ↑ "Helium supply deflated: production shortages mean some industries and partygoers must squeak by". Houston Chronicle. 2006-11-05.
- ↑ Brown, David. Helium a New Target in New Mexico. American Association of Petroleum Geologists (2 февраля 2008). Дата обращения: 20 апреля 2011. Архивировано 4 марта 2012 года.
- ↑ Voth, Greg (2006-12-01). "Where Do We Get the Helium We Use?". The Science Teacher.
Ссылки
[править | править код]- Левченков С. И. Краткий очерк истории химии. Архивная копия от 30 января 2013 на Wayback Machine
- Bloch, D. R. Organic Chemistry Demystified. — McGraw-Hill Professional, 2006. — ISBN 0-07-145920-0.