Эмтрицитабин
| Эмтрицитабин | |
|---|---|
 | |
 | |
| Химическое соединение | |
| ИЮПАК |
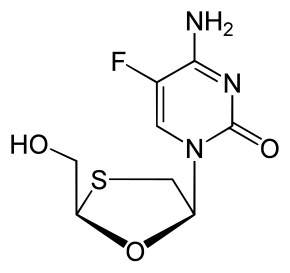
2',3'-dideoxy-5-fluoro-3'-thiacytidine 4-amino-5-fluoro-1-[(2R,5S)-2-(hydroxymethyl)-1,3-oxathiolan-5-yl]-1,2-dihydropyrimidin-2-one |
| Брутто-формула | C8H10FN3O3S |
| CAS | 143491-57-0 |
| PubChem | 60877 |
| DrugBank | DB00879 |
| Состав | |
| Классификация | |
| АТХ | J05AF09 |
| Фармакокинетика | |
| Биодоступн. | 93% (натощак) |
| Связывание с белками плазмы | менее 4% |
| Период полувывед. | около 10 часов |
| Экскреция | С мочой (86%) и калом (14%) |
| Лекарственные формы | |
| таблетки, покрытые пленочной оболочкой; капсулы | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Эмтрицитабин, Эмтритаб | |
Эмтрицитабин (международная транскрипция FTC, 4-Амино-5-фтор-1-[(2R,5S)-2-(гидроксиметил)-1,3-оксатиолан-5-ил]-1,2-дигидропиримидин-2-он)[1] — синтетический нуклеозидный аналог цитидина, нуклеозидный ингибитор обратной транскриптазы под торговым названием Emtriva (ранее Coviracil) для профилактики и лечения ВИЧ-инфекции у взрослых и детей. Является (-)энантиомером тиоаналога цитидина, который отличается от других аналогов цитидина наличием фтора в положении 5 пиримидинового ядра.
Эмтрицитабин также продается в комбинации с фиксированной дозой с тенофовир дизопроксилом (Viread) под торговой маркой Truvada и с тенофовир алафенамидом (Vemlidy) под торговой маркой Descovy.
Тройная комбинация фиксированных доз эмтрицитабина, тенофовира и эфавиренца (Sustiva, продаваемая Bristol Myers Squibb) была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 12 июля 2006 года под торговой маркой Atripla.
Эмтрицитабин составляет четверть таблетки Элвитегравир/кобицистат/эмтрицитабин/тенофовира (торговые марки: Stribild и Genvoya).
В комбинации с фиксированными дозами с тенофовиром или эфавиренцем и тенофовиром он включен в Примерный перечень ВОЗ основных лекарственных средств[2]. В 2017 году это Эмтрицитабин занимал 224-е место среди наиболее часто выписываемых лекарств в Соединенных Штатах; было выписано более двух миллионов рецептов[3] [4].
История
[править | править код]Эмтрицитабин был открыт доктором Деннисом К. Лиотта, доктором Раймондом Ф. Шинази и доктором Ву-Баэг Чой из Эморийскийского университета и лицензирован для Triangle Pharmaceuticals компанией Emory в 1996 году[5]. Triangle Pharmaceuticals была приобретена в 2003 году компанией Gilead Sciences[6], которая завершила разработку и теперь продает продукт под торговой маркой Emtriva.
Эмтрицитабин был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 2 июля 2003 года[7].
Фармакологические свойства
[править | править код]Эмтрицитабин — фармацевтический препарат с активностью против обратной транскриптазы ВИЧ-1. Внутри клетки фосфорилируется до активного метаболита — эмтрицитабин-5'-трифосфата, который ингибирует обратную транскриптазу ВИЧ-1 по конкурентному механизму, результатом чего является прерывание синтеза цепи ДНК[8].
Показания к применению
[править | править код]Применяется в составе комбинированной антиретровирусной терапии и доконтактной профилактики ВИЧ-инфекции (ДКП/ПрЕП) совместно с тенофовиром (TDF) или тенофовира алафенамидом (TAF)[9] [10].
Побочные эффекты
[править | править код]Наиболее частыми побочными эффектами, связанными с лечением, являются диарея, головная боль, тошнота и сыпь. Эти симптомы заставили 1% пациентов отказаться от лечения препаратом.
Обесцвечивание кожи, которое называют гиперпигментацией (обычно поражает ладони рук или подошвы ног), встречается менее чем у 2% пациентов и почти исключительно у пациентов африканского происхождения.
Примечания
[править | править код]- ↑ Liotta DC, Schinazi RF, Choi WB, "Method for the synthesis, compositions and use of 2'-deoxy-5-fluoro-3'-thiacytidine and related compounds", US 5814639, issued 29 September 1998 Архивная копия от 31 мая 2021 на Wayback Machine
- ↑ World Health Organization model list of essential medicines: 21st list 2019. — Geneva : World Health Organization, 2019. — ISBN WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ↑ The Top 300 of 2020. ClinCalc. Дата обращения: 11 апреля 2020. Архивировано 18 марта 2020 года.
- ↑ Emtricitabine - Drug Usage Statistics. ClinCalc. Дата обращения: 11 апреля 2020. Архивировано 8 июля 2020 года.
- ↑ Leaf C (2005-09-19). "The Law of Unintended Consequences". CNN. Архивировано 6 ноября 2020. Дата обращения: 12 марта 2021.
- ↑ Hoover's Handbook of Emerging Companies 2004. Hoover's, Incorporated, (2004), p. 161.
- ↑ Standard & Poor's 500 Guide Архивная копия от 16 октября 2022 на Wayback Machine. Standard & Poor's, McGraw-Hill, (2004), p. 83.
- ↑ Эмтрицитабин (Emtricitabinum)- описание вещества, инструкция, применение, противопоказания и формула. www.rlsnet.ru. Дата обращения: 8 ноября 2019. Архивировано 8 ноября 2019 года.
- ↑ Emtriva- emtricitabine capsule Emtriva- emtricitabine solution. DailyMed (14 декабря 2018). Дата обращения: 24 июля 2020. Архивировано 24 июля 2020 года.
- ↑ Emtriva EPAR. European Medicines Agency (17 сентября 2018). Дата обращения: 24 июля 2020. Архивировано 24 июля 2020 года.
Ссылки
[править | править код]- Эмтрицитабин (Emtricitabine) инструкция по применению. Лекарственные препараты в России. Издательство «Видаль Рус». Дата обращения: 8 ноября 2019.
- Эмтрицитабин-ТЛ - официальная инструкция по применению, аналоги. Cправочник лекарств по ГРЛС МинЗдрава РФ. Дата обращения: 8 ноября 2019.
- Stephanie E Cohen, MD; Darpun Sachdev, MD; Sulggi A Lee, MD; Susan Scheer, PhD; Oliver Bacon, MD; Miao-Jung Chen, PhD; Hideaki Okochi, PhD; Prof Peter L Anderson, PharmD; Mary F Kearney, PhD; Prof Susa Coffey, MD; Hyman Scott, MD; Prof Robert M Grant, MD; Prof Diane Havlir, MD; Prof Monica Gandhi, MD. Acquisition of tenofovir-susceptible, emtricitabine-resistant HIV despite high adherence to daily pre-exposure prophylaxis: a case report (англ.). The Lancet HIV (29 ноября 2018). Дата обращения: 8 ноября 2019.