Молнупиравир
| Молнупиравир | |
|---|---|
 | |
| Химическое соединение | |
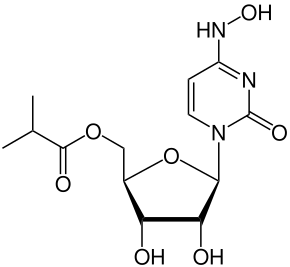
| ИЮПАК | ((2R,3S,4R,5R)-3,4-dihydroxy-5-(4-(hydroxyimino)-2-oxo-3,4-dihydropyrimidin-1(2H)-yl)tetrahydrofuran-2-yl)methyl isobutyrate |
| Брутто-формула | C13H19N3O7 |
| Молярная масса | 329.31 |
| CAS | 2349386-89-4 |
| PubChem | 145996610 |
| DrugBank | 15661 |
| Состав | |
| Классификация | |
| АТХ | J05AX |
| МКБ-10 | B34.2 |
| Фармакокинетика | |
| Связывание с белками плазмы | Не связывается |
| Метаболизм | Пролекарство 5'-изобутирата, который гидролизируется до попадания в системный кровоток до N-гидроксицитидина (NHC), который далее внутриклеточно фосфорилируется до активного трифосфата (NHC-TP) |
| Период полувывед. | Примерно 3.3 ч (NHC) |
| Экскреция | С мочой (≤3%) |
| Лекарственные формы | |
| капсулы (200 мг, 400 мг) | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Молнупиравир, АЛАРИО-ТЛ, Ковипир, ЭСПЕРАВИР | |
Молнупирави́р (коды разработки MK-4482 и EIDD-2801) — противовирусный препарат, активный при пероральном приёме. Подавляет репликацию некоторых РНК-вирусов. Используется для лечения COVID-19 у лиц, инфицированных SARS-CoV-2[1]. Согласно данным рандомизированного контролируемого исследования эффективности для взрослых из групп риска[2] препарат не обладает эффективностью для лечения COVID-19. Более того применение молнупиравира через 14 дней приводит к снижению иммунного ответа, что провоцирует существенно более высокую вирусную нагрузку по сравнению с контрольной группой и порождает мутации, потенциально позволяющие вирусу легче распространяться.
Это пролекарство на основе синтетического нуклеозидного производного N4-гидроксицитидина (также известного как EIDD-1931) проявляет своё противовирусное действие за счёт внесения ошибок копирования во время репликации вирусной РНК[3][4]. Препарат был разработан для лечения гриппа в Университете Эмори университетской фармацевтической компанией Drug Innovation Ventures at Emory (DRIVE). Затем он был приобретён компанией Ridgeback Biotherapeutics из Майами, которая позже заключила соглашение с Merck & Co. для дальнейшей разработки препарата[5].
4 ноября 2021 Великобритания стала первой страной, одобрившей применение молнупиравира для лечения COVID-19[6][7].
Механизм действия[править | править код]
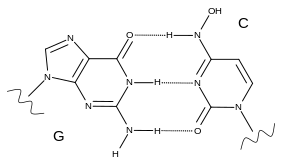
Молнупиравир подавляет репродукцию вируса, способствуя распространению мутаций при репликации вирусной РНК с помощью РНК-направленной РНК-полимеразы[8]. Он метаболизируется в аналог рибонуклеозида, напоминающий цитидин, β-D-N 4-гидроксицитидин 5'-трифосфат (также известный как 5'-трифосфат EIDD-1931 или NHC-TP)[9][10][11]. Во время репликации фермент вируса включает NHC-TP во вновь созданную РНК вместо использования настоящего цитидина[11].
Молнупиравир может переключаться между двумя формами (таутомерами), одна из которых имитирует цитидин (C), а другая — уридин (U)[12]. NHC-TP не распознается как ошибка проверяющими вирус ферментами экзонуклеазами, которые могут заменять мутантные нуклеотиды исправленными версиями[8]. Когда вирусная РНК-полимераза пытается скопировать РНК, содержащую молнупиравир, она иногда интерпретирует его как C, а иногда как U[12]. Это вызывает во всех последующих копиях больше мутаций, чем вирус может пережить — эффект, называемый катастрофой вирусной ошибки или летальным мутагенезом[13].
|

|
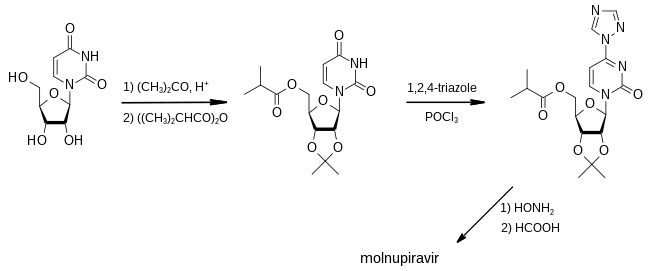
Синтез[править | править код]
Первый синтез молнупиравира был описан в патенте, поданном Университетом Эмори в 2018 году[14].
На первой стадии ацетон используется в качестве защитной группы, чтобы сделать две из трех гидроксильных групп уридина инертными по отношению к обработке ангидридом изомасляной кислоты, который превращает третью гидроксигруппу в ее сложный эфир. Обработка 1,2,4-триазолом и фосфорилхлоридом дает реакционноспособный промежуточный продукт, в котором часть триазола может быть заменена гидроксиламином. Наконец, удаление защитной группы с помощью муравьиной кислоты превращает материал в молнупиравир[14].
Были рассмотрены альтернативные запатентованные пути получения молнупиравира[15].
История разработки[править | править код]
Молнупиравир был разработан в Университете Эмори университетской фармацевтической инновационной компанией Drug Innovation Ventures at Emory (DRIVE). В 2014 году DRIVE начал скрининговый проект, финансируемый DTRA, с целью найти противовирусный препарат, нацеленный на вирус венесуэльского энцефалита лошадей (VEEV), что привело к открытию EIDD-1931[12]. При превращении в пролекарство EIDD-2801 (молнупиравир) соединение также показало активность против других РНК-вирусов, включая грипп, лихорадку Эбола, чикунгунья и различные коронавирусы[12].
Безопасность[править | править код]
Жалоба, поданная в апреле 2020 года бывшим главой Управления перспективных биомедицинских исследований и разработок США (BARDA) Риком Брайтом, содержала обеспокоенность по поводу предоставления финансирования для дальнейшей разработки молнупиравира из-за аналогичных препаратов, обладающих мутагенными свойствами (вызывающих врождённые дефекты). Предыдущая компания, исследовавшая активный ингредиент препарата, Pharmasset, отказалась от него. Данные утверждения были опровергнуты Джорджем Пейнтером, генеральным директором DRIVE. Согласно его заявлению, были проведены исследования токсичности молнупиравира. Данные, предоставленные регулирующим органам в США и Великобритании, позволили продолжить исследования безопасности на людях весной 2020 года. DRIVE и Ridgeback Biotherapeutics также заявили, что планируют будущие исследования безопасности на животных. Мутагенные свойства молнупиравира были подтверждены с помощью HPRT-теста на клетках CHO-K1: было показано, что β-D-N 4-гидроксицитидин оказывает мутагенное действие на клетки дозозависимым образом (до 3 мкМ), предположительно, через соответствующую дезоксирибонуклеозидную форму[16].
COVID-19[править | править код]
После того, как в марте 2020 года было обнаружена активность молнупиравира в отношении SARS-CoV-2, препарат был протестирован в предварительном исследовании на предмет «Безопасности, переносимости и фармакокинетики» на здоровых добровольцах в Великобритании и США. В июне 2020 года Ridgeback Biotherapeutics объявила о переходе к фазе II исследований для проверки эффективности препарата в качестве средства лечения COVID-19[17]. В июле в США и Великобритании были проведены два исследования на небольшом числе госпитализированных и не госпитализированных пациентов[18]. В конце июля 2020 года, ещё не обнародовав никаких медицинских данных, компания Merck, сотрудничавшая с Ridgeback Biotherapeutics при разработке препарата, объявила о своём намерении начиная с сентября 2020 года перевести молнупиравир на позднюю стадию исследований[19]. 19 октября 2020 года компания Merck начала исследование фаз 2/3, ориентированное на госпитализированных пациентов, которое продлится год[20].
3 декабря 2020 года в журнале Nature была опубликована статья о результатах исследования лечения молнупиравиром хорьков, инфицированных Covid-19[21]. Исследование показало, что препарат был «эффективным» при пероральном введении инфицированным хорькам и что он блокировал передачу вируса между хорьками через 24 часа после приёма препарата.
1 октября 2021 года компания Merck заявила, что независимый консультативный совет, наблюдавший за ходом клинического исследования 2/3 фаз, рекомендовал досрочно прекратить исследование из-за убедительных доказательств пользы препарата для пациентов (снижение риска госпитализации или смерти примерно на 48%); согласно заявлению компании, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) согласилось с этим решением. Компания Merck планирует получить разрешение на использование в чрезвычайных ситуациях в США и подать заявки на регистрацию в регулирующие органы других стран. Компания также объявила о планах лицензировать препарат для производителей дженериков, чтобы ускорить его появление в продаже[22][23][24][25][26].
Согласно более позднему заявлению компании, эффективность против госпитализации составляет всё же не 48, а 30 процентов. Однако среди принимавших препарат погиб всего один пациент, а среди принимавших плацебо — девять[27].
Клинические исследования препарата проходят также и на Украине[28].
Регистрация и доступность[править | править код]
В июне 2021 года Министерство здравоохранения и социальных служб США обязалось закупить молнупиравир на сумму 1,2 миллиарда долларов США (соответствует примерно 1,7 миллионам полных курсов препарата) у производителя, компании Merck, если препарат получит разрешение на экстренное использование (EUA) или одобрение Управления по контролю за продуктами и лекарствами США (FDA).
В октябре 2021 года Комитет по лекарственным средствам человека (CHMP) Европейского агентства по лекарственным средствам (EMA) начал непрерывный обзор молнупиравира.
В ноябре 2021 года молнупиравир был одобрен в Великобритании Агентством по регулированию лекарственных средств и товаров медицинского назначения (MHRA) для лечения подтвержденных инфекций COVID-19. MHRA выдало условное разрешение на продажу, действительное в Соединенном Королевстве, и разрешение на использование в чрезвычайных ситуациях для Северной Ирландии. Согласно соглашению, подписанному в октябре, Великобритания рассчитывает получить 480 000 доз молнупиравира в этом году.
Австралия закупила 300 000 курсов. В октябре 2021 года новозеландский фармацевтический поставщик Pharmac закупил 60 000 доз.
В ноябре 2021 года Генеральное управление по лекарственным средствам Бангладеш (DGDA) утвердило разрешение на продажу молнупиравира, производимого Beximco Pharmaceuticals и Eskayef Pharmaceuticals под торговыми марками Emorivir и Monuvir соответственно. Beximco стала первым производителем, выпустившим непатентованную версию (дженерик) таблеток молнупиравира. Стоимость полного курса дженерика составит 33$[29]. Для сравнения, правительство США закупает препарат по цене 700$ за курс[29].
Разрешен к применению в США 23 декабря 2021 года[30].
В России производство молнупиравира по лицензии планируется компанией Р-Фарм[31]. Дженерик молнупиравира зарегистрирован[32] в России под торговым названием Эсперавир, выпускается группой компаний «Промомед»[33] на заводе АО «Биохимик»[34] в капсулах по 200 и 400 мг[33].
См. также[править | править код]
Примечания[править | править код]
- ↑ Summary of Product Characteristics for Lagevrio (англ.). GOV.UK. Дата обращения: 7 ноября 2021. Архивировано 4 ноября 2021 года.
- ↑ Standing J. F., et al. Randomized controlled trial of molnupiravir SARS-CoV-2 viral and antibody response in at-risk adult outpatients (англ.) // Nature Communications. — 2024-02-23. — Vol. 15, iss. 1. — P. 1652. — ISSN 2041-1723. — doi:10.1038/s41467-024-45641-0.
- ↑ Mart Toots, Jeong-Joong Yoon, Robert M. Cox, Michael Hart, Zachary M. Sticher. Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia (англ.) // Science Translational Medicine. — 2019-10-23. — Vol. 11, iss. 515. — ISSN 1946-6242 1946-6234, 1946-6242. — doi:10.1126/scitranslmed.aax5866. Архивировано 5 марта 2021 года.
- ↑ Mart Toots, Jeong-Joong Yoon, Michael Hart, Michael G. Natchus, George R. Painter. Quantitative efficacy paradigms of the influenza clinical drug candidate EIDD-2801 in the ferret model (англ.) // Translational Research. — 2020-04-01. — Т. 218. — С. 16–28. — ISSN 1878-1810 1931-5244, 1878-1810. — doi:10.1016/j.trsl.2019.12.002.
- ↑ A. B. C. News. Daily pill to treat COVID could be just months away (англ.). ABC News. Дата обращения: 7 ноября 2021. Архивировано 29 сентября 2021 года.
- ↑ В Великобритании одобрены первые таблетки от COVID-19. ФОКУС (4 ноября 2021). Дата обращения: 5 ноября 2021. Архивировано 4 ноября 2021 года.
- ↑ First oral antiviral for COVID-19, Lagevrio (molnupiravir), approved by MHRA (англ.). GOV.UK. Дата обращения: 5 ноября 2021. Архивировано 5 января 2022 года.
- ↑ 1 2 Molnupiravir Mutations (англ.). www.science.org. Дата обращения: 7 ноября 2021. Архивировано 21 декабря 2021 года.
- ↑ Wendy P. Painter, Wayne Holman, Jim A. Bush, Firas Almazedi, Hamzah Malik. Human Safety, Tolerability, and Pharmacokinetics of Molnupiravir, a Novel Broad-Spectrum Oral Antiviral Agent with Activity against SARS-CoV-2 // Antimicrobial Agents and Chemotherapy. — Т. 65, вып. 5. — С. e02428–20. — doi:10.1128/AAC.02428-20. Архивировано 7 ноября 2021 года.
- ↑ Alieu Amara, Sujan Dilly Penchala, Laura Else, Colin Hale, Richard FitzGerald. The development and validation of a novel LC-MS/MS method for the simultaneous quantification of Molnupiravir and its metabolite ß-d-N4-hydroxycytidine in human plasma and saliva (англ.) // Journal of Pharmaceutical and Biomedical Analysis. — 2021-11-30. — Vol. 206. — P. 114356. — ISSN 0731-7085. — doi:10.1016/j.jpba.2021.114356.
- ↑ 1 2 Beth Mole. Meet molnupiravir, Merck’s Thor-inspired pill that hammers COVID (амер. англ.). Ars Technica (1 октября 2021). Дата обращения: 7 ноября 2021. Архивировано 2 октября 2021 года.
- ↑ 1 2 3 4 Halford B. "An emerging antiviral takes aim at COVID-19". Дата обращения: 7 ноября 2021. Архивировано 2 августа 2020 года.
- ↑ 1 2 Brandon Malone, Elizabeth A. Campbell. Molnupiravir: coding for catastrophe (англ.) // Nature Structural & Molecular Biology. — 2021-09. — Vol. 28, iss. 9. — P. 706–708. — ISSN 1545-9985. — doi:10.1038/s41594-021-00657-8. Архивировано 23 октября 2021 года.
- ↑ 1 2 Painter, George R.; Bluemling, Gregory R. & Natchus, Michael G. et al. US application 20200276219. N4-hydroxycytidine and derivatives and anti-viral uses related thereto. Emory University (3 сентября 2020). Дата обращения: 7 ноября 2021. Архивировано 5 октября 2021 года.
- ↑ Mohd Imran, Mandeep Kumar Arora, Syed Mohammed Basheeruddin Asdaq, Shah Alam Khan, Saleh I. Alaqel. Discovery, Development, and Patent Trends on Molnupiravir: A Prospective Oral Treatment for COVID-19 (англ.) // Molecules. — 2021-01. — Vol. 26, iss. 19. — P. 5795. — doi:10.3390/molecules26195795. Архивировано 7 ноября 2021 года.
- ↑ Shuntai Zhou, Collin S Hill, Sanjay Sarkar, Longping V Tse, Blaide M D Woodburn. β- d - N 4-hydroxycytidine Inhibits SARS-CoV-2 Through Lethal Mutagenesis But Is Also Mutagenic To Mammalian Cells (англ.) // The Journal of Infectious Diseases. — 2021-08-02. — Vol. 224, iss. 3. — P. 415–419. — ISSN 1537-6613 0022-1899, 1537-6613. — doi:10.1093/infdis/jiab247. Архивировано 30 ноября 2021 года.
- ↑ Ridgeback Biotherapeutics объявляет о запуске испытаний фазы 2, тестирующих EIDD-2801 в качестве потенциального лечения COVID-19. Business Wire. Дата обращения: 4 июля 2020. Архивировано 5 июля 2020 года.
- ↑ Безопасность, переносимость и эффективность EIDD-2801 для устранения выявления инфекционных вирусов у лиц с COVID-19. ClinicalTrials.gov. Дата обращения: 4 июля 2020. Архивировано 4 июля 2020 года.
- ↑ Влияние EIDD-2801 на вирус SARS-CoV-2 (COVID-19). ClinicalTrials.gov. Дата обращения: 4 июля 2020. Архивировано 4 июля 2020 года.
- ↑ Merck Sharp & Dohme Corp. A Phase 2/3, Randomized, Placebo-Controlled, Double-Blind Clinical Study to Evaluate the Efficacy, Safety, and Pharmacokinetics of MK-4482 in Hospitalized Adults With COVID-19. — clinicaltrials.gov, 2021-09-02. — № NCT04575584. Архивировано 19 октября 2021 года.
- ↑ Robert M. Cox, Josef D. Wolf, Richard K. Plemper. Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets (англ.) // Nature Microbiology. — 2021-01. — Vol. 6, iss. 1. — P. 11–18. — ISSN 2058-5276. — doi:10.1038/s41564-020-00835-2. Архивировано 9 марта 2021 года.
- ↑ Merck and Ridgeback’s Investigational Oral Antiviral Molnupiravir Reduced the Risk of Hospitalization or Death by Approximately 50 Percent Compared to Placebo for Patients with Mild or Moderate COVID-19 in Positive Interim Analysis of Phase 3 Study (амер. англ.). Merck.com. Дата обращения: 1 октября 2021. Архивировано 1 октября 2021 года.
- ↑ Chloe Taylor. Merck says its new Covid pill reduces the risk of hospitalization, death by half for some patients (англ.). CNBC (1 октября 2021). Дата обращения: 1 октября 2021. Архивировано 1 октября 2021 года.
- ↑ Beasley, Deena (2021-09-29). "Merck says research shows its COVID-19 pill works against variants". Reuters. Архивировано 1 октября 2021. Дата обращения: 1 октября 2021.
- ↑ Robbins, Rebecca (2021-10-01). "Merck says a trial shows it has produced the first effective antiviral pill for Covid". The New York Times. Архивировано 1 октября 2021. Дата обращения: 1 октября 2021.
- ↑ Р. Дмитриев. Лечение коронавируса. Молнупиравир: новое эффективное лекарство от COVID-19. Молнупиравир поможет ковидным больным не загреметь в больницу или не умереть. Mosmedpreparaty.ru. «Мосмедпрепараты» (1 октября 2021). Дата обращения: 1 октября 2021. Архивировано 1 октября 2021 года.
- ↑ Mishra, Manas (2021-11-26). "Merck's COVID-19 pill significantly less effective in new analysis". Reuters. Архивировано 1 декабря 2021. Дата обращения: 26 ноября 2021.
- ↑ В Украине начинаются испытания таблеток Pfizer и Merck от коронавируса. ФОКУС (4 ноября 2021). Дата обращения: 5 ноября 2021. Архивировано 4 ноября 2021 года.
- ↑ 1 2 Ravikumar, Sachin (2021-11-09). "Bangladesh's Beximco to sell first generic version of Merck COVID-19 pill". Reuters. Архивировано 20 ноября 2021. Дата обращения: 17 ноября 2021.
- ↑ В США одобрили лекарство против COVID-19 от компании Merck. РБК. Дата обращения: 25 декабря 2021. Архивировано 24 декабря 2021 года.
- ↑ «Р-Фарм» будет производить в России молнупиравир от COVID-19 в форме таблеток. vademec.ru. Дата обращения: 22 февраля 2022. Архивировано 22 февраля 2022 года.
- ↑ Государственный реестр лекарственных средств. grls.rosminzdrav.ru. Дата обращения: 20 февраля 2022. Архивировано 20 февраля 2022 года.
- ↑ 1 2 Минздрав зарегистрировал препарат от коронавируса «Эсперавир». РБК. Дата обращения: 20 февраля 2022. Архивировано 20 февраля 2022 года.
- ↑ Новый препарат от COVID-19 "Эсперавир" будут выпускать в Мордовии. РИА Новости (20220203T2017). Дата обращения: 20 февраля 2022. Архивировано 20 февраля 2022 года.