Температура: различия между версиями
| [отпатрулированная версия] | [отпатрулированная версия] |
оформление таблицы |
статья дополнена |
||
| Строка 10: | Строка 10: | ||
}} |
}} |
||
'''Температу́ра''' (от {{lang-la|temperatura}} — надлежащее смешение, нормальное состояние) — [[Скалярная величина|скалярная]] [[физическая величина]], характеризующая |
'''Температу́ра''' (от {{lang-la|temperatura}} — надлежащее смешение, нормальное состояние) — [[Скалярная величина|скалярная]] [[физическая величина]], характеризующая свойства однородной части [[термодинамическая система|макроскопической системы]] и служащая количественной мерой степени нагретости/охлаждённости материального объекта. Температура всех частей системы, находящейся в [[термодинамическое равновесие|термодинамическом равновесии]], одинакова. Если система не находится в равновесии, то между её частями, имеющими различную температуру, происходит [[теплопередача]] (переход [[энергия|энергии]] от более нагретых частей системы к менее нагретым), приводящая к выравниванию температур в системе. |
||
Температура определяет: распределение образующих систему частиц по уровням энергии (см. [[Статистика Максвелла — Больцмана]]) и распределение частиц по скоростям (см. [[Распределение Максвелла]]); степень ионизации вещества (см. [[Уравнение Саха]]); спектральную плотность излучения (см. [[Формула Планка]]); полную объёмную плотность излучения (см. [[Закон Стефана — Больцмана]]) и т. д. Температуру, входящую в качестве параметра в распределение Больцмана, часто называют температурой возбуждения, в распределение Максвелла — кинетической температурой, в формулу Саха — ионизационной температурой, в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы<ref>{{книга |
Температура определяет: распределение образующих систему частиц по уровням энергии (см. [[Статистика Максвелла — Больцмана]]) и распределение частиц по скоростям (см. [[Распределение Максвелла]]); степень ионизации вещества (см. [[Уравнение Саха]]); спектральную плотность излучения (см. [[Формула Планка]]); полную объёмную плотность излучения (см. [[Закон Стефана — Больцмана]]) и т. д. Температуру, входящую в качестве параметра в распределение Больцмана, часто называют температурой возбуждения, в распределение Максвелла — кинетической температурой, в формулу Саха — ионизационной температурой, в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы<ref>{{книга |
||
| Строка 35: | Строка 35: | ||
Существуют также шкала [[градус Фаренгейта|Фаренгейта]] и некоторые [[Единицы измерения температуры|другие]]. |
Существуют также шкала [[градус Фаренгейта|Фаренгейта]] и некоторые [[Единицы измерения температуры|другие]]. |
||
== Температура как локальный параметр. Температурное поле == |
|||
== Эмпирическая, абсолютная и термодинамическая температуры == |
|||
[[Физика сплошных сред]] рассматривает температуру как локальную макроскопическую переменную, т. е. величину, характеризующую мысленно выделяемую область (элементарный объём) сплошной среды (континуума), размеры которой бесконечно малы по сравнению с неоднородностями среды и бесконечно велики по отношению к размерам частиц (атомов, ионов, молекул и т. п.) этой среды{{sfn|Жилин П. А., Рациональная механика сплошных сред|2012|с=84.}}. Значение температуры может меняться от точки к точке (от одного элементарного объёма к другому); распределение температуры в пространстве в данный момент времени задаётся [[Скалярное поле|скалярным полем]] температуры (''температурным полем'')<ref name="temppole">{{cite web| url = http://alcala.ru/bse/izbrannoe/slovar-T/T11278.shtml | title = Температурное поле | author = | publisher = | work = БСЭ, 3-е изд., 1976, т. 25 | lang = ru}}</ref>. Температурное поле может быть как нестационарным (изменяющимся во времени), так и не зависящим от времени стационарным. Среда с одинаковыми во всех точках значениями температуры называют термически однородной. Математически температурное поле описывают уравнением зависимости температуры <math>T</math> от пространственных координат (иногда рассмотрение ограничивают одной или двумя координатами) и от времени. Для термически однородных систем <math>\mathrm{grad}\, T =0. </math> |
|||
Температура не может быть [[Измерение|измерена]] непосредственно. Об изменении температуры судят по изменению других [[физические свойства|физических свойств]] тел ([[объём]]а, [[Давление|давления]], [[Электрическое сопротивление|электрического сопротивления]], [[ЭДС]], [[Интенсивность (физика)|интенсивности излучения]] и др.), однозначно с ней связанных (так называемых термометрических свойств). Количественно же температура определяется указанием способа ее измерения с помощью того или иного термометра. Такое определение ещё не фиксирует ни начало отсчета, ни единицу измерения температуры, поэтому любой метод измерения температуры связан с выбором [[Температурные шкалы|температурной шкалы]]. ''Эмпирическая температура'' — это температура, измеренная в выбранной температурной шкале. |
|||
В термодинамике даётся определение температуры (см. ниже), которое не зависит от выбора термометрического свойства, использованного для её измерения (''абсолютная температура'')<ref>{{книга |
|||
|заглавие = Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур |
|||
|ответственный = Пер. с англ. Ю. А. Данилова и В. В. Белого |
|||
|место = {{М}} |
|||
|издательство = Мир |
|||
|год = 2002 |
|||
|страниц = 462 |
|||
|страницы = 23, 83, 86 |
|||
}}</ref>. |
|||
Абсолютную температуру, измеренную в температурной шкале Кельвина (см. ниже) называют ''абсолютной термодинамической температурой'', или просто ''термодинамической температурой''<ref>{{книга |
|||
|заглавие = Р. Фейнман, Р. Лейтон, М. Сэндс. Фейнмановские лекции по физике. Части 3–4 |
|||
|ответственный = 3-е изд. Пер. с англ. Под ред. |
|||
Я. А. Смородинского |
|||
|место = {{М}} |
|||
|издательство = Мир |
|||
|год = 1976 |
|||
|страниц = 496 |
|||
|страницы = 349–350 |
|||
}}</ref><ref>{{книга |
|||
|заглавие = Калинин М.И., Кононогов C.А. Постоянная Больцмана, энергетический смысл температуры и термодинамическая необратимость |
|||
|ответственный = Измерительная техника |
|||
|год = 2005 |
|||
|том = 7 |
|||
|страницы = 5–8 |
|||
}}</ref>. |
|||
На практике, если речь идёт о численном значении абсолютной термодинамической температуры, для краткости говорят просто об абсолютной температуре объекта. |
|||
== Термодинамическое определение == |
== Термодинамическое определение == |
||
Существование [[Термодинамическое равновесие|равновесного состояния]] называют первым исходным положением термодинамики. Вторым исходным положением термодинамики называют утверждение о том, что равновесное состояние характеризуется некоторой величиной, которая при тепловом контакте двух равновесных систем становится для них одинаковой в результате обмена энергией. Эта величина называется температурой.<ref>И. П. Базаров. Термодинамика, М., Высшая школа, 1976, с. 13-14. |
|||
</ref> |
|||
=== История термодинамического подхода === |
=== История термодинамического подхода === |
||
| Строка 82: | Строка 50: | ||
Свойства температуры изучает раздел [[физика|физики]] — [[термодинамика]]. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также [[химия|химию]] и [[биология|биологию]]. |
Свойства температуры изучает раздел [[физика|физики]] — [[термодинамика]]. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также [[химия|химию]] и [[биология|биологию]]. |
||
=== Равновесная и неравновесная температуры === |
|||
[[Термодинамическая система|Система]], находящаяся в состоянии [[Термодинамическое равновесие|термодинамического равновесия]], имеет стационарное температурное поле. Если в такой системе отсутствуют адиабатические (энергонепроницаемые) перегородки, то все части системы имеют одну и ту же температуру. Иначе говоря, ''равновесная температура'' термически однородной системы не зависит явно от времени (но может меняться в [[Тепловой процесс|квазистатических процессах]]). Неравновесная система в общем случае имеет нестационарное температурное поле, в котором каждый элементарный объём среды имеет собственную ''неравновесную температуру'', [[Числовая функция#Способы задания функции|в явном виде]] зависящую от времени. |
|||
=== Температура в феноменологической термодинамике === |
|||
Определение температуры в [[Термодинамика|феноменологической термодинамике]] зависит от способа построения математического аппарата данной дисциплины (см. [[Аксиоматика термодинамики]]). |
|||
Отличия в формальных определениях термодинамической температуры в различных системах построения термодинамики не означают большую наглядность некоторых из таких систем по сравнению с другими, ибо во всех этих системах, во-первых, в описательном определении температуру рассматривают как меру нагретости/охлаждённости тела, и, во-вторых, содержательные определения, устанавливающие связь между термодинамической температурой и используемыми для её измерения температурными шкалами, совпадают. |
|||
В [[Рациональная термодинамика|рациональной термодинамике]], изначально отвергающей деление этой дисциплины на термодинамику равновесную и [[Неравновесная термодинамика|термодинамику неравновесную]] (т. е. не проводящей различия между равновесной и неравновесной температурами), температура есть первоначальная неопределяемая переменная, описываются только такими свойствами, которые можно выразить языком математики{{sfn|Трусделл К., Термодинамика для начинающих|1970|с=117.}}. Понятия энергии, температуры, [[Энтропия|энтропии]] и [[Химический потенциал|химического потенциала]] вводятся в рациональной термодинамике одновременно; по отдельности определить их принципиально нельзя. Методика введения этих понятий показывает, что можно ввести в рассмотрение много различных температур, отвечающих разным энергетическим потокам. Например, можно ввести температуры трансляционных и спинорных движений, температуру радиационных излучений и т. д.{{sfn|Жилин П. А., Рациональная механика сплошных сред|2012|с=48.}}. |
|||
[[Закон транзитивности термического равновесия|Нулевое начало (закон)]] вводит в равновесную термодинамику понятие [[#Эмпирическая, абсолютная и термодинамическая температуры|эмпирической температуры]]{{sfn|Физика. Большой энциклопедический словарь|1998|с=751.}}{{sfn|Залевски К., Феноменологическая и статистическая термодинамика|1973|с=11–12.}}{{sfn|Вукалович М. П., Новиков И. И., Термодинамика|1972|с=11.}}{{sfn|Зоммерфельд А., Термодинамика и статистическая физика|1955|с=11.}} как параметра состояния, равенство которого во всех точках есть условие термического равновесия в системе без адиабатических перегородок. |
|||
В подходе к построению термодинамики, используемом последователями [[Клаузиус, Рудольф Юлиус Эммануэль|Р. Клаузиуса]]{{sfn|Клаузиус Р., Механическая теория тепла|1934.}}, равновесные параметры состояния — термодинамическую температуру <math> T </math> и энтропию <math> S </math> — задают посредством термодинамического параметра, характеризующего [[термодинамический процесс]]. А именно, |
|||
{{EF|:|<math>\delta Q = TdS,</math>|style=|ref=Термодинамическая температура и энтропия по Клаузиусу|center=}} |
|||
где <math>\delta Q </math> — количество теплоты, получаемое или отдаваемое [[Термодинамическая система#Классификация термодинамических систем|закрытой системой]] в [[Тепловой процесс|элементарном]] (бесконечно малом) [[Равновесный процесс|равновесном процессе]]. Далее понятие о термодинамической температуре по Клаузиусу распространяют на [[Термодинамическая система#Классификация термодинамических систем|открытые системы]] и [[Неравновесная термодинамика|неравновесные состояния и процессы]], обычно не оговаривая специально, что речь идёт о включении в используемый набор законов термодинамики дополнительных аксиом. |
|||
В аксиоматике [[Каратеодори, Константин|Каратеодори]]{{sfn|Каратеодори К., Об основах термодинамики.}}{{sfn|Борн М., Критические замечания по поводу традиционного изложения термодинамики.}} <math>\delta Q </math> рассматривают как [[Дифференциальная форма|дифференциальную форму]] [[Пфафф, Иоганн Фридрих|Пфаффа]], а равновесную термодинамическую температуру — как [[Простейшие дифференциальные уравнения первого порядка#Интегрирующий множитель|интегрирующий делитель]] этой дифференциальной формы{{sfn|Базаров И. П., Термодинамика|2010|с=57.}}. |
|||
В системе аксиом [[Гухман, Александр Адольфович|А. А. Гухмана]]{{sfn|Гухман А. А., Об основаниях термодинамики|1986.}}{{sfn|Леонова В. Ф., Термодинамика|1968.}} изменение [[Внутренняя энергия|внутренней энергии]] системы <math> U </math> в элементарном равновесном процессе выражают через потенциалы взаимодействия <math> P_k </math> и координаты состояния<math> x_k </math>: |
|||
{{EF|:|<math> dU = \sum_k P_k d x_k , </math>|style=|ref=Уравнение Гухмана|center=}} |
|||
причём тепловым потенциалом служит термодинамическая температура <math> T </math>, а тепловой координатой — энтропия <math> S </math>; давление (с обратным знаком) играет роль потенциала механического деформационного взаимодействия для изотропных жидкостей и газов, а сопряжённой с давлением координатой служит объём; при [[Химическая реакция|химических]] и [[Фазовый переход|фазовых превращениях]] координатами состояния и потенциалами служат массы [[Компоненты (в термодинамике и химии)|компонентов]] и сопряжённые с ними химические потенциалы. Другими словами, в аксиоматике Гухмана температуру, энтропию и химические потенциалы вводят в равновесную термодинамику одновременно посредством [[Термодинамика#Выражение основных величин через термодинамические потенциалы#Уравнение Гиббса и уравнение Гиббса—Дюгема|фундаментального уравнения Гиббса]]. Используемый Гухманом и его последователями термин ''координаты состояния'', в перечень которых наряду с геометрическими, механическими и электромагнитными переменными включают энтропию и массы компонентов, исключает неоднозначность, связанную с термином ''обобщённые термодинамические координаты'': одни авторы относят к обобщённым координатам, помимо прочих переменных, энтропию и массы компонентов{{sfn|Базаров И. П., Термодинамика|2010|с=29, 58, 127, 171.}}, тогда как другие ограничиваются геометрическими, механическими и электромагнитными переменными{{sfn|Кубо Р., Термодинамика|1970|с=20–21.}}.) |
|||
В термодинамике [[Гиббс, Джозайя Уиллард|Гиббса]] равновесную температуру выражают через внутреннюю энергию и энтропию{{sfn|Гиббс Дж. В., Термодинамика. Статистическая механика|1982|с=93.}}{{sfn|Guggenheim E. A., Thermodynamics|1986, p. 15.}}{{sfn|Callen H. B., Thermodynamics and an Introduction to Thermostatistics|1986, p. 35.}} |
|||
{{EF|:|<math> T \equiv \left ( \frac { \partial U}{ \partial S} \right )_{\{x_i\}} , </math>|style=|ref=Термодинамическая температура по Гиббсу|center=}} |
|||
где <math> {\{x_i\}} </math> — набор (без энтропии) естественных переменных внутренней энергии, рассматриваемой как [[характеристическая функция (термодинамика)|характеристические функции]]. Равенство температур во всех точках системы без адиабатических перегородок как условие термического равновесия в термодинамике Гиббса следует из экстремальных свойств внутренней энергии и энтропии в состоянии термодинамического равновесия. |
|||
Аксиоматика Фалька и Юнга{{sfn|Falk G., Jung H., Axiomatik der Thermodynamik|1959, S. 156.}} при определении энтропии не делает различия между равновесными и неравновесными состояниями, и, следовательно, даваемое в этой системе аксиом определение температуры через энтропию и внутреннюю энергию одинаково применимо для любых термически однородных систем: |
|||
{{EF|:|<math> T \equiv \left [ \left ( \frac { \partial S}{ \partial U} \right )_{\{x_i\}} \right ]^{-1} , </math>|style=|ref=Термодинамическая температура по Фальку и Юнгу|center=}} |
|||
где <math> {\{x_i\}} </math> — набор (в который не входит внутренняя энергия) независимых переменных энтропии. |
|||
[[Неравновесная термодинамика|Принцип локального равновесия]] разрешает для неравновесных систем заимствовать определение температуры из равновесной термодинамики и использовать данную переменную в качестве неравновесной температуры элементарного объёма среды{{sfn|Дьярмати И., Неравновесная термодинамика|1974|с=26.}}. |
|||
В [[Неравновесная термодинамика#Расширенная неравновесная термодинамика|расширенной неравновесной термодинамике]] (РНТ), базирующейся на отказе от принципа локального равновесия, неравновесную температуру задают посредством соотношения, аналогичного используется в аксиоматике Фалька и Юнга (см. {{eqref|Термодинамическая температура по Фальку и Юнгу|}}), но с другим набором независимых переменных для энтропии{{sfn|Jou D. e. a., Extended Irreversible Thermodynamics|2010, p. 48.}}. Локально-равновесная {{eqref|термодинамическая температура по Гиббсу|}} также отличается от РНТ-неравновесной температуры выбором независимых переменных для энтропии{{sfn|Jou D. e. a., Extended Irreversible Thermodynamics|2010, p. 48.}}. |
|||
== Эмпирическая, абсолютная и термодинамическая температуры == |
|||
Температура не может быть [[Измерение|измерена]] непосредственно. Об изменении температуры судят по изменению других [[Физические свойства|физических свойств]] тел ([[объём]]а, [[Давление|давления]], [[Электрическое сопротивление|электрического сопротивления]], [[ЭДС]], [[Интенсивность (физика)|интенсивности излучения]] и др.), однозначно с ней связанных (так называемых термометрических свойств). Количественно же температура определяется указанием способа ее измерения с помощью того или иного термометра. Такое определение ещё не фиксирует ни начало отсчета, ни единицу измерения температуры, поэтому любой метод измерения температуры связан с выбором [[Температурные шкалы|температурной шкалы]]. ''Эмпирическая температура'' — это температура, измеренная в выбранной температурной шкале. |
|||
Даваемые феноменологической термодинамикой определения [[#Термодинамическое определение температуры|''термодинамической температуры'']] не зависят от выбора термометрического свойства, использованного для её измерения; единицу измерения температуры задают с помощью одной из [[#Единицы и шкала измерения температуры|термодинамических температурных шкал]]. |
|||
В термодинамике в качестве аксиомы принимается основанное на опыте положение о том, что термодинамическая температура есть величина, для всех систем ограниченная с одной стороны, причём температура, соответствующая этой границе, одинакова для всех термодинамических систем и, следовательно, может быть использована в качестве естественной [[Реперная точка|реперной точки]] шкалы температур. Если этой реперной точке присвоить равное нулю значение температуры, то температуры в шкале, базирующейся на данном репере, всегда будут иметь один и тот же знак{{sfn|Базаров И. П., Термодинамика|2010|с=62.}}. Приписывая второй реперной точке положительное значение температуры, получают ''абсолютную температурную шкалу'' с положительными температурами; температуру отсчитываемую от абсолютного нуля, называют ''абсолютной температурой''<ref name="abstemp">{{cite web| url = http://litrus.net/book/read/115273?p=26 | title = Абсолютная температура | author = | publisher = | work = БСЭ, 3-е изд., 1969, т. 1 | lang = ru}}</ref>. Соответственно термодинамическую температуру, отсчитываемую от абсолютного нуля, называют ''абсолютной термодинамической температурой'' (см. [[#Единицы и шкала измерения температуры|Шкала температур Кельвина]]). Примером эмпирической температурной шкалы с отсчётом температуры от абсолютного нуля служит [[#Единицы и шкала измерения температуры|международная практическая температурная шкала]]. |
|||
[[#Единицы и шкала измерения температуры|Термодинамическая шкала температур Целься]] не является абсолютной. |
|||
Некоторые авторы под абсолютностью температуры подразумевают не её отсчёт от абсолютного нуля, а независимость температуры от выбора термометрического свойства{{sfn|Пригожин И., Кондепуди Д., Современная термодинамика|2002|с=23, 83, 86.}}. |
|||
== Отрицательные абсолютные температуры == |
|||
{{main|Отрицательная абсолютная температура}} |
|||
Термодинамическая абсолютная температура всегда положительна (см. [[#Эмпирическая, абсолютная и термодинамическая температуры|Эмпирическая, абсолютная и термодинамическая температуры]]). Использование отрицательных (по шкале Кельвина) температур есть удобный математический приём описания систем с особыми свойствами<ref name="otriztemp">{{cite web| url = http://alcala.ru/bse/izbrannoe/slovar-O/O12531.shtml | title = Отрицательная температура | author = | publisher = | work = БСЭ, 3-е изд., 1975, т. 19 | lang = ru}}</ref>. Приём этот состоит в мысленном выделении в самостоятельную подсистему объектов с особыми свойствами, входящих в состав физической системы, и сепаратном рассмотрении полученной [[Термодинамическая система|парциальной подсистемы]]. Иными словами, один и тот же объём пространства рассматривается как одновременно занимаемый двумя и боле парциальными подсистемами, слабо взаимодействующими друг с другом. |
|||
Примером использования данного подхода может служить рассмотрение ядерных спинов находящегося в магнитном поле кристалла как системы, слабо зависящей от тепловых колебаний кристаллической решётки. При быстром изменении направления магнитного поля на обратное, когда спины не успевают следовать за изменяющимся полем, система ядерных спинов некоторое время будет иметь отрицательную неравновесную температуру{{sfn|Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1|2002|с=262.}}, т. е. с формальной точки зрения в это время в одной и той же пространственной области будут находиться две слабо взаимодействующие системы с разными температурами{{sfn|Поулз Д., Отрицательные абсолютные температуры|1964.}}. В силу всё-таки имеющего место взаимодействия температуры обеих систем спустя какое-то время сравняются. |
|||
Формализм классической феноменологической термодинамики может быть дополнен представлениями об отрицательных абсолютных температурах{{sfn|Базаров И. П., Термодинамика|2010|с=136–148.}}{{sfn|Поулз Д., Отрицательные абсолютные температуры|1964.}}. В соответствии с [[Внутренняя энергия#Внутренняя энергия в равновесной термодинамике##Постулат Тиссы|постулатом Тиссы]] внутренняя энергия любой системы ограничена снизу, и эта граница соответствует абсолютному нулю температуры{{sfn|Tisza L., Generalized Thermodynamics|1966, p. 125.}}. В системах, у которых имеется не только нижняя, но и верхняя граница внутренней энергии, с ростом температуры внутренняя энергия увеличивается и достигает своего предельного значения; дальнейшее повышение температуры <math> T </math> ведёт уже не к увеличению внутренней энергии, а к уменьшению энтропии <math> S </math> системы (<math> S \rightarrow 0 </math> при <math> T \rightarrow - 0 </math>){{sfn|Поулз Д., Отрицательные абсолютные температуры|1964.}}. В соответствии с формулами термодинамики это соответствует переходу из области положительных температур через точку с температурой <math> \pm \infty </math> (точки с температурами <math> T = + \infty </math> и <math> T = - \infty </math> физически тождественны{{sfn|Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1|2002|с=261.}}) в сторону точки с недостижимым предельным значением температуры, равным <math> - 0 </math>{{sfn|Базаров И. П., Термодинамика|2010|с=137–138.}}{{sfn|Поулз Д., Отрицательные абсолютные температуры|1964.}}. |
|||
== Молекулярно-кинетическое определение == |
== Молекулярно-кинетическое определение == |
||
| Строка 365: | Строка 396: | ||
{{Навигация}} |
{{Навигация}} |
||
{{викисловарь}} |
{{викисловарь}} |
||
* {{книга|автор=Callen H. B.|заглавие=Thermodynamics and an Introduction to Thermostatistics|ссылка= |язык= |издание=2<sup>nd</sup> ed|место=N. Y. e. a.|издательство=John Wiley|год=1986. — XVI + 493 p|том= |страниц= |серия= |isbn=0471862568, 9780471862567 |ref=Callen H. B., Thermodynamics and an Introduction to Thermostatistics|1986}} |
|||
* {{книга |
|||
* {{статья|автор=Falk G., Jung H.|заглавие=Axiomatik der Thermodynamik|ссылка= |язык=de|издание=Flügge S. (ed.). Encyclopedia of Physics / Flügge S. (Hrsg.). Handbuch der Physik|издательство=Springer-Verlag|год=1959|volume=III/2. Principles of Thermodynamics and Statistics / Band III/2. Prinzipien der Thermodynamik und Statistik, S. 119–175|номер= |с= |doi= |Falk G., Jung H., Axiomatik der Thermodynamik|1959}} |
|||
| автор = Спасский Б. И. |
|||
* {{книга|автор=Guggenheim E. A.|заглавие=Thermodynamics: An Advanced Treatment for Chemists and Physicists|ссылка= |язык= |издание=8<sup>th</sup> ed|место=Amsterdam|издательство=North-Holland|год=1986. — XXIV + 390 p|том= |страниц= |серия= |isbn=0444869514, 9780444869517 |ref=Guggenheim E. A., Thermodynamics|1986}} |
|||
| заглавие = История физики Ч.I |
|||
* {{книга|автор=Jou D., Casas-Vázquez J., Lebon G.|заглавие=Extended Irreversible Thermodynamics|ссылка= |язык= |издание=4<sup>th</sup> ed|место=N. Y.—Dordrecht—Heidelberg—London|издательство=Springer|год=2010. — XVIII + 483 p|том= |страниц= |серия= |isbn=978-90-481-3073-3|doi=10.1007/978-90-481-3074-0|ref=Jou D. e. a., Extended Irreversible Thermodynamics|2010}} |
|||
| место = Москва |
|||
* {{книга|автор=Tisza Laszlo.|заглавие=Generalized Thermodynamics|ответственный= |издание= |место=Cambridge (Massachusetts) — London (England)|издательство=The M.I.T. Press|год=1966. — XI + 384 p|том= |страниц= |серия= |isbn= |ref=Tisza L., Generalized Thermodynamics|1966}} |
|||
| издательство = «Высшая школа» |
|||
* {{книга|автор=Базаров И. П.|заглавие=Термодинамика|издание=5-е изд|место=СПб.—М.—Краснодар|издательство=Лань|год=2010|том= |страниц=384|серия=Учебники для вузов. Специальная литература|isbn=978-5-8114-1003-3|ref=Базаров И. П., Термодинамика|2010}} |
|||
| год = 1977 |
|||
* {{статья|автор=Борн М.|заглавие=Критические замечания по поводу традиционного изложения термодинамики|ссылка= |язык=ru|издание=Развитие современной физики|издательство=М.: Наука|год=1964, с. 223—256|volume= |номер= |с= |doi= |ref=Борн М., Критические замечания по поводу традиционного изложения термодинамики}} |
|||
| ссылка = http://osnovanija.narod.ru/History/Spas/T1_1.djvu |
|||
* {{книга|автор=Вукалович М. П., Новиков И. И.|заглавие=Термодинамика|ответственный= |издание= |место=М.|издательство=Машиностроение|год=1972|том= |страниц=671|серия= |isbn= |ref=Вукалович М. П., Новиков И. И., Термодинамика|1972}} |
|||
}} |
|||
* {{книга|автор=Гиббс Дж. В.|заглавие=Термодинамика. Статистическая механика|ответственный=Отв. ред. Д. Н. Зубарев|издание= |место=М.|издательство=Наука|год=1982|том= |страниц=584|серия=Классики науки|isbn= |ref=Гиббс Дж. В., Термодинамика. Статистическая механика|1982}} |
|||
* {{книга|автор=Гухман А. А.|заглавие=Об основаниях термодинамики|ответственный= |издание= |место=Алма-Ата|издательство=Изд-во АН КазССР|год=1947|том= |страниц=106|серия= |isbn= |ref=Гухман А. А., Об основаниях термодинамики|1947}} |
|||
* {{книга|автор=Гухман А. А.|заглавие=Об основаниях термодинамики|ответственный= |издание= |место=М.|издательство=Энергоатомиздат|год=1986|том= |страниц=384|серия= |isbn= |ref=Гухман А. А., Об основаниях термодинамики|1986}} |
|||
* {{книга|автор=Дьярмати И.|заглавие=Неравновесная термодинамика. Теория поля и вариационные принципы|ответственный= |издание= |место=М.|издательство=Мир|год=1974|том= |страниц=304|серия= |isbn= |ref=Дьярмати И., Неравновесная термодинамика|1974}} |
|||
* {{книга|автор=Залевски К.|заглавие=Феноменологическая и статистическая термодинамика: Краткий курс лекций|ответственный=Пер. с польск. под. ред. Л. А. Серафимова|издание= |место=М.|издательство=Мир|год=1973|том= |страниц=168|серия= |isbn= |ref=Залевски К., Феноменологическая и статистическая термодинамика|1973}} |
|||
* {{книга|автор=Зоммерфельд А.|заглавие=Термодинамика и статистическая физика|ответственный=Пер. с нем.|издание= |место=М.|издательство=Изд-во иностр. лит-ры|год=1955|том= |страниц=480|серия= |isbn= |ref=Зоммерфельд А., Термодинамика и статистическая физика|1955}} |
|||
* {{статья|автор=Клаузиус Р.|заглавие=Механическая теория тепла|ссылка= |язык=ru|издание=Второе начало термодинамики|издательство=М.—Л.: Гостехиздат|год=1934, с. 70—158|volume= |номер= |с= |doi= |ref=Клаузиус Р., Механическая теория тепла|1934}} |
|||
* {{книга|автор=Ландау Л. Д., Лифшиц Е. М.|заглавие=Статистическая физика. Часть 1|ответственный= |издание=5-е изд|место=М.|издательство=Физматлит|год=2002|страниц=616|серия=Теоретическая физика в 10 томах. Том 5|том= |isbn=5-9221-0054-8|ref=Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1|2002}} |
|||
* {{книга|автор=Леонова В. Ф.|заглавие=Термодинамика|издательство=Высшая школа|год=1968|место=М|страниц=159|ref=Леонова В. Ф., Термодинамика|1968}} |
|||
* {{статья|автор=Поулз Д.|заглавие=Отрицательные абсолютные температуры и температуры во вращающихся системах координат |ссылка= |язык=ru|издание=Успехи физических наук|издательство= |год=1964, т. 84, № 4, с. 693—713|volume= |номер= |с= |doi= |ref=Поулз Д., Отрицательные абсолютные температуры|1964}} |
|||
* {{книга|автор=Пригожин И., Кондепуди Д.|заглавие=Современная термодинамика. От тепловых двигателей до диссипативных структур |ответственный = Пер. с англ|издание= |место=М.|издательство=Мир |год=2002 |том= |страниц=462 |серия= |isbn= |ref=Пригожин И., Кондепуди Д., Современная термодинамика|2002}} |
|||
* {{книга |
* {{книга |
||
| автор = Сивухин Д. В. |
| автор = Сивухин Д. В. |
||
| Строка 380: | Строка 422: | ||
| год = 1990 |
| год = 1990 |
||
| ссылка = |
| ссылка = |
||
}} |
|||
* {{книга |
|||
| автор = Спасский Б. И. |
|||
| заглавие = История физики Ч.I |
|||
| место = Москва |
|||
| издательство = «Высшая школа» |
|||
| год = 1977 |
|||
| ссылка = http://osnovanija.narod.ru/History/Spas/T1_1.djvu |
|||
}} |
}} |
||
*{{книга|автор= Тальма Лобель|заглавие= Теплая чашка в холодный день: Как физические ощущения влияют на наши решения|оригинал= Sensation The New Science of Physical Intelligence|издательство= [[Альпина Паблишер]]|год= 2014|место = М.|серия= |страниц= 259 |
*{{книга|автор= Тальма Лобель|заглавие= Теплая чашка в холодный день: Как физические ощущения влияют на наши решения|оригинал= Sensation The New Science of Physical Intelligence|издательство= [[Альпина Паблишер]]|год= 2014|место = М.|серия= |страниц= 259 |
||
|isbn= 978-5-9614-4698-2|ref= Тальма Лобель}} |
|isbn= 978-5-9614-4698-2|ref= Тальма Лобель}} |
||
* {{статья|автор=Трусделл К.|заглавие=Термодинамика для начинающих|ссылка= |язык=ru|издание=Механика. Периодический сборник переводов иностранных статей|издательство=М.: Мир|год=1970|volume= |номер=3 (121), с. 116—128|с= |doi= |ref=Трусделл К., Термодинамика для начинающих|1970}} |
|||
* {{книга|заглавие=Физика. Большой энциклопедический словарь|ответственный=Гл. ред. [[Прохоров, Александр Михайлович|А. М. Прохоров]]|издание= |место=М.|издательство=[[Большая Российская энциклопедия (издательство)|Большая Российская энциклопедия]]|год=1998|том= |страниц=944|серия= |isbn=5-85270-306-0|ref=Физика. Большой энциклопедический словарь|1998}} |
|||
{{Температурные шкалы}} |
{{Температурные шкалы}} |
||
Версия от 01:38, 27 марта 2015
| Температура | |
|---|---|
| , | |
| Размерность | Θ |
| Единицы измерения | |
| СИ | К |
| СГС | К |
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая свойства однородной части макроскопической системы и служащая количественной мерой степени нагретости/охлаждённости материального объекта. Температура всех частей системы, находящейся в термодинамическом равновесии, одинакова. Если система не находится в равновесии, то между её частями, имеющими различную температуру, происходит теплопередача (переход энергии от более нагретых частей системы к менее нагретым), приводящая к выравниванию температур в системе.
Температура определяет: распределение образующих систему частиц по уровням энергии (см. Статистика Максвелла — Больцмана) и распределение частиц по скоростям (см. Распределение Максвелла); степень ионизации вещества (см. Уравнение Саха); спектральную плотность излучения (см. Формула Планка); полную объёмную плотность излучения (см. Закон Стефана — Больцмана) и т. д. Температуру, входящую в качестве параметра в распределение Больцмана, часто называют температурой возбуждения, в распределение Максвелла — кинетической температурой, в формулу Саха — ионизационной температурой, в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы[1].
Температура относится к интенсивным величинам, не зависящим от массы системы.
Более строгие определения температуры, даваемые ей в различных разделах физики, смотри ниже.
Интуитивно понятие температура появилось как мера градации наших ощущений тепла и холода; на бытовом уровне температура воспринимается как параметр, служащий для количественного описания степени нагретости материального объекта[2].
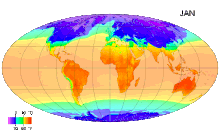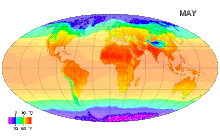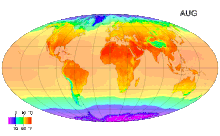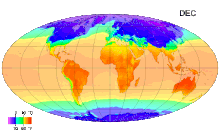

В Международной системе величин (англ. International System of Quantities, ISQ) термодинамическая температура выбрана в качестве одной из семи основных физических величин системы. Соответственно, в Международной системе единиц (СИ), основанной на Международной системе величин, единица этой температуры — кельвин — является одной из семи основных единиц СИ[3].
Кроме термодинамической температуры в СИ используется температура Цельсия, её единицей является градус Цельсия, входящий в состав производных единиц СИ, имеющих специальные наименования и обозначения, и по размеру равный кельвину[4]. На практике часто применяют градусы Цельсия из-за исторической привязки к важным характеристикам воды — температуре таяния льда (0 °C) и температуре кипения (100 °C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном. Изменение температуры на один градус Цельсия тождественно изменению температуры на один кельвин. Поэтому после введения в 1967 г. нового определения кельвина, температура кипения воды перестала играть роль неизменной реперной точки и, как показывают точные измерения, она уже не равна 100 °C, а близка к 99,975 °C[2].
Существуют также шкала Фаренгейта и некоторые другие.
Температура как локальный параметр. Температурное поле
Физика сплошных сред рассматривает температуру как локальную макроскопическую переменную, т. е. величину, характеризующую мысленно выделяемую область (элементарный объём) сплошной среды (континуума), размеры которой бесконечно малы по сравнению с неоднородностями среды и бесконечно велики по отношению к размерам частиц (атомов, ионов, молекул и т. п.) этой среды[5]. Значение температуры может меняться от точки к точке (от одного элементарного объёма к другому); распределение температуры в пространстве в данный момент времени задаётся скалярным полем температуры (температурным полем)[6]. Температурное поле может быть как нестационарным (изменяющимся во времени), так и не зависящим от времени стационарным. Среда с одинаковыми во всех точках значениями температуры называют термически однородной. Математически температурное поле описывают уравнением зависимости температуры от пространственных координат (иногда рассмотрение ограничивают одной или двумя координатами) и от времени. Для термически однородных систем
Термодинамическое определение
История термодинамического подхода
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых[источник не указан 3850 дней]. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами[источник не указан 3850 дней].
В равновесном состоянии температура имеет одинаковое значение для всех макроскопических частей системы. Если в системе два тела имеют одинаковую температуру, то между ними не происходит передачи кинетической энергии частиц (тепла). Если же существует разница температур, то тепло переходит от тела с более высокой температурой к телу с более низкой.
Температура связана также с субъективными ощущениями «тепла» и «холода», связанными с тем, отдаёт ли живая ткань тепло или получает его.
Некоторые квантовомеханические системы (например, рабочее тело лазера, в котором присутствуют инверсно заселённые уровни) могут находиться в состоянии, при котором энтропия не возрастает, а убывает при добавлении энергии, что формально соответствует отрицательной абсолютной температуре. Однако такие состояния находятся не «ниже абсолютного нуля», а «выше бесконечности», поскольку при контакте такой системы с телом, обладающим положительной температурой, энергия передаётся от системы к телу, а не наоборот (подробнее см. Отрицательная абсолютная температура).
Свойства температуры изучает раздел физики — термодинамика. Температура также играет важную роль во многих областях науки, включая другие разделы физики, а также химию и биологию.
Равновесная и неравновесная температуры
Система, находящаяся в состоянии термодинамического равновесия, имеет стационарное температурное поле. Если в такой системе отсутствуют адиабатические (энергонепроницаемые) перегородки, то все части системы имеют одну и ту же температуру. Иначе говоря, равновесная температура термически однородной системы не зависит явно от времени (но может меняться в квазистатических процессах). Неравновесная система в общем случае имеет нестационарное температурное поле, в котором каждый элементарный объём среды имеет собственную неравновесную температуру, в явном виде зависящую от времени.
Температура в феноменологической термодинамике
Определение температуры в феноменологической термодинамике зависит от способа построения математического аппарата данной дисциплины (см. Аксиоматика термодинамики).
Отличия в формальных определениях термодинамической температуры в различных системах построения термодинамики не означают большую наглядность некоторых из таких систем по сравнению с другими, ибо во всех этих системах, во-первых, в описательном определении температуру рассматривают как меру нагретости/охлаждённости тела, и, во-вторых, содержательные определения, устанавливающие связь между термодинамической температурой и используемыми для её измерения температурными шкалами, совпадают.
В рациональной термодинамике, изначально отвергающей деление этой дисциплины на термодинамику равновесную и термодинамику неравновесную (т. е. не проводящей различия между равновесной и неравновесной температурами), температура есть первоначальная неопределяемая переменная, описываются только такими свойствами, которые можно выразить языком математики[7]. Понятия энергии, температуры, энтропии и химического потенциала вводятся в рациональной термодинамике одновременно; по отдельности определить их принципиально нельзя. Методика введения этих понятий показывает, что можно ввести в рассмотрение много различных температур, отвечающих разным энергетическим потокам. Например, можно ввести температуры трансляционных и спинорных движений, температуру радиационных излучений и т. д.[8].
Нулевое начало (закон) вводит в равновесную термодинамику понятие эмпирической температуры[9][10][11][12] как параметра состояния, равенство которого во всех точках есть условие термического равновесия в системе без адиабатических перегородок.
В подходе к построению термодинамики, используемом последователями Р. Клаузиуса[13], равновесные параметры состояния — термодинамическую температуру и энтропию — задают посредством термодинамического параметра, характеризующего термодинамический процесс. А именно,
| (Термодинамическая температура и энтропия по Клаузиусу) |
где — количество теплоты, получаемое или отдаваемое закрытой системой в элементарном (бесконечно малом) равновесном процессе. Далее понятие о термодинамической температуре по Клаузиусу распространяют на открытые системы и неравновесные состояния и процессы, обычно не оговаривая специально, что речь идёт о включении в используемый набор законов термодинамики дополнительных аксиом.
В аксиоматике Каратеодори[14][15] рассматривают как дифференциальную форму Пфаффа, а равновесную термодинамическую температуру — как интегрирующий делитель этой дифференциальной формы[16].
В системе аксиом А. А. Гухмана[17][18] изменение внутренней энергии системы в элементарном равновесном процессе выражают через потенциалы взаимодействия и координаты состояния:
| (Уравнение Гухмана) |
причём тепловым потенциалом служит термодинамическая температура , а тепловой координатой — энтропия ; давление (с обратным знаком) играет роль потенциала механического деформационного взаимодействия для изотропных жидкостей и газов, а сопряжённой с давлением координатой служит объём; при химических и фазовых превращениях координатами состояния и потенциалами служат массы компонентов и сопряжённые с ними химические потенциалы. Другими словами, в аксиоматике Гухмана температуру, энтропию и химические потенциалы вводят в равновесную термодинамику одновременно посредством фундаментального уравнения Гиббса. Используемый Гухманом и его последователями термин координаты состояния, в перечень которых наряду с геометрическими, механическими и электромагнитными переменными включают энтропию и массы компонентов, исключает неоднозначность, связанную с термином обобщённые термодинамические координаты: одни авторы относят к обобщённым координатам, помимо прочих переменных, энтропию и массы компонентов[19], тогда как другие ограничиваются геометрическими, механическими и электромагнитными переменными[20].)
В термодинамике Гиббса равновесную температуру выражают через внутреннюю энергию и энтропию[21][22][23]
| (Термодинамическая температура по Гиббсу) |
где — набор (без энтропии) естественных переменных внутренней энергии, рассматриваемой как характеристические функции. Равенство температур во всех точках системы без адиабатических перегородок как условие термического равновесия в термодинамике Гиббса следует из экстремальных свойств внутренней энергии и энтропии в состоянии термодинамического равновесия.
Аксиоматика Фалька и Юнга[24] при определении энтропии не делает различия между равновесными и неравновесными состояниями, и, следовательно, даваемое в этой системе аксиом определение температуры через энтропию и внутреннюю энергию одинаково применимо для любых термически однородных систем:
| (Термодинамическая температура по Фальку и Юнгу) |
где — набор (в который не входит внутренняя энергия) независимых переменных энтропии.
Принцип локального равновесия разрешает для неравновесных систем заимствовать определение температуры из равновесной термодинамики и использовать данную переменную в качестве неравновесной температуры элементарного объёма среды[25].
В расширенной неравновесной термодинамике (РНТ), базирующейся на отказе от принципа локального равновесия, неравновесную температуру задают посредством соотношения, аналогичного используется в аксиоматике Фалька и Юнга (см. Термодинамическая температура по Фальку и Юнгу), но с другим набором независимых переменных для энтропии[26]. Локально-равновесная термодинамическая температура по Гиббсу также отличается от РНТ-неравновесной температуры выбором независимых переменных для энтропии[26].
Эмпирическая, абсолютная и термодинамическая температуры
Температура не может быть измерена непосредственно. Об изменении температуры судят по изменению других физических свойств тел (объёма, давления, электрического сопротивления, ЭДС, интенсивности излучения и др.), однозначно с ней связанных (так называемых термометрических свойств). Количественно же температура определяется указанием способа ее измерения с помощью того или иного термометра. Такое определение ещё не фиксирует ни начало отсчета, ни единицу измерения температуры, поэтому любой метод измерения температуры связан с выбором температурной шкалы. Эмпирическая температура — это температура, измеренная в выбранной температурной шкале.
Даваемые феноменологической термодинамикой определения термодинамической температуры не зависят от выбора термометрического свойства, использованного для её измерения; единицу измерения температуры задают с помощью одной из термодинамических температурных шкал.
В термодинамике в качестве аксиомы принимается основанное на опыте положение о том, что термодинамическая температура есть величина, для всех систем ограниченная с одной стороны, причём температура, соответствующая этой границе, одинакова для всех термодинамических систем и, следовательно, может быть использована в качестве естественной реперной точки шкалы температур. Если этой реперной точке присвоить равное нулю значение температуры, то температуры в шкале, базирующейся на данном репере, всегда будут иметь один и тот же знак[27]. Приписывая второй реперной точке положительное значение температуры, получают абсолютную температурную шкалу с положительными температурами; температуру отсчитываемую от абсолютного нуля, называют абсолютной температурой[28]. Соответственно термодинамическую температуру, отсчитываемую от абсолютного нуля, называют абсолютной термодинамической температурой (см. Шкала температур Кельвина). Примером эмпирической температурной шкалы с отсчётом температуры от абсолютного нуля служит международная практическая температурная шкала.
Термодинамическая шкала температур Целься не является абсолютной.
Некоторые авторы под абсолютностью температуры подразумевают не её отсчёт от абсолютного нуля, а независимость температуры от выбора термометрического свойства[29].
Отрицательные абсолютные температуры
Термодинамическая абсолютная температура всегда положительна (см. Эмпирическая, абсолютная и термодинамическая температуры). Использование отрицательных (по шкале Кельвина) температур есть удобный математический приём описания систем с особыми свойствами[30]. Приём этот состоит в мысленном выделении в самостоятельную подсистему объектов с особыми свойствами, входящих в состав физической системы, и сепаратном рассмотрении полученной парциальной подсистемы. Иными словами, один и тот же объём пространства рассматривается как одновременно занимаемый двумя и боле парциальными подсистемами, слабо взаимодействующими друг с другом.
Примером использования данного подхода может служить рассмотрение ядерных спинов находящегося в магнитном поле кристалла как системы, слабо зависящей от тепловых колебаний кристаллической решётки. При быстром изменении направления магнитного поля на обратное, когда спины не успевают следовать за изменяющимся полем, система ядерных спинов некоторое время будет иметь отрицательную неравновесную температуру[31], т. е. с формальной точки зрения в это время в одной и той же пространственной области будут находиться две слабо взаимодействующие системы с разными температурами[32]. В силу всё-таки имеющего место взаимодействия температуры обеих систем спустя какое-то время сравняются.
Формализм классической феноменологической термодинамики может быть дополнен представлениями об отрицательных абсолютных температурах[33][32]. В соответствии с постулатом Тиссы внутренняя энергия любой системы ограничена снизу, и эта граница соответствует абсолютному нулю температуры[34]. В системах, у которых имеется не только нижняя, но и верхняя граница внутренней энергии, с ростом температуры внутренняя энергия увеличивается и достигает своего предельного значения; дальнейшее повышение температуры ведёт уже не к увеличению внутренней энергии, а к уменьшению энтропии системы ( при )[32]. В соответствии с формулами термодинамики это соответствует переходу из области положительных температур через точку с температурой (точки с температурами и физически тождественны[35]) в сторону точки с недостижимым предельным значением температуры, равным [36][32].
Молекулярно-кинетическое определение
В молекулярно-кинетической теории температура определяется как величина, характеризующая приходящуюся на одну степень свободы среднюю кинетическую энергию частиц макроскопической системы, находящейся в состоянии термодинамического равновесия.
... мерилом температуры является не само движение, а хаотичность этого движения. Хаотичность состояния тела определяет его температурное состояние, и эта идея (которая впервые была разработана Больцманом), что определённое температурное состояние тела вовсе не определяется энергией движения, но хаотичностью этого движения, и является тем новым понятием в описании температурных явлений, которым мы должны пользоваться…П. Л. Капица[37]
Определение температуры в статистической физике
В статистической физике температура определяется как производная от энергии системы по её энтропии:
- ,
где S — энтропия, E — энергия термодинамической системы. Введённая таким образом величина T является одинаковой для различных тел при термодинамическом равновесии. При контакте двух тел тело с большим значением T будет отдавать энергию другому.
Измерение температуры

Для измерения термодинамической температуры выбирается некоторый термодинамический параметр термометрического вещества. Изменение этого параметра однозначно связывается с изменением температуры. Классическим примером термодинамического термометра может служить газовый термометр, в котором температуру определяют методом измерения давления газа в баллоне постоянного объёма. Известны также термометры абсолютные радиационные, шумовые, акустические.
Термодинамические термометры — это очень сложные установки, которые невозможно использовать для практических целей. Поэтому большинство измерений производится с помощью практических термометров, которые являются вторичными, так как не могут непосредственно связывать какое-то свойство вещества с температурой. Для получения функции интерполяции они должны быть отградуированы в реперных точках международной температурной шкалы.
Для измерения температуры какого-либо тела обычно измеряют какой-либо физический параметр, связанный с температурой, например, геометрические размеры (см. Дилатометр) для газов — объём или давление, скорость звука, электрическую проводимость, электромагнитные спектры поглощения или излучения (например, пирометры и измерение температуры фотосфер и атмосфер звёзд — в последнем случае по доплеровскому уширению спектральных линий поглощения или излучения).
В повседневной практике температуру обычно измеряют с помощью специальных приборов — контактных термометров. При этом термометр приводят в тепловой контакт с исследуемым телом, и, после установления термодинамического равновесия тела и термометра, — выравнивания их температур, по изменениям некоторого измеримого физического параметра термометра судят о температуре тела. Тепловой контакт между термометром и телом должен быть достаточным, чтобы выравнивание температур происходило быстрее, также, ускорение выравнивания температур достигается снижением теплоёмкости термометра по сравнению с исследуемым телом, обычно, уменьшением размеров термометра. Снижение теплоёмкости термометра также меньше искажает результаты измерения, так как меньшая часть теплоты исследуемого тела отбирается или передаётся термометру. Идеальный термометр имеет нулевую теплоёмкость[38].
Средства измерения температуры часто проградуированы по относительным шкалам — Цельсия или Фаренгейта.
На практике для измерения температуры также используют
- жидкостные и механические термометры,
- термопару,
- термометр сопротивления,
- газовый термометр,
- пирометр.
Самым точным практическим термометром является платиновый термометр сопротивления[39]. Разработаны новейшие методы измерения температуры, основанные на измерении параметров лазерного излучения[40].
Единицы и шкала измерения температуры
Из того, что температура — это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (то есть в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Абсолютная температура. Шкала температур Кельвина
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К).
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что равно −273.15 °C.
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Важное значение имеет разработка на основе термодинамической шкалы Кельвина Международных практических шкал, основанных на реперных точках — фазовых переходах чистых веществ, определенных методами первичной термометрии. Первой международной температурной шкалой являлась принятая в 1927 г. МТШ-27. С 1927 г. шкала несколько раз переопределялась (МТШ-48, МПТШ-68, МТШ-90): менялись реперные температуры, методы интерполяции, но принцип остался тот же — основой шкалы является набор фазовых переходов чистых веществ с определенными значениями термодинамических температур и интерполяционные приборы, градуированные в этих точках. В настоящее время действует шкала МТШ-90. Основной документ (Положение о шкале) устанавливает определение Кельвина, значения температур фазовых переходов (реперных точек)[41] и методы интерполяции.
Используемые в быту температурные шкалы — как Цельсия, так и Фаренгейта (используемая, в основном, в США), — не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температура опускается ниже точки замерзания воды, из-за чего температуру приходится выражать отрицательным числом. Для таких случаев были введены абсолютные шкалы температур.
Одна из них называется шкалой Ранкина, а другая — абсолютной термодинамической шкалой (шкалой Кельвина); температуры по ним измеряются, соответственно, в градусах Ранкина (°Ra) и кельвинах (К). Обе шкалы начинаются при температуре абсолютного нуля. Различаются они тем, что цена одного деления по шкале Кельвина равна цене деления шкалы Цельсия, а цена деления шкалы Ранкина эквивалентна цене деления термометров со шкалой Фаренгейта. Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K, 0 °C, 32 °F.
Масштаб шкалы Кельвина привязан к тройной точке воды (273,16 К), при этом от неё зависит постоянная Больцмана. Это создаёт проблемы с точностью интерпретации измерений высоких температур. Сейчас Международное бюро мер и весов рассматривает возможность перехода к новому определению кельвина, основанному на фиксации численного значения постоянной Больцмана, вместо привязки к температуре тройной точки[42].
Шкала Цельсия
В технике, медицине, метеорологии и в быту в качестве единицы измерения температуры используется шкала Цельсия. В настоящее время в системе СИ термодинамическую шкалу Цельсия определяют через шкалу Кельвина: t(°С) = Т(К) — 273,15 (точно), т. е. цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина. По шкале Цельсия температура тройной точки воды равна приблизительно 0,008 °C,Шаблон:-1 и, следовательно, точка замерзания воды при давлении в 1 атм очень близка к 0 °C. Точка кипения воды, изначально выбранная Цельсием в качестве второй реперной точки со значением, по определению равным 100 °C, утратила свой статус одного из реперов. По современным оценкам температура кипения воды при нормальном атмосферном давлении в термодинамической шкале Цельсия составляет около 99,975 °C. Шкала Цельсия очень удобна с практической точки зрения, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку связана с замерзанием атмосферной воды. Шкала предложена Андерсом Цельсием в 1742 г.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а 100 градусов Цельсия — 212 градуса Фаренгейта.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724 году.
Шкала Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°Ré), 1 °Ré равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °Ré) и кипения воды (80 °Ré)
1 °Ré = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Энергия теплового движения при абсолютном нуле
Когда материя охлаждается, многие формы тепловой энергии и связанные с ней эффекты одновременно уменьшаются по величине. Вещество переходит от менее упорядоченного состояния к более упорядоченному.
… современное понятие абсолютного нуля не есть понятие абсолютного покоя, наоборот, при абсолютном нуле может быть движение — и оно есть, но это есть состояние полного порядка …
П. Л. Капица[37]
Газ превращается в жидкость и затем кристаллизуется в твёрдое тело (гелий и при абсолютном нуле остаётся в жидком состоянии при атмосферном давлении). Движение атомов и молекул замедляется, их кинетическая энергия уменьшается. Сопротивление большинства металлов падает из-за уменьшения рассеяния электронов на колеблющихся с меньшей амплитудой атомах кристаллической решётки. Таким образом даже при абсолютном нуле электроны проводимости движутся между атомами со скоростью Ферми порядка 106 м/с.
Температура, при которой частицы вещества имеют минимальное количество движения, сохраняющееся только благодаря квантовомеханическому движению, — это температура абсолютного нуля (Т = 0К).
Температуры абсолютного нуля достичь невозможно. Наиболее низкая температура (450±80)⋅10−12К конденсата Бозе-Эйнштейна атомов натрия была получена в 2003 г. исследователями из МТИ[43]. При этом пик теплового излучения находится в области длин волн порядка 6400 км, то есть примерно радиуса Земли.
Температура и излучение
Излучаемая телом энергия пропорциональна четвёртой степени его температуры. Так, при 300 К с квадратного метра поверхности излучается до 450 ватт. Этим объясняется, например, ночное охлаждение земной поверхности ниже температуры окружающего воздуха. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Переходы из разных шкал
| Шкала | Условное обозначение | из Цельсия (°C) | в Цельсий |
|---|---|---|---|
| Фаренгейт | (°F) | [°F] = [°C] × 9⁄5 + 32 | [°C] = ([°F] − 32) × 5⁄9 |
| Кельвин | (K) | [K] = [°C] + 273.15 | [°C] = [K] − 273.15 |
| Ранкин (Rankin) | (°R) | [°R] = ([°C] + 273.15) × 9⁄5 | [°C] = ([°R] − 491.67) × 5⁄9 |
| Делиль (Delisle) | (°Д или °De) | [°De] = (100 − [°C]) × 3⁄2 | [°C] = 100 − [°De] × 2⁄3 |
| Ньютон (Newton) | (°N) | [°N] = [°C] × 33⁄100 | [°C] = [°N] × 100⁄33 |
| Реомюр (Réaumur) | (°Re, °Ré, °R) | [°Ré] = [°C] × 4⁄5 | [°C] = [°Ré] × 5⁄4 |
| Рёмер (Rømer) | (°Rø) | [°Rø] = [°C] × 21⁄40 + 7.5 | [°C] = ([°Rø] − 7.5) × 40⁄21 |
Сравнение температурных шкал
| Описание | Кельвин | Цельсий | Фаренгейт | Ранкин | Делиль | Ньютон | Реомюр | Рёмер |
|---|---|---|---|---|---|---|---|---|
| Абсолютный нуль | 0 | −273,15 | −459,67 | 0 | 559,725 | −90,14 | −218,52 | −135,90 |
| Температура таяния смеси Фаренгейта (соль и лёд в равных количествах) | 255,37 | −17,78 | 0 | 459,67 | 176,67 | −5,87 | −14,22 | −1,83 |
| Температура замерзания воды (Нормальные условия) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| Средняя температура человеческого тела¹ | 309,75 | 36,6 | 98,2 | 557,9 | 94,5 | 12,21 | 29,6 | 26,925 |
| Температура кипения воды (Нормальные условия) | 373,15 | 100 | 212 | 671,67 | 0 | 33 | 80 | 60 |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Солнце² | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹ Нормальная средняя температура человеческого тела — +36,6 °C ±0,7 °C, или +98,2 °F ±1,3 °F. Приводимое обычно значение +98,6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения +37 °C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная.[44]
² Некоторые значения в этой таблице являются округлёнными. Например, температура поверхности Солнца равняется 5800 градусам Кельвина очень приближённо. Однако для остальных температурных шкал уже дан точный результат перевода 5800 градусов Кельвина в данную шкалу.
Характеристика фазовых переходов
Для описания точек фазовых переходов различных веществ используют следующие значения температуры:
- Температура плавления
- Температура кипения
- Температура отжига
- Температура спекания
- Температура синтеза
- Температура воздушных масс
- Температура почвы
- Гомологическая температура
- Тройная точка
- Температура Дебая (Характеристическая температура)
- Температура Кюри
- Температура Нееля
Психология восприятия
Как показывают результаты многочисленных экспериментов, ощущение холода или тепла зависит не только от температуры окружающей среды, но и от настроения. Так, если испытуемый чувствует себя одиноким, например, находится в помещении с людьми, которые не разделяют его взглядов или ценностей, или просто находится далеко от других людей, то для него комната становится холоднее, и наоборот[45].
Интересные факты

- Самая высокая температура, созданная человеком, ~ 10 трлн К (что сравнимо с температурой Вселенной в первые секунды её жизни) была достигнута в 2010 году при столкновении ионов свинца, ускоренных до околосветовых скоростей. Эксперимент был проведён на Большом Адронном Коллайдере[46]
- Самая высокая теоретически возможная температура — планковская температура. Более высокая температура по современным физическим представлениям не может существовать, так как придание дополнительной энергии системе, нагретой до такой температуры, не увеличивает скорости частиц, а только порождает в столкновениях новые частицы, при этом число частиц в системе растёт и растёт масса системы. Можно считать, что это температура "кипения" физического вакуума. Она примерно равна 1.41679(11)⋅1032 K (примерно 142 нониллиона K).
- Поверхность Солнца имеет температуры около 6000 K, а солнечное ядро — около 15 000 000 K.
- Самая низкая температура, достигнутая человеком, была получена в 1995 году Эриком Корнеллом и Карлом Виманом из США при охлаждении атомов рубидия.[47][48]. Она была выше абсолютного нуля менее чем на 1/170 миллиардную долю кельвина (5,9⋅10−12 K).
- Рекордно низкая температура на поверхности земли −89.2 °С была зарегистрирована на советской внутриконтинентальной научной станции Восток, Антарктида (высота 3488 м над уровнем моря) 21 июля 1983 года[49][50].
- 9 декабря 2013 года на конференции Американского геофизического союза группа американских исследователей сообщила о том, что 10 августа 2010 года температура воздуха в одной из точек Антарктиды опускалась до -135,8 F (-93,2 °С). Данная информация была выявлена в результате анализа спутниковых данных НАСА[51]. По мнению выступавшего с сообщением Т. Скамбоса (англ. Ted Scambos) полученное значение не будет зарегистрировано в качестве рекордного, поскольку определено в результате спутниковых измерений, а не с помощью термометра[52].
- Рекордно высокая температура воздуха вблизи поверхности земли + 56,7 ˚C была зарегистрирована 10 июля 1913 года на ранчо Гринленд в долине Смерти (штат Калифорния, США)[53][54].
- Семена высших растений сохраняют всхожесть после охлаждения до −269 °C.
См. также
- Отрицательная абсолютная температура
- Цветовая температура
- Яркостная температура
- Антенная температура
- Тепловой насос
- Виртуальная температура
- Температура воздуха
- Температура тела
- Термометр
Примечания
- ↑ Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — С. 741. — 944 с.
- ↑ 1 2 Понятие температуры
- ↑ The SI brochure Описание СИ на сайте Международного бюро мер и весов
- ↑ ГОСТ 8.417-2002. Государственная система обеспечения единства измерений. Единицы величин.
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, с. 84..
- ↑ Температурное поле. БСЭ, 3-е изд., 1976, т. 25.
- ↑ Трусделл К., Термодинамика для начинающих, 1970, с. 117..
- ↑ Жилин П. А., Рациональная механика сплошных сред, 2012, с. 48..
- ↑ Физика. Большой энциклопедический словарь, 1998, с. 751..
- ↑ Залевски К., Феноменологическая и статистическая термодинамика, 1973, с. 11–12..
- ↑ Вукалович М. П., Новиков И. И., Термодинамика, 1972, с. 11..
- ↑ Зоммерфельд А., Термодинамика и статистическая физика, 1955, с. 11..
- ↑ Клаузиус Р., Механическая теория тепла, 1934..
- ↑ Каратеодори К., Об основах термодинамики..
- ↑ Борн М., Критические замечания по поводу традиционного изложения термодинамики..
- ↑ Базаров И. П., Термодинамика, 2010, с. 57..
- ↑ Гухман А. А., Об основаниях термодинамики, 1986..
- ↑ Леонова В. Ф., Термодинамика, 1968..
- ↑ Базаров И. П., Термодинамика, 2010, с. 29, 58, 127, 171..
- ↑ Кубо Р., Термодинамика, 1970, с. 20–21..
- ↑ Гиббс Дж. В., Термодинамика. Статистическая механика, 1982, с. 93..
- ↑ Guggenheim E. A., Thermodynamics, 1986, p. 15..
- ↑ Callen H. B., Thermodynamics and an Introduction to Thermostatistics, 1986, p. 35..
- ↑ Falk G., Jung H., Axiomatik der Thermodynamik, 1959, S. 156..
- ↑ Дьярмати И., Неравновесная термодинамика, 1974, с. 26..
- ↑ 1 2 Jou D. e. a., Extended Irreversible Thermodynamics, 2010, p. 48..
- ↑ Базаров И. П., Термодинамика, 2010, с. 62..
- ↑ Абсолютная температура. БСЭ, 3-е изд., 1969, т. 1.
- ↑ Пригожин И., Кондепуди Д., Современная термодинамика, 2002, с. 23, 83, 86..
- ↑ Отрицательная температура. БСЭ, 3-е изд., 1975, т. 19.
- ↑ Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1, 2002, с. 262..
- ↑ 1 2 3 4 Поулз Д., Отрицательные абсолютные температуры, 1964..
- ↑ Базаров И. П., Термодинамика, 2010, с. 136–148..
- ↑ Tisza L., Generalized Thermodynamics, 1966, p. 125..
- ↑ Ландау Л. Д., Лифшиц Е. М., Статистическая физика. Часть 1, 2002, с. 261..
- ↑ Базаров И. П., Термодинамика, 2010, с. 137–138..
- ↑ 1 2 Капица П. Л. Свойства жидкого гелия // Природа. — 1997. — № 12.
- ↑ Шахмаев Н. М. и др. Физика: Учебник для 10 класса общеобразовательных учреждений. — М.: Просвещение, 1996. — С. 21. — 240 с. — ISBN 5090067937.
- ↑ Платиновый термометр сопротивления — основной прибор МТШ-90.
- ↑ Лазерная термометрия
- ↑ Реперные точки МТШ-90
- ↑ Разработка нового определения кельвина
- ↑ Belle Dumé. Bose-Einstein condensates break temperature record (англ.) (12 сентября 2003). Архивировано 25 июля 2013 года.
- ↑ О различных измерениях температуры тела (англ.)
- ↑ Тальма Лобель, 2014, с. 24.
- ↑ BBC News — Large Hadron Collider (LHC) generates a 'mini-Big Bang'
- ↑ Всё про всё. Рекорды температуры
- ↑ Чудеса науки
- ↑ Самая низкая температура на поверхности Земли. National Geographic Росиия. Дата обращения: 9 декабря 2013.
- ↑ World: Lowest Temperature (англ.). Arizona State University. Дата обращения: 9 декабря 2013.
- ↑ NASA-USGS Landsat 8 Satellite Pinpoints Coldest Spots on Earth (англ.). NASA.
- ↑ Antarctica sets low temperature record of -135.8 degrees (англ.). FoxNews.
- ↑ Старый температурный рекорд оспорен. Компьюлента. Дата обращения: 30 ноября 2013.
- ↑ Press Release No. 956 (англ.). World Meteorological Organizayion. Дата обращения: 30 ноября 2013.
Литература
- Callen H. B. Thermodynamics and an Introduction to Thermostatistics. — 2nd ed. — N. Y. e. a.: John Wiley, 1986. — XVI + 493 p. — ISBN 0471862568, 9780471862567.
- Falk G., Jung H. Axiomatik der Thermodynamik (нем.) // Flügge S. (ed.). Encyclopedia of Physics / Flügge S. (Hrsg.). Handbuch der Physik. — Springer-Verlag, 1959. — Vol. III/2. Principles of Thermodynamics and Statistics / Band III/2. Prinzipien der Thermodynamik und Statistik, S. 119–175.
- Guggenheim E. A. Thermodynamics: An Advanced Treatment for Chemists and Physicists. — 8th ed. — Amsterdam: North-Holland, 1986. — XXIV + 390 p. — ISBN 0444869514, 9780444869517.
- Jou D., Casas-Vázquez J., Lebon G. Extended Irreversible Thermodynamics. — 4th ed. — N. Y.—Dordrecht—Heidelberg—London: Springer, 2010. — XVIII + 483 p. — ISBN 978-90-481-3073-3. — doi:10.1007/978-90-481-3074-0.
- Tisza Laszlo. Generalized Thermodynamics. — Cambridge (Massachusetts) — London (England): The M.I.T. Press, 1966. — XI + 384 p.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Борн М. Критические замечания по поводу традиционного изложения термодинамики // Развитие современной физики. — М.: Наука, 1964, с. 223—256.
- Вукалович М. П., Новиков И. И. Термодинамика. — М.: Машиностроение, 1972. — 671 с.
- Гиббс Дж. В. Термодинамика. Статистическая механика / Отв. ред. Д. Н. Зубарев. — М.: Наука, 1982. — 584 с. — (Классики науки).
- Гухман А. А. Об основаниях термодинамики. — Алма-Ата: Изд-во АН КазССР, 1947. — 106 с.
- Гухман А. А. Об основаниях термодинамики. — М.: Энергоатомиздат, 1986. — 384 с.
- Дьярмати И. Неравновесная термодинамика. Теория поля и вариационные принципы. — М.: Мир, 1974. — 304 с.
- Залевски К. Феноменологическая и статистическая термодинамика: Краткий курс лекций / Пер. с польск. под. ред. Л. А. Серафимова. — М.: Мир, 1973. — 168 с.
- Зоммерфельд А. Термодинамика и статистическая физика / Пер. с нем.. — М.: Изд-во иностр. лит-ры, 1955. — 480 с.
- Клаузиус Р. Механическая теория тепла // Второе начало термодинамики. — М.—Л.: Гостехиздат, 1934, с. 70—158.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — 5-е изд. — М.: Физматлит, 2002. — 616 с. — (Теоретическая физика в 10 томах. Том 5). — ISBN 5-9221-0054-8.
- Леонова В. Ф. Термодинамика. — М.: Высшая школа, 1968. — 159 с.
- Поулз Д. Отрицательные абсолютные температуры и температуры во вращающихся системах координат // Успехи физических наук. — 1964, т. 84, № 4, с. 693—713.
- Пригожин И., Кондепуди Д. Современная термодинамика. От тепловых двигателей до диссипативных структур / Пер. с англ. — М.: Мир, 2002. — 462 с.
- Сивухин Д. В. Термодинамика и молекулярная физика. — Москва: «Наука», 1990.
- Спасский Б. И. История физики Ч.I. — Москва: «Высшая школа», 1977.
- Тальма Лобель. Теплая чашка в холодный день: Как физические ощущения влияют на наши решения = Sensation The New Science of Physical Intelligence. — М.: Альпина Паблишер, 2014. — 259 с. — ISBN 978-5-9614-4698-2.
- Трусделл К. Термодинамика для начинающих // Механика. Периодический сборник переводов иностранных статей. — М.: Мир, 1970. — № 3 (121), с. 116—128.
- Физика. Большой энциклопедический словарь / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — 944 с. — ISBN 5-85270-306-0.













![{\displaystyle T\equiv \left[\left({\frac {\partial S}{\partial U}}\right)_{\{x_{i}\}}\right]^{-1},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3199aedd04aecf0811bc8ef796f064be37d4cbac)






