Бромид золота(I)
| Бромид золота(I) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Бромид золота(I) |
| Традиционные названия | Монобромид золота, бромистое золото |
| Хим. формула | AuBr |
| Физические свойства | |
| Состояние | светло-жёлтое[1] твёрдое вещество |
| Молярная масса | 276,87055 г/моль |
| Плотность | 7,9[1] (8,2[2]) |
| Термические свойства | |
| Температура | |
| • плавления | 200 (165[2]) (с разл.) |
| • разложения | > 250 °C |
| Энтальпия | |
| • образования | −14[1][3] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | малорастворим |
| Структура | |
| Кристаллическая структура | тетрагональная |
| Классификация | |
| Рег. номер CAS | 10294-27-6 |
| PubChem | 33567 |
| Рег. номер EINECS | 260-763-2 |
| SMILES | |
| InChI | |
| ChemSpider | 30968 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бромид золота(I) (монобромид золота) — бинарное неорганическое химическое соединение золота с бромом состава AuBr.
Физические свойства[править | править код]
Лимонно-жёлтые или желтовато-серые (в зависимости от кристаллической структуры) кристаллы. Термически неустойчив.
В воде малорастворим. Растворим в концентрированных водных растворах галогенводородных кислот и галогенидов щелочных металлов[4].
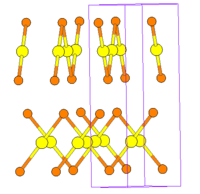
Кристаллическая структура[править | править код]
Кристаллическая структура бромида золота(I) известна в двух модификациях.
Модификация с объёмноцентрированной тетрагональной решеткой изоструктурна AuCl. Параметры ячейки: а = 0,6734 нм, с = 0,8674 нм, угол Au-Br-Au — 92,3°, пространственная группа I41/amd, Z = 8[5].
Модификация с примитивной тетрагональной решеткой изоструктурна AuI. Параметры ячейки: а = 0,4296 нм, с = 1,2146 нм, угол Au-Br-Au — 77°, пространственная группа P42/ncm, Z = 4[5].
Химические свойства[править | править код]
Бромид золота(I) по химическим свойствам сходен с AuCl.
Под воздействием действием света, тёплой воды, слабого нагревания, ацетона, эфира и спирта AuBr, подобно AuCl, либо диспропорционирует, либо отщепляет бром[4][6]:
При слабом подогревании взвеси AuBr в растворе KOH образуется тёмно-фиолетовый AuOH[7].
В концентрированных растворах галогеноводородных кислот и их щелочных солей AuBr растворяется с образованием комплексного, малоустойчивого в присутствии воды аниона [AuHal2]−, относительно стабильного в неводных средах.
С аммиаком, пиридином, триалкилфосфинами, СО и многими другими веществами AuBr образует комплексы.
Синтез[править | править код]
Бромид золота(I) может быть получен:
- прямым синтезом из простых веществ:
- (реакция начинается уже при комнатной температуре с образованием смеси AuBr3 и AuBr, а выше 60 °С — только AuBr[8])
- путём неполного термического разложения AuBr3 при контроле температуры и давления (или осторожным восстановлением)[9]:
- (выше 250 °С идёт полное разложение на элементы)
- нагреванием Н[AuBr4] в вакууме при 10 °С.
Применение[править | править код]
Бромид золота(I) используется в одной из схем получения наночастиц золота путём термолиза комплекса AuBr с олеиламином[10].
Токсичность[править | править код]
Как и другие соединения золота, при длительном контакте бромид золота(I) вызывает у человека специфические аллергические дерматиты и экземы, проявляющиеся в виде рецидивирующих папулёзных высыпаний на кистях, предплечьях и лице[11].
Примечания[править | править код]
- ↑ 1 2 3 Краткая химическая энциклопедия, т. 2, 1990, с. 171.
- ↑ 1 2 Gold compounds: gold bromide Архивная копия от 21 декабря 2016 на Wayback Machine (англ.)
- ↑ Standard thermodynamic properties of chemical substances Архивировано 26 апреля 2015 года.
- ↑ 1 2 Краткая химическая энциклопедия, т. 2, 1990, с. 170.
- ↑ 1 2 Janssen E. M. W., Wiegers G. A. Crystal growth and the crystal structures of two modifications of gold monobromide, I-AuBr and P-AuBr // Journal of the Less Common Metals. — 1978. — Vol. 57, № 2. — P. 47—57. — doi:10.1016/0022-5088(78)90248-5.
- ↑ Некрасов Б. В. Основы общей химии, т. 2, 1974, с. 259.
- ↑ Некрасов Б. В. Основы общей химии, т. 2, 1974, с. 258.
- ↑ Некрасов Б. В. Основы общей химии, т. 2, 1974, с. 256.
- ↑ Некрасов Б. В. Основы общей химии, т. 2, 1974, с. 259, 276.
- ↑ Facile Synthesis of Gold Nanoparticles with Narrow Size Distribution by Using AuCl or AuBr as the Precursor Архивная копия от 17 марта 2015 на Wayback Machine Chemistry — A European Journal, Volume 14, Issue 5, pages 1584—1591, February 8, 2008
- ↑ Лазарев Н. В. Вредные вещества в промышленности, Л., «Химия», 1977, т. III, с. 342
Источники[править | править код]
- Кнунянц И. Л. (гл. ред.), Н.С. Зефиров, Н.Н. Кулов и др.. Краткая химическая энциклопедия, т. 2. — М.: Советская энциклопедия, 1990. — ISBN 5-85270-035-5.
- Janssen E. M. W., Wiegers G. A. Phase transitions of gold monobromide, AuBr // Journal of the Less Common Metals. — 1978. — Vol. 57, № 2. — P. 59—67. — doi:10.1016/0022-5088(78)90249-7.
- Щукарев С. А., Оранская М. А., Цинциус В. М. Журнал неорганической химии, 1956, 1, вып. 5, 881
- Щукарев С. А. и др. Журнал неорганической химии, 1958, 3, вып. 7, 1478
- Некрасов Б. В.. Основы общей химии, т. 2. — М.: Химия, 1974.
- Золота галогениды
- Ефимов А. И. и др. Свойства неорганических соединений. Справочник. — Л.: Химия, 1983. — С. 120—121
Эта статья входит в число добротных статей русскоязычного раздела Википедии. |




