Цитохром-c-оксидаза
| Цитохром-c-оксидаза | |
|---|---|
 Цитохром с-оксидаза быка. | |
| Идентификаторы | |
| Шифр КФ | 7.1.1.9 |
| Номер CAS | 9001-16-5 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9001-16-5 |
Цитохром-c-оксида́за (цитохромоксидаза) или цитохром-c-кислород:оксидоредуктаза, также известная как цитохром aa3 и комплекс IV — терминальная оксидаза аэробной дыхательной цепи переноса электронов, которая катализирует перенос электронов с цитохрома с на кислород с образованием воды[1]. Цитохромоксидаза присутствует во внутренней мембране митохондрий всех эукариот, где её принято называть комплекс IV, а также в клеточной мембране многих аэробных бактерий[2].
Комплекс IV последовательно окисляет четыре молекулы цитохрома с и, принимая четыре электрона, восстанавливает O2 до H2O. При восстановлении O2 четыре H+ захватываются из митохондриального матрикса для образования двух молекул H2O, а ещё четыре H+ активно перекачиваются через мембрану. Таким образом, цитохромоксидаза вносит свой вклад в создание протонного градиента для синтеза АТФ и является частью пути окислительного фосфорилирования[3]. Кроме того, этот мультибелковый комплекс играет ключевую роль в регуляции активности всей дыхательной цепи и производстве энергии эукариотической клеткой[4].
История изучения
[править | править код]Цитохромоксидаза была открыта ирландским врачом и учёным Ч. А. МакМанном[англ.], который в 1885 году описал обратимые изменения в спектре поглощения при длине волны в 605 нм, происходящие при окислении в клетках животных, что является характерной спектральной подписью цитохромоксидазы. Однако его работы были раскритикованы влиятельными физиологами Гоппе-Зейлером и Леви, которые постулировали, что МакМанн просто наблюдал поглощение продуктов распада гемоглобина. В результате исследования этого фермента прекратились более чем на 30 лет, пока в 1923 году Ханс Фишер не подтвердил результаты МакМанна[5][6][7].
Дальнейшие исследования этого фермента были продолжены немецким учёным Отто Варбургом. В своей работе он ингибировал дыхание в суспензии дрожжей при помощи CO, а затем получал спектры поглощения, снимая ингибирование путём облучения когерентным пучком света с разной длиной волны. Из полученных данных следовало, что ингибируемый фермент — гемопротеин, в котором гем находится в комплексе с CO[8][9]. Варбург связал новый, неизвестный белок с функцией клеточного дыхания и применил к нему используемый им с 1924 года термин Atmungsferment или «дыхательный фермент». Работа была опубликована в 1929, а в 1931 Варбург получил за неё Нобелевскую премию по физиологии и медицине с формулировкой «за открытие природы и механизма действия дыхательного фермента»[5].
Немалый вклад в понимание природы комплекса IV внёс британский учёный Дэвид Кейлин. В 1939 году, в совместной работе с Е. Ф. Хартри он обнаружил неизвестный ранее цитохром, получивший название a3, который обладал способностью окислять цитохром c. Новый цитохром обладал тем же спектром поглощения, что и загадочный дыхательный фермент Варбурга, а также ингибировался под действием СО и KCN[10]. В своей работе Кейлин ввёл в обиход название цитохром c-оксидаза, предложенное Малкольмом Диксоном в 1928 году[11]. Варбург и Кейлин длительное время спорили о природе циохромоксидазы: Варбург считал, что кофактором этого фермента может быть только железо, в то время как Кейлин полагал, что это медьсодержащий белок. По прошествии лет оказалось, что оба великих учёных были правы: в состав цитохромоксидазы входит как железосодержащий гем, так и атом меди[12].
Механизм связывания цитохромоксидазой кислорода исследовал американский биохимик Бриттон Ченс[англ.], который в середине 70-х годов двадцатого века, используя передовую технику ЯМР и спектроскопии при низких температурах, обнаружил фермент-субстратный комплекс цитохромоксидазы — аддукт гема a3 с молекулярным кислородом[11].
В 1977 году финский учёный Мартин Викстрём показал, что цитохромоксидаза в процессе своей работы перекачивает протоны через мембрану[13], чего долгое время не мог принять создатель хемиосмотической гипотезы, Питер Митчелл. Тем не менее накапливавшиеся экспериментальные данные свидетельствовали в пользу правоты Викстрёма, и позже Митчел признал свою ошибку[5][14].
Первые попытки выделить фермент предпринимались начиная с 1941 года: поскольку тогда ещё не было разработано процедур для выделения больших мембранных белков, то приходилось действовать путём проб и ошибок. В первых процедурах выделения использовались соли желчных кислот, что вызывало большие потери активности. Появление неионных детергентов наподобие Triton X-100 вызвало новый подъём в этой области с 1966 по 1974 год и позволило получить первые чистые препараты[15]. Первая трёхмерная структура с атомным разрешением комплекса появилась чуть позже, в 1995 году[5].
Структурная организация комплекса IV
[править | править код]Комплекс IV из митохондрий млекопитающих и птиц[16] состоит из 13 белковых субъединиц, три из которых обладают каталитической активностью, связывают кофакторы и кодируются генами митохондрий (исключение составляет субъединица III у Chlamydomonas reinhardtii и Polytomella sp[англ.], которая кодируется в ядре[17]). Остальные десять субъединиц закодированы в ДНК ядра[18][19]. В 2012 году поступило сообщение об обнаружении 14-й субъединицы[20], но позже оно было опровергнуто[21]. В мембране митохондрий комплекс существует в виде гомодимера, каждый мономер состоит из 13 субъединиц. Молекулярная масса такого димера, выделенного из митохондрий быка, составляет приблизительно 350 кДа[22]. Встречающиеся в мембране немногочисленные мономеры обладают вдвое более высокой каталитической активностью[16].
У S. cerevisiae комплекс IV состоит всего из 11 субъединиц, однако отсутствующие субъединицы в бычьем комплексе представляют собой маленькие периферические белки, так что дрожжевая цитохромоксидаза существенно не отличается от таковой у млекопитающих[23][19]. Значительно меньше известно о комплексе IV у растений, он и по сей день остаётся одним из самых неизученных комплексов растительных митохондрий. Последние эксперименты по его выделению из арабидопсиса и исследование его методом голубого нативного электрофореза[англ.] показали, что он, по-видимому, состоит из восьми субъединиц, схожих с субъединицами комплекса IV других эукариот, и шести дополнительных субъединиц, специфичных для растений. Менее точное разделение комплекса IV из картофеля и фасоли дало рисунок полос, схожий с таковым у арабидопсиса: можно точно сказать, что их комплекс IV состоит по крайней мере из 9—10 субъединиц[24]. Бактериальные комплексы существуют в мембране в виде мономеров и состоят из 3—4 субъединиц, три из которых гомологичны трём закодированным в митохондриях субъединицам эукариот[22][19][4].
Субъединицы
[править | править код]
Три большие субъединицы комплекса (I—III), гомологичные бактериальным, несут на себе все необходимые кофакторы и осуществляют основные реакции катализа, связанные, в том числе, и с переносом протонов. Расположенные на периферии малые ядерные субъединицы не участвуют в этом процессе. В настоящее время специфические функции известны только для четырёх ядерных субъединиц (IV, Va, VIa-L, VIa-H), но очевидно, что все они играют роль в сборке, димеризации, а также регуляции активности комплекса[23]. Ядро комплекса IV обладает крайне высокой каталитической активностью, которая подавляется плотно связанными с ним вспомогательными ядерными субъединицами, что особенно важно для регуляции всего дыхания в целом. У позвоночных многие из этих субъединиц представлены несколькими тканеспецифичными изоформами, каждая из которых кодируется отдельным геном. Экспрессия каждой изоформы зависит от типа ткани, стадии развития организма и может изменятся в зависимости от внешних условий, что позволяет чётко регулировать снабжение энергией разных органов и тканей[16].
Появление большого разнообразия ядерных субъединиц после полногеномной дупликации у позвоночных приблизительно совпадает по времени с утратой ими альтернативной оксидазы, которая обеспечивала альтернативный путь для электронов к кислороду в обход комплекса IV. Роль этих субъединиц особенно возросла поскольку клетки млекопитающих утратили способность переключаться между разными терминальными оксидазами, как это происходит у прокариот. Например, E. coli имеет две терминальные хинон-оксидазы; при нормальном содержании кислорода она преимущественно экспрессирует цитохром bo3, а при низком переходит на цитохром bd, который обладает повышенным сродством к кислороду, но не перекачивает протоны. Очевидно, что в таких условиях ядерные субъединицы приняли на себя функцию по управлению активностью всего окислительного фосфорилирования в зависимости от уровня кислорода[25].
Субъединица Va специфически связывает тиреоидный гормон 3,5-дийодотиронин, но не взаимодействует с тироксином или трийодтиронином. В результате такого взаимодействия комплекс IV перестаёт аллостерически ингибироваться АТФ. Этот механизм объясняет кратковременный стимулирующий эффект тиреоидных гормонов на метаболизм млекопитающих[26][16].
У млекопитающих субъединица IV-2 экспрессируется в основном в мозге и лёгких, а в остальных тканях её синтез индуцируется в условиях гипоксии. У рыб эта изоформа сильнее экспрессируется в жабрах[25]. Хотя у всех позвоночных есть по одной копии обеих изоформ субъединицы IV, активация экспрессии IV-2 в ответ на недостаток кислорода есть только у млекопитающих и отсутствует у рыб и рептилий, а у птиц ген COX4-2, кодирующий изоформу IV-2, не функционален[27]. У мышей, нокаутных по гену IV-2, наблюдались трудности в сокращении дыхательных путей, пониженное содержание АТФ в лёгких, а с возрастом появлялись патологии дыхательной системы, включая кристаллы Шарко-Лейдена. Эти экспериментальные данные свидетельствуют о важности изоформы IV-2 для нормальной работы лёгких млекопитающих[16].
Для субъединиц VIa-L и VIa-H удалось определить специфические функции. Оказалось, что способность перекачивать протоны (стехиометрия H+/e−) у комплекса из почек и печени снижалась с 1 до 0,5 низкими концентрациями свободной пальмитиновой кислоты, чего не происходило с комплексом IV из сердца и мышц, содержащего изоформу VIa-H. Предположительное физиологическое значение этого процесса заключается в усилении термогенеза и поддержании температуры тела во всех тканях кроме мышечной в ответ на свободный пальмитат. Субъединица VIa-H из сердца и мышц стимулирует работу комплекса, связывая АДФ, и наоборот, снижает стехиометрию H+/e− при высоком соотношении АТФ/АДФ. Физиологическое значение этой особенности заключается в усилении термогенеза в мышцах во время сна или отдыха, когда расход АТФ снижен, а соотношение АТФ/АДФ остаётся высоким. Субъединица VIa-H отсутствует у рыб[16].
| Субъединица[К 1] | Изоформа | Белок | Описание[К 2] |
|---|---|---|---|
| I | - | Cox1 | Связывает гем а, гем а3, центр CuB, имеет протонные каналы. |
| II | - | Cox2 | Связывает центр CuA, взаимодействует с цитохромом с. |
| III | - | Cox3 | Стабилизирует транспорт протонов. |
| IV | IV-1 IV-2 |
Cox41 | Обеспечивает аллостерическое ингибирование АТФ. |
| Cox42 | Экспрессируется в основном в лёгких, плаценте и мозге, индуцируется гипоксией. Возможно, O2-зависимое ингибирование АТФ. | ||
| Va | - | Cox5a | Связывает 3,5-дийодотиронин, в результате чего снимается ингибирование АТФ. |
| Vb | - | Cox5b | Связывает Zn2+. |
| VIa | VIa-L VIa-H |
Cox6a1 | Печёночая изоформа. Экспрессируется во всех тканях, кроме скелетных мышц и сердца. Снижает стехиометрию H+/e− с 1 до 0,5 в присутствии пальмитата. |
| Cox6a2 | Сердечная изоформа. Экспрессируется в сердце и скелетных мышцах. Снижает стехиометрию H+/e− с 1 до 0,5 при высоком соотношении АТФ/АДФ. | ||
| VIb | VIb-1 VIb-2 |
Cox6b1 | Во всех тканях. Обеспечивает димеризацию комплекса. |
| Cox6b2 | Специфична для семенников. Возможно увеличивает интенсивность дыхания. | ||
| VIc | - | Cox6c | Во всех тканях. |
| VIIa | VIIa-L VIIa-H VIIa-R SIG81 |
Cox7a2 | Экспрессируется во всех тканях, кроме скелетных мышц и сердца. |
| Cox7a1 | Экспрессируется в сердце и скелетных мышцах. | ||
| Cox7a3 | - | ||
| Cox7A2L | - | ||
| VIIb | VIIb-1 VIIb-2 |
Cox7b | Во всех тканях. |
| Cox7b2 | Специфична для семенников. Возможно увеличивает интенсивность дыхания. | ||
| VIIc | - | Cox7c | Во всех тканях. |
| VIII | VIII-L VIII-H VIII-3 |
Cox8a | Во всех тканях. |
| Cox8b | Экспрессируется в скелетных мышцах и буром жире. У человека превратилась в псевдоген. | ||
| Cox8c | - |
Кофакторы
[править | править код]Кофакторы комплекса IV расположены на двух крупных единицах I и II, встроенных в мембрану. Субъединица I образует двенадцать трансмембранных α-спиралей и содержит три окислительно-восстановительных центра: гем а (окислительно-восстановительный потенциал + 0,22 В[1]) и так называемый биядерный центр a3-CuB, в состав которого входит гем а3 и атом меди CuB. Химически гемы a и a3 идентичны, но железо гема а шестикоординированно, поскольку образует шесть координационных связей с четырьмя атомами азота пиррольных колец и двумя атомами азота близлежащих остатков гистидина, а в геме а3 оно образует только пять координационных связей, что делает шестую связь доступной для связывания с молекулярным кислородом. Напротив железа гема а3 располагается атом меди CuB, лигированный тремя остатками гистидина. Хотя между железом и медью биядерного центра нет связующих элементов, между ними наблюдается сильное антиферромагнитное сопряжение[28]. Окислительно-восстановительный потенциал биядерного центра составляет приблизительно + 0,24 В[1].
Кристаллографические исследования выявили необычную посттрансляционную модификацию субъединицы I: гистидин-240[К 3] ковалентно связан через свой атом азота в тау-положении с мета-углеродом бензольного кольца тирозина-244. Этот остаток тирозина поставляет электрон и протон для восстановления кислорода с образованием нейтрального радикала. Кроме того, ковалентная связь создаёт пентамерное кольцо из аминокислот, остаток глутамата которого является важным компонентом транспорта протонов[23].
На субъединице II расположен CuA-центр (редокс-потенциал = − 0,70 В[1]), который состоит из двух атомов меди, напрямую соединённых ковалентной связью. Он лигирован шестью остатками аминокислот: двумя остатками цистеина, двумя остатками гистидина, одним остатком метионина и пептидным карбоксилом глутаминовой кислоты. Функционирует как одноэлектронный переносчик[28].
Методами рентгеноструктурного анализа и сайтспецифичного мутагенеза субъединицы I были выявлены пути, по которым протоны могут проникать через комплекс и пересекать мембрану. Эти пути получили название D-, K- и Н-каналов. В каналах, выстланных полярными аминокислотными остатками, удерживается разное число молекул воды. Обнаруженный в комплексе ион Mg2+, возможно, как раз и нужен для стабилизации этих молекул. Предполагается, что К-канал связывает водную фазу матрикса с биядерным центром и служит для доставки «субстратных» протонов, необходимых для образования воды из кислорода. D-канал, по-видимому, формирует сквозной путь, и по нему могут проходить как «субстратные» протоны, так и протоны, перекачиваемые через мембрану. У эукариот обнаружен дополнительный Н-канал, который, вероятно, также является сквозным[23][29].
Реакция
[править | править код]Суммарная реакция, катализируемая комплексом, описывается следующим уравнением:
- 4цит. c2+ + O2 + 8H+in → 4цит. c3+ + 2H2O + 4H+out
Путь электрона в комплексе известен. Цитохром с связывается на субъединице II при посредничестве субъединиц I, III и VIb и восстанавливает CuA-центр, расположенный вблизи поверхности мембраны. С CuA-центра электрон уходит на гем а и далее на биядерный центр a3-CuB, расположенные в толще мембраны. Именно в биядерном центре происходит связывание О2 и его восстановление до Н2О[3]. Поскольку кислород обладает высоким сродством к электронам, то в процессе восстановления до воды он высвобождает большое количество свободной энергии. Благодаря этому аэробные организмы способны получать гораздо большее количество энергии, чем можно выработать исключительно анаэробным способом.
Механизм восстановления кислорода
[править | править код]Механизм восстановления кислорода уже давно является предметом интенсивного изучения, но ясен не до конца. Каталитический цикл цитохромоксидазы состоит из шести стадий, обозначаемых A (аддукт, англ. Adduct)[30], P (пероксиинтермедиат от англ. Peroxy intermediate), F (феррилоксоинтермедиат от англ. Ferryl-oxo intermediate)[30], OH (полностью окисленное высокоэнергетическое состояние от англ. Fully-Oxidized High-Energy state), E (одноэлектронно-восстановленное состояние от англ. One-electron reduced state) и R (восстановленное состояние от англ. Reduced state) и названных так по состоянию биядерного центра[31]. Следует отметить, что номенклатура каталитических состояний значительно устарела, не всегда отражает реальное химическое состояние биядерного центра и сохраняется во многом по историческим причинам. Так например, на стадии P кислород в биядерном центре находится совсем не в пероксидой форме, как то полагали 30 лет назад, а в оксоферрильном состоянии, где связь между атомами кислорода уже разорвана[30]. Согласно современным представлениям, восстановление кислорода в цитохром-с-оксидазе происходит путём быстрого и полного восстановления с попарным переносом электронов, что исключает образование активных форм кислорода. Происходит следующая последовательность событий[30][32][33]:
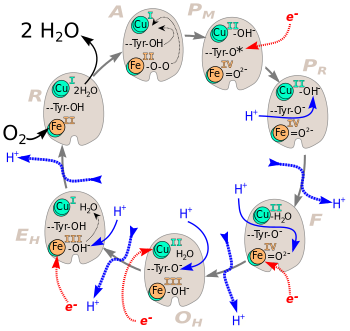
- A Полностью восстановленный биядерный центр быстро связывает O2 c образование кислородного аддукта, что приводит к конформационным перестройкам (обозначены тонкими чёрными стрелочками).
- PM Происходит быстрый перенос четырёх электронов на кислород: два поставляются железом гема а3 (FeII→FeIV), ещё один расположенным рядом CuB (CuI→CuII), а четвёртый приходит от остатка тирозина-244, он же отдаёт протон, необходимый для разрыва двойной связи O2. Образовавшийся нейтральный тирозиновый радикал восстанавливается до состояния аниона за счёт электрона от цитохрома с.
- PR Происходит протонирование Cu(II)-OH− с образованием молекулы воды.
- F Образовавшаяся молекула воды связывается с CuB координационной связью. Железо Fe(IV)=О2- восстанавливается до FeIII, а связанный с ним кислород протонируется. Высвобождается первая молекула воды.
- OH Тирозиновый анион протонируется, а CuB восстанавливается до CuI за счёт электрона от цитохрома с.
- EH Железо восстанавливается до FeII, после чего связанная с ним OH- группа протонируется с образованием второй молекулы воды.
- R В этом состоянии биядерный центр полностью восстановлен и комплекс готов к связыванию новой молекулы кислорода.
Механизм транспорта протонов
[править | править код]Известно, что эукариотическая цитохромоксидаза переносит через мембрану по одному протону на каждый электрон, полученный от цитохрома с. За один раз комплекс закачивает один «субстратный» протон, используемый для образования воды, через канал К и переносит один дополнительный протон через мембрану по каналу D. В ходе одного каталитического цикла акт транслокации приходятся на четыре относительно стабильных стадии: PM, F, OH, и EH.

Точный механизм транспорта протонов до сих пор остаётся не ясным: за последние годы было предложено множество моделей, в которых предпринимались попытки детально описания этого процесса[33]. Не понятно и то, каким образом осуществляется сопряжение энергии электрона с перемещением протонов. Тем не менее, в общем виде это можно описать следующим образом[31]:
- В начальной стадии цикла протонные каналы комплекса закрыты, затем цитохром с передаёт электрон на CuA-центр.
- Электрон быстро перемещается c CuA-центра на гем a, что ведёт к изменению окислительно-восстановительного потенциала и заставляет молекулы воды в канале D переориентироваться, делая его открытым для протона. В результате перемещения электрона с CuA на гем a происходит перемещение протона через канал D и его загрузка в сайт загрузки протона PLS (англ. proton loading site).
- Электрон переходит на биядерный центр к гему a3, в результате чего через канал K входит один субстратный протон. При этом протон в PLS испытывает значительное увеличение его кислотности (с pK=11 до pK=5).
- На завершающей стадии цикла предзагруженный в PLS протон выбрасывается наружу, как полагают, по причине электростатического отталкивания от субстратного протона, который участвует в восстановлении кислорода в биядерном центре.
Регуляция и сборка
[править | править код]Биогенез комплекса IV — очень сложный и хорошо регулируемый процесс, который уже длительное время является предметом усиленного изучения. В сборке комплекса участвует более двадцати закодированных в ядре вспомогательных факторов, а также белков, которые вставляют в него гемы а, а3 и атомы меди. Сюда же относятся по крайней мере 15 белков-активаторов трансляции митохондриальных субъединиц, ответственных за правильную транскрипцию и сплайсинг мРНК и активацию трансляции, специальные транслоказы, необходимые для транспорта ядерных субъединиц в митохондрии, а также ферменты биосинтеза кофакторов[34]. Помимо специальных факторов сборки для биогенеза комплекса IV требуется ещё немалое количество белков с большой специфичностью, включая АТФ-зависимые пептидазы, ответственные за процессинг пропептидов[16].
Посттрансляционная регуляция активности комплекса IV не менее сложна и достигается за счёт множества разных способов. Сюда относятся фосфорилирование субъединиц, обратимое связывания части периферических субъединиц, регуляция за счёт использования определённых изоформ ядерных субъединиц, которое зависит от стадии развития и типа ткани, аллостерическое регулирование за счёт АТФ и АДФ в десяти сайтах связывания (у цитохромоксидазы млекопитающих), моно- и димеризация комплекса, а также его взаимодействие с другими дыхательными комплексами с образованием респирасом[16].
Фосфорилирование субъединиц комплекса имеет особую важность, поскольку связывает его активность с действием регуляторных каскадов клетки и работой цикла Кребса. Фосфорилирование и дефосфорилирование вызывает такие эффекты, как снятие ингибирования через АТФ во время стресса или запуск апоптоза. Всего в комплексе обнаружено 18 позиций для фосфорилирования, но точная функция фосфорилирования по каждому из этих положений не определена[16].
Положение в системе классификации белков
[править | править код]Цитохромоксидаза относится к белковому суперсемейству гем-медных оксидоредуктаз (в классификации ферментов перенесена в 7 класс - транслоказы), в которое входит большинство известных на данный момент терминальных оксидаз, а также редуктазы[англ.] оксида азота(II), которые катализирую двухэлектронное восстановление NO до N2O с образованием воды. Для всех представителей этого суперсемейства характерно наличие субъединицы I с консервативной третичной структурой, одного низкоспинового гема и биядерного центра из атома меди и высокоспинового гема. Члены суперсемейства подразделяются на семейства по типу гема, наличию дополнительных кофакторов, аминокислотной последовательности, третичной структуры и количества субъединиц, типу окисляемого субстрата, а также по строению протон-переносящих каналов или отсутствию таковых[35]. Наличие дополнительных субъединиц, несущих добавочные гемы или атомы металлов (или же полное отсутствие таковых) даёт возможность этим ферментам получать электроны от разного типа субстратов: разнообразных мембранных переносчиков типа хинонов, водорастворимых цитохромов или голубых медьсвязывающих белков[36].
Семейство А — самое большое и самое изученное семейство из всех гем-медных оксидоредуктаз. Для него характерны состав гемов типа aa3 или caa3. Представители этого семейства обычно состоят из трёх субъединиц: I, II и III, которые гомологичны субъединицам типового представителя семейства — митохондриальной цитохром-с-оксидазе. Они обладают как минимум двумя протонными каналами, D и K, и транслоцируют протоны со стехиометрией H+/e-. Цитохром-с-оксидаза млекопитающих относится к подсемейству А1 вместе с цитохромоксидазами P. denitrificans[англ.] и R. sphaeroides[англ.][37].
Оксидазы из семейства В состоят из трёх субъединиц: I, II и IIa. Субъединица IIa представляет собой единственную трансмембранную цепь, аналогичной по структуре второй трансмембранной цепи субъединицы II из семейства А. Имеют только один альтернативный протонный канал К, стехиометрия переноса протонов — 0,5-0,75 H+/e-[36][38][39]. Характерен набор гемов типа ba3, b(o)a3 и aa3[35].
К семейству C относятся только терминальные оксидазы типа cbb3. Обладают дополнительной субъединицей, которая может связывать один или два гема c[35]. Это второе по размеру семейство кислород-редуктаз (24 %) после семейства А (71 %)[36]. Имеется альтернативный канал К, который отличается по строению от К-канала редуктаз из семейства B. Стехиометрия переноса протонов составляет 0,2-0,4 H+/e-, но по другим данным 0,6-1[35]. Это семейство встречается только среди бактерий, так как большинство архей не умеют синтезировать гем с[36].
На основе биоинформатического анализа было предложено выделить малые семейства D, E, F, G, и H, которые представлены только у архей и обладают чрезвычайным разнообразием. В классической системе все эти семейства включены в состав семейства B, однако высокое разнообразие их первичной структуры говорит в пользу выделения их в отдельные семейства[36].
Внутриклеточное распределение
[править | править код]Три коровые субъединицы цитохром-с-оксидазы, закодированные в митохондриальном геноме, недавно были обнаружены за пределами митохондрий. Их нашли в зимогенных гранулах ацинусов поджелудочной железы. Относительно высокую концентрацию этих субъединиц обнаружили в секреторных гранулах вместе с гормоном роста в передней доле гипофиза[40]. Функции этих субъединиц за пределами митохондрий ещё не определены. Кроме субъединиц цитохром-с-оксидазы вне митохондрий были обнаружены многие другие митохондриальные белки[41][42]. В связи с этими находками была высказана гипотеза о существовании неизвестного механизма транспорта белков из митохондрий в другие клеточные компартменты[40][42][43].
Ингибиторы
[править | править код]Цианиды, сульфиды, азиды, монооксид углерода и монооксид азота[44] связываются с окисленным или восстановленным биядерным центром фермента и конкурируют с кислородом, ингибируя при этом фермент, что приводит к смерти клеток от химической асфиксии. Метанол, который входит в состав технического спирта, в организме преобразуется в муравьиную кислоту, которая тоже может ингибировать цитохромоксидазу[45].
Клиническое и практическое значение
[править | править код]Мутации, затрагивающие ферментативную активность или структуру цитохром-с-оксидазы, приводят к тяжёлым и, как правило, фатальным нарушениям метаболизма. Такие нарушения обычно проявляются в раннем детстве и влияют преимущественно на ткани с высоким потреблением энергии (мозг, сердце, мышцы). Среди множества митохондриальных заболеваний, заболевания, связанные с дисфункцией или нарушением сборки цитохромоксидазы, считаются самыми тяжёлыми[46].
Подавляющее большинство нарушений работы цитохромоксидазы связаны с мутациями закодированных в ядре факторах сборки этого комплекса. Они обеспечивают правильную сборку и работу комплекса и участвуют в нескольких жизненно важных процессах, включая транскрипцию и трансляцию митохондриальных субъединиц, процессинг пропептидов и их встраивание в мембрану, а также биосинтез кофакторов и закрепление их в комплексе[47].
По состоянию на текущий момент удалось идентифицировать мутации в семи факторах сборки: SURF1[англ.], SCO1[англ.], SCO2[англ.], COX10[англ.], COX15[англ.], COX20, COA5 и LRPPRC[англ.]. Мутации в этих белках могут приводить к изменению работы комплекса, неправильной сборке субкомплексов, нарушению транспорта меди или регуляции трансляции. Мутация в каждом из генов связана с этиологией определённого заболевания, некоторые из которых могут переходить в множественные расстройства. К такого рода генетическим нарушениям относятся синдром Лея, кардиомиопатия, энцефалопатия, лейкодистрофия, анемия и нейросенсорная тугоухость[47].
Гистохимия
[править | править код]Гистохимическое окрашивание комплекса IV используется для картирования метаболически активных участков мозга животных, поскольку существует прямая зависимость между активностью этого фермента и активностью всего нейрона[48]. Такое картирование проводилось на мутантных мышах с различными нарушениями работы мозжечка, в частности на мышах из линии reeler[49] и на трансгенной модели болезни Альцгеймера[50]. Эта техника также применяется для картирования областей мозга животных, активных в процессе обучения[51].
ДНК-баркодирование
[править | править код]Последовательность участка гена субъединицы I цитохром-с-оксидазы (длиной порядка 600 нуклеотидов) широко используется в проектах, связанных с ДНК-баркодированием — определением принадлежности организма к тому или иному таксону на основе коротких маркеров в его ДНК[52][53].
См. также
[править | править код]- НАДН-дегидрогеназный комплекс
- Сукцинатдегидрогеназа
- Цитохром-b6f-комплекс
- Цитохром-bc1-комплекс
- Респирасомы
Примечания
[править | править код]Источники
[править | править код]- ↑ 1 2 3 4 Ермаков, 2005, с. 243.
- ↑ Elena A. Gorbikova, Ilya Belevich, Mårten Wikström, and Michael I. Verkhovsky. The proton donor for OGraphicO bond scission by cytochrome c oxidase (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — March 12, 2008. — Vol. 105, no. 31. — P. 10733—10737. — doi:10.1073/pnas.0802512105.
- ↑ 1 2 Ермаков, 2005, с. 244.
- ↑ 1 2 Denis Pierron, Derek E. Wildman, Maik Hüttemann, Gopi Chand Markondapatnaikuni, Siddhesh Aras, Lawrence I. Grossman. Cytochrome c oxidase: Evolution of control via nuclear subunit addition (англ.) // Biochimica et Biophysica Acta - Bioenergetics : journal. — April 2012. — Vol. 1817, no. 4. — P. 590—597. — doi:10.1016/j.bbabio.2011.07.007. — PMID 21802404. Архивировано 25 марта 2019 года.
- ↑ 1 2 3 4 Hartmut Michel. Structure and Mechanism of Otto Warburg's Respiratory Enzyme, the Cytochrome c Oxidase (англ.) (2013). Дата обращения: 18 февраля 2016. Архивировано 4 марта 2016 года.
- ↑ Thomas L. Mason and Gottfried Schatz. Cytochrome c Oxidase from Bakers' Yeast II. SITE OF TRANSLATION OF THE PROTEIN COMPONENTS (англ.) // The Journal of Biological Chemistry : journal. — February 25. — Vol. 248. — P. 1355—1360. Архивировано 23 марта 2020 года.
- ↑ David Kelin. The History of Cell Respiration and Cytochrome. — Cambridge University Press, 1966.
- ↑ William W. Parson. Modern Optical Spectroscopy With Exercises and Examples from Biophysics and Biochemistry. — Springer, 2009. — ISBN 978-3-662-46777-0.
- ↑ Warburg, Otto Heinrich. Atmungsferment und Oxydasen (англ.) // Biochemische Zeitschrift[англ.] : journal. — 1929. — Vol. 214. — P. 1—3.
- ↑ D. Keilin, E. F. Hartree. Cytochrome and cytochrome oxidase (англ.) // Proceedings of the Royal Society B: Biological Sciences : journal. — 18 May 1939. — Vol. 127. — P. 167—191. — doi:10.1098/rspb.1939.0016. Архивировано 29 февраля 2016 года.
- ↑ 1 2 Mårten Wikström. Active site intermediates in the reduction of O2 by cytochrome oxidase, and their derivatives (англ.) // Biochimica et Biophysica Acta - Bioenergetics : journal. — April 2012. — Vol. 1817, no. 4. — P. 468—475. — doi:10.1016/j.bbabio.2011.10.010. Архивировано 9 марта 2022 года.
- ↑ Biological Oxidations:34. Colloquium - Mosbach / Edited by H. Sund and V. Ullrich. — Berlin ; Heidelberg ; New York ; Tokyo: Springer-Verlag, 1983. — P. 191. — ISBN 978-3-642-69469-1.
- ↑ Mårten KF Wikström. Proton pump coupled to cytochrome c oxidase in mitochondria. (англ.) // Nature : journal. — 1977 March 17. — Vol. 266. — P. 271—273. — doi:10.1038/266271a0. Архивировано 20 апреля 2016 года.
- ↑ Peter R. Rich. A perspective on Peter Mitchell and the chemiosmotic theory (англ.) // J Bioenerg Biomembr : journal. — 2008. — Vol. 40. — P. 407—410. — doi:10.1007/s10863-008-9173-7.
- ↑ R. Gregory. Biophysical Chemistry of Dioxygen Reactions in Respiration and Photosyntheses / Edited by Tore Vänngård. — Cambridge, UK: Cambridge University Press, 1988. — P. 36. — ISBN 0-521-36604-6.
- ↑ 1 2 3 4 5 6 7 8 9 10 Bernhard Kadenbacha, Maik Hüttemannb. The subunit composition and function of mammalian cytochrome c oxidase (англ.) // Mitochondrion : journal. — 2015. — September (vol. 24). — P. 64—76. — doi:10.1016/j.mito.2015.07.002. — PMID 26190566.
- ↑ Pérez-Martínez, X., Funes, S., Tolkunova, E., Davidson, E., King, M.P., González-Halphen, D. Structure of nuclear-localized cox3 genes in Chlamydomonas reinhardtii and in its colorless close relative Polytomella sp (англ.) // Current Genetics : journal. — 2002. — Vol. 40, no. 2. — P. 399—404. — doi:10.1007/s00294-002-0270-6. — PMID 11919679.
- ↑ Taanman J.W. Human cytochrome c oxidase: structure, function, and deficiency. (англ.) // J Bioenerg Biomembr. : journal. — 1997. — Vol. 29, no. 2. — P. 151—163. — PMID 9239540.
- ↑ 1 2 3 4 Ileana C. Sotoa, Flavia Fontanesib, Jingjing Liua, Antoni Barrientosa. Biogenesis and assembly of eukaryotic cytochrome c oxidase catalytic core (англ.) // et Biophysica Acta - Bioenergetics : journal. — 2012. — June (vol. 1817, no. 6). — P. 883—897. — doi:10.1016/j.bbabio.2011.09.005. — PMID 21958598.
- ↑ Balsa E., Marco R., Perales-Clemente E., Szklarczyk R., Calvo E., Landázuri M.O., Enríquez J.A. NDUFA4 is a subunit of complex IV of the mammalian electron transport chain (англ.) // Cell Metab.[англ.] : journal. — 2012. — September (vol. 16, no. 3). — P. 378—386. — doi:10.1016/j.cmet.2012.07.015. — PMID 22902835.
- ↑ Bernhard Kadenbacha, Maik Hüttemannb. The subunit composition and function of mammalian cytochrome c oxidase (англ.) // Mitochondrion : journal. — 2015. — September (vol. 15). — P. 64—76. — doi:10.1016/j.mito.2015.07.002. — PMID 26190566.
- ↑ 1 2 Sone N., Takagi T. Monomer-dimer structure of cytochrome-c oxidase and cytochrome bc1 complex from the thermophilic bacterium PS3. (англ.) // Biochim Biophys Acta[англ.] : journal. — 1990. — November (vol. 1020, no. 2). — P. 207—212. — doi:10.1016/0005-2728(90)90052-6. — PMID 2173952.
- ↑ 1 2 3 4 5 Amandine Maréchala, Brigitte Meunierb, David Leea, Christine Orengoa, Peter R. Richa. Yeast cytochrome c oxidase: A model system to study mitochondrial forms of the haem–copper oxidase superfamily (англ.) // Biochimica et Biophysica Acta - Bioenergetics : journal. — 2012. — April (vol. 1817, no. 4). — P. 620—628. — doi:10.1016/j.bbabio.2011.08.011. — PMID 21925484.
- ↑ A. Harvey Millar, Holger Eubel, Lothar Jansch, Volker Kruft, Joshua L. Heazlewood, Hans-Peter Braun. Mitochondrial cytochrome c oxidase and succinate dehydrogenase complexes contain plant specific subunits. (англ.) // Plant Mol Biol : journal. — 2004. — September (vol. 56, no. 1). — P. 77—90. — PMID 15604729.
- ↑ 1 2 Denis Pierron, Derek E. Wildman, Maik Hüttemann, Gopi Chand Markondapatnaikuni, Siddhesh Aras, Lawrence I. Grossman. Cytochrome c oxidase: Evolution of control via nuclear subunit addition. (англ.) // Biochimica et Biophysica Acta - Bioenergetics : journal. — April 2012. — Vol. 1817, no. 4. — P. 590—597. — doi:10.1016/j.bbabio.2011.07.007.
- ↑ Arnold S., Goglia F., Kadenbach B. 3,5-Diiodothyronine binds to subunit Va of cytochrome-c oxidase and abolishes the allosteric inhibition of respiration by ATP. (англ.) // Eur J Biochem. : journal. — 1998. — Vol. 252, no. 2. — P. 325—330. — doi:10.1046/j.1432-1327.1998.2520325.x. — PMID 9523704.
- ↑ K. M. Kocha, K. Reilly, D. S. M. Porplycia, J. McDonald, T. Snider, C. D. Moyes. Evolution of the oxygen sensitivity of cytochrome c oxidase subunit 4 (англ.) // American Physiological Society[англ.] : journal. — February 2015. — Vol. 308, no. 4. — doi:10.1152/ajpregu.00281.2014. Архивировано 2 марта 2016 года.
- ↑ 1 2 Tsukihara T., Aoyama H., Yamashita E., Tomizaki T., Yamaguchi H., Shinzawa-Itoh K., Nakashima R., Yaono R., Yoshikawa S. Structures of metal sites of oxidized bovine heart cytochrome c oxidase at 2.8 A (англ.) // Science : journal. — 1995. — August (vol. 269, no. 5227). — P. 1069—1074. — doi:10.1126/science.7652554. — PMID 7652554.
- ↑ Ермаков, 2005, с. 245.
- ↑ 1 2 3 4 Alexander A. Konstantinov. Cytochrome c oxidase: Intermediates of the catalytic cycle and their energy-coupled interconversion (англ.) // FEBS letters[англ.] : journal. — March 2012. — Vol. 586, no. 5. — P. 630—639. — doi:10.1016/j.febslet.2011.08.037.
- ↑ 1 2 Ilya Belevich & Michael Verkhovsky. Homepage of the Molecular Biophysics Group (англ.). Дата обращения: 20 февраля 2016. Архивировано 6 марта 2016 года.
- ↑ Vivek Sharmaa, Giray Enkavia, Ilpo Vattulainena, Tomasz Róga, and Mårten Wikströmc. Proton-coupled electron transfer and the role of water molecules in proton pumping by cytochrome c oxidase (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — January 2015. — Vol. 112, no. 7. — P. 2040—2045. — doi:10.1073/pnas.1409543112.
- ↑ 1 2 Elisa Fadda, Ching-Hsing Yu, Régis Pomès. Electrostatic control of proton pumping in cytochrome c oxidase (англ.) // BBA : journal. — March 2008. — Vol. 1777, no. 3. — P. 277—284. — doi:10.1016/j.bbabio.2007.11.010.
- ↑ Ileana C. Sotoa, Flavia Fontanesib, Jingjing Liua, Antoni Barrientos. Biogenesis and assembly of eukaryotic cytochrome c oxidase catalytic core (англ.) // Biochimica et Biophysica Acta[англ.] : journal. — June 2012. — Vol. 1817, no. 6. — P. 883—897. — doi:10.1016/j.bbabio.2011.09.005.
- ↑ 1 2 3 4 Filipa L. Sousaa, Renato J. Alvesb, Miguel A. Ribeiroa, José B. Pereira-Lealb, Miguel Teixeiraa, Manuela M. Pereiraa. The superfamily of heme–copper oxygen reductases: Types and evolutionary considerations (англ.) // Biochimica et Biophysica Acta - Bioenergetics : journal. — April 2012. — Vol. 1817, no. 4. — P. 629—637. — doi:10.1016/j.bbabio.2011.09.020.
- ↑ 1 2 3 4 5 Hemp J., Gennis RB. Diversity of the heme-copper superfamily in archaea: insights from genomics and structural modeling. (англ.) // Results Probl Cell Differ. : journal. — 2008. — Vol. 45. — P. 1—31. — doi:10.1007/400_2007_046.. — PMID 18183358.
- ↑ Shinya Yoshikawa and Atsuhiro Shimada. Reaction Mechanism of Cytochrome c Oxidase (англ.) // Chem. Rev.[англ.] : journal. — 2015. — Vol. 115, no. 4. — P. 1936—1989. — doi:10.1021/cr500266a.
- ↑ Sergey A. Siletsky, Ilya Belevich, Audrius Jasaitis, Alexander A. Konstantinov, Mårten Wikström. Time-resolved single-turnover of ba3 oxidase from Thermus thermophilus (англ.) // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — 2007-12. — Vol. 1767, iss. 12. — P. 1383–1392. — doi:10.1016/j.bbabio.2007.09.010. Архивировано 26 января 2020 года.
- ↑ Sergey A. Siletsky, Ilya Belevich, Nikolai P. Belevich, Tewfik Soulimane, Mårten Wikström. Time-resolved generation of membrane potential by ba cytochrome c oxidase from Thermus thermophilus coupled to single electron injection into the O and OH states (англ.) // Biochimica et Biophysica Acta (BBA) - Bioenergetics. — 2017-11. — Vol. 1858, iss. 11. — P. 915–926. — doi:10.1016/j.bbabio.2017.08.007. Архивировано 26 января 2020 года.
- ↑ 1 2 Sadacharan S.K., Singh B., Bowes T., Gupta R.S. Localization of mitochondrial DNA encoded cytochrome c oxidase subunits I and II in rat pancreatic zymogen granules and pituitary growth hormone granules (англ.) // Histochem. Cell Biol.[англ.] : journal. — 2005. — Vol. 124, no. 5. — P. 409—421. — doi:10.1007/s00418-005-0056-2. — PMID 16133117.
- ↑ Gupta R.S., Ramachandra N.B., Bowes T., Singh B. Unusual cellular disposition of the mitochondrial molecular chaperones Hsp60, Hsp70 and Hsp10 (англ.) // Novartis Found. Symp. : journal. — 2008. — Vol. 291. — P. 59—68; discussion 69—73, 137—40. — doi:10.1002/9780470754030.ch5. — PMID 18575266.
- ↑ 1 2 Soltys B.J., Gupta R.S. Mitochondrial proteins at unexpected cellular locations: export of proteins from mitochondria from an evolutionary perspective (англ.) // Int. Rev. Cytol.[англ.] : journal. — 2000. — Vol. 194. — P. 133—196. — doi:10.1016/s0074-7696(08)62396-7. — PMID 10494626.
- ↑ Soltys B.J., Gupta R.S. Mitochondrial-matrix proteins at unexpected locations: are they exported? (англ.) // Trends Biochem. Sci.[англ.] : journal. — 1999. — Vol. 24, no. 5. — P. 174—177. — doi:10.1016/s0968-0004(99)01390-0. — PMID 10322429.
- ↑ Alonso J.R., Cardellach F., López S., Casademont J., Miró O. Carbon monoxide specifically inhibits cytochrome c oxidase of human mitochondrial respiratory chain (англ.) // Pharmacol. Toxicol. : journal. — 2003. — September (vol. 93, no. 3). — P. 142—146. — doi:10.1034/j.1600-0773.2003.930306.x. — PMID 12969439.
- ↑ Chris E. Cooper & Guy C. Brown. The inhibition of mitochondrial cytochrome oxidase by the gases carbon monoxide, nitric oxide, hydrogen cyanide and hydrogen sulfide: chemical mechanism and physiological significance (англ.) // Bioenerg Biomembr : journal. — 2008. — October (vol. 40). — P. 533—539. — doi:10.1007/s10863-008-9166-6.
- ↑ Pecina P., Houstková H., Hansíková H., Zeman J., Houstek J. Genetic defects of cytochrome c oxidase assembly (неопр.) // Physiol Res. — 2004. — Т. 53 Suppl 1. — С. S213—23. — PMID 15119951. Архивировано 18 июля 2011 года.
- ↑ 1 2 Zee J.M., Glerum D.M. Defects in cytochrome oxidase assembly in humans: lessons from yeast (англ.) // Biochem. Cell Biol.[англ.] : journal. — 2006. — December (vol. 84, no. 6). — P. 859—869. — doi:10.1139/o06-201. — PMID 17215873.
- ↑ Wong-Riley M.T. Cytochrome oxidase: an endogenous metabolic marker for neuronal activity. (англ.) // Trends Neurosci.[англ.] : journal. — 1989. — Vol. 12, no. 3. — P. 94—111. — doi:10.1016/0166-2236(89)90165-3. — PMID 2469224.
- ↑ Strazielle C., Hayzoun K., Derer M., Mariani J., Lalonde R. Regional brain variations of cytochrome oxidase activity in Relnrl-orl mutant mice. (англ.) // J. Neurosci. Res.[англ.] : journal. — 2006. — April (vol. 83, no. 5). — P. 821—831. — doi:10.1002/jnr.20772. — PMID 16511878.
- ↑ Strazielle C., Sturchler-Pierrat C., Staufenbiel M., Lalonde R. Regional brain cytochrome oxidase activity in beta-amyloid precursor protein transgenic mice with the Swedish mutation. (англ.) // Neuroscience[англ.] : journal. — Elsevier, 2003. — Vol. 118, no. 4. — P. 1151—1163. — doi:10.1016/S0306-4522(03)00037-X. — PMID 12732258.
- ↑ Conejo N.M., González-Pardo H., Gonzalez-Lima F., Arias J.L. Spatial learning of the water maze: progression of brain circuits mapped with cytochrome oxidase histochemistry. (англ.) // Neurobiol. Learn. Mem.[англ.] : journal. — 2010. — Vol. 93, no. 3. — P. 362—371. — doi:10.1016/j.nlm.2009.12.002. — PMID 19969098.
- ↑ Paul D. N. Hebert, Alina Cywinska, Shelley L. Ball, Jeremy R. deWaard. Biological identifications through DNA barcodes (англ.) // Proceedings of the Royal Society of London B: Biological Sciences : journal. — February 2003. — Vol. 270, no. 1512. — P. 313—321. — doi:10.1098/rspb.2002.2218. Архивировано 19 апреля 2016 года.
- ↑ Živa Fišer Pečnikar, Elena V. Buzan. 20 years since the introduction of DNA barcoding: from theory to application (англ.) // Journal of Applied Genetics : journal. — February 2014. — Vol. 55, no. 1. — P. 43—52. — ISSN 2190-3883. — doi:10.1007/s13353-013-0180-y.
Литература
[править | править код]- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Дэвид Л. Нельсон, Майкл М. Кокс. Основы биохимии Ленинджера. Биоэнергетика и метаболизм. = Leninger Principles of Biochemistry. — Бином. Лаборатория знаний, 2012. — Т. 2. — С. 344. — 692 с. — (Лучший зарубежный учебник). — ISBN 978-5-94774-365-4.
Ссылки
[править | править код]- Instituto Gulbenkian de Ciência & Universidade Nova de Lisboa. Heme-copper oxygen reductases (HCOs) classifier (сентябрь 2010).
- UMich Orientation of Proteins in Membranes families/superfamily-4
- MeSH Cytochrome-c+Oxidase
Эта статья входит в число избранных статей русскоязычного раздела Википедии. |