Динатриевая соль этилендиаминтетрауксусной кислоты
| Динатриевая соль этилендиаминтетрауксусной кислоты | |
|---|---|
 | |
 | |
| Общие | |
| Сокращения | EDTA-Na2, ЭДТА-Na2 |
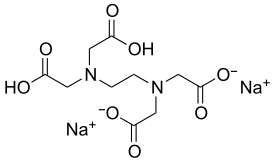
| Хим. формула | C10H14N2Na2O8 |
| Физические свойства | |
| Молярная масса |
безводный: 336,21, дигидрат: 372,24 г/моль |
| Химические свойства | |
| Константа диссоциации кислоты | 1,99(1), 2,67(2), 6,16(3), 10,26(4) |
| Растворимость | |
| • в воде | 10,5 г/100 мл |
| Классификация | |
| Рег. номер CAS |
безводный: 139-33-3, дигидрат: 6381-92-6 |
| PubChem | 8759, 13020083, 57339238, 59718226 и 18401221 |
| Рег. номер EINECS | безводный: 205-358-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E386 |
| ChEBI | 64734 |
| ChemSpider | 8429 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дина́триевая соль этилендиаминтетрау́ксусной кислоты́ (другие названия: комплексо́н-III, трило́н Б, хелато́н III) — органическое соединение, натриевая соль этилендиаминтетрауксусной кислоты, представляет собой белый кристаллический порошок или кристаллы белого цвета. Хорошо растворяется в воде и щелочах, очень слабо растворяется в спирте; водный 1 % раствор имеет рН 4,5; препарат с массовой долей 5 % — рН 4—5,5.
Образует очень устойчивые комплексные соединения с большинством катионов.
Вступает в реакцию с сильными окислителями.
При хранении вещества не допускать его контакта с алюминием, цинком, никелем, медью и медными сплавами.
Описание
[править | править код]Представляет собой кристаллический порошок белого цвета. Растворимость в воде составляет 10,5 г / 100 мл (20° C)[1].
Торговое название «трилон Б» было введено фирмой BASF и использовалось как торговая марка, но очень быстро вошло во все языки и используется другими фирмами для обозначения продукта.
Используются также тринатриевая и тетранатриевая соль этилендиаминтетрауксусной кислоты, но для связывания того же количества ионов их надо брать в большем количестве. Трилон Б придаёт растворимость нерастворимым солям многих металлов. Его действие основано на извлечении ионов металла из молекул нерастворимых солей металлов и замещения в них ионами натрия, почти все соли которого растворимы в воде, причём независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой соли металла. Это ценное свойство нашло большое применение в аналитической химии.
Пример растворения нерастворимого осадка карбоната кальция:
- ЭДТА-Na2 (растворим) + CaCO3 (нерастворим) → ЭДТА-Ca(растворим) + Na2CO3 (растворим).
Аналогичное взаимодействие происходит с солями меди, железа в степени окисления II и III, магния и марганца. Причём трилон Б не является окислителем и не взаимодействует с металлами, находящимися в нулевой степени окисления.
Применение
[править | править код]Основное применение: делает нерастворимые соли металлов растворимыми.
- в аналитической химии для качественного и количественного определения многих катионов и анионов, напр.: Ca, Mg, Cu, Со, Ni, Zn, Fe, Mo, Al, редкоземельных элементов, Tc, U, SO42−, PO43−, CN− и др. (см. Комплексонометрия), при потенциометрических, полярографических и амперометрических определениях.
- в производстве медицинских препаратов и при отравлениях тяжелыми металлами;
- в производстве препаратов для бытовой химии и в синтетических моющих средствах;
- в сельском хозяйстве и гидропонном растениеводстве, для повышения стабильности железа в питательных растворах, а также для улучшения усвоения питательных элементов при внекорневой подкормке растений;
- при консервировании и др.;
- в реставрационных работах для удаления коррозии с изделий из бронзы и других цветных металлов, особо хорошо себя проявляет в очистке изделий из серебра[2];
- в промышленности для промывки теплоэнергетического оборудования, труб, трубопроводов котлов от накипи и ржавчины, уменьшающих полезное сечение, водоподготовки в котельных и теплосетях, с этой же целью трилон Б применяют для очистки автомобильных систем охлаждения, защиты стиральных машин от накипи как отдельный препарат или в комплексе со стиральным порошком;
- в виде стабилизатора в процессах полимеризации;
- в целлюлозно-бумажной промышленности;
- при производстве каучука;
- аммиачный раствор трилона Б (5 % аммиака, 3 % трилона Б) позволяет быстро и эффективно восстанавливать свинцовые аккумуляторы за счёт десульфатации свинцовых пластин[источник не указан 1744 дня];
- в фотографии трилон Б применяют в качестве водоумягчителя в различных растворах[3], при приготовлении таких растворов на дистиллированной воде, трилон Б можно не применять, но в рецептах отбеливающих растворов в цветной фотографии трилон Б служит для получения непосредственно в растворе железной соли трилона Б, которая обладает свойством окислять металлическое серебро[4]; в таких растворах исключать трилон Б нельзя; тем не менее, подобная рецептура получения железной соли трилона Б использовалась только в устаревших процессах Agfa/Orwo и для цветных материалов СССР, выпуск которых полностью прекращён в конце 1990-х годов; в современных процессах C-41, E-6 и RA-4 железная соль трилона Б по-прежнему применяется для этой цели, однако подобный способ её получения непригоден по причине загрязнения раствора, поэтому необходимо использовать чистый реактив[5].
Опасность для человека
[править | править код]Может вызвать раздражение кожи, слизистых оболочек глаз и дыхательных путей и вызвать симптомы бронхита.
Средства индивидуальной защиты
[править | править код]Противопылевой респиратор, средства защиты лица, глаз.
Меры первой помощи
[править | править код]Вынести пострадавшего на свежий воздух, снять загрязнённую одежду. Глаза и кожные покровы тщательно и обильно промыть водой. Оттягивать веки от глазных яблок для более полного промывания. При проглатывании прополоскать рот, дать воды для питья.
См. также
[править | править код]Примечания
[править | править код]- ↑ Hart, 2011.
- ↑ Внимание! Препарат может безнадёжно испортить изделие, нарушив патину!
- ↑ Гурлев, 1988, с. 301.
- ↑ Гурлев, 1988, с. 287.
- ↑ Шадрин, 1992, с. 18.
Литература
[править | править код]- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Шадрин А. Е. Процесс E-6: лабораторная обработка цветных обращемых пленок типа Эктахром. — СПб.: Тускарора, 1992. — ISBN 5-89977-008-2.
- Hart J. R. Ethylenediaminetetraacetic Acid and Related Chelating Agents : статья // Ulmann's encyclopedia of industrial chemistry. — Wiley-VCH Verlag GmbH & Co. KGaA, 2011. — Т. 13. — С. 573—578. — doi:10.1002/14356007.a10_095.pub2.
Это заготовка статьи по химии. Помогите Википедии, дополнив её. |
Для улучшения этой статьи желательно:
|
