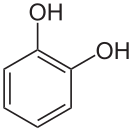
Пирокатехин
| Пирокатехин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1,2-дигидроксибензол | ||
| Традиционные названия | пирокатехин, катехол | ||
| Хим. формула | C6H6O2 | ||
| Физические свойства | |||
| Молярная масса | 110,11 г/моль | ||
| Плотность | 1,34 ± 0,01 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 105 °C | ||
| • кипения | 240 °C | ||
| • вспышки | 261 ± 1 ℉ | ||
| Пределы взрываемости | 1,4 ± 0,1 об.% | ||
| Давление пара | 10 ± 1 мм рт.ст. | ||
| Классификация | |||
| Рег. номер CAS | 120-80-9 | ||
| PubChem | 289 | ||
| Рег. номер EINECS | 204-427-5 | ||
| SMILES | |||
| InChI | |||
| RTECS | UX1050000 | ||
| ChEBI | 18135 | ||
| ChemSpider | 13837760 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пирокатехи́н (1,2-дигидроксибензол) — органическое соединение, двухатомный фенол, имеющий химическую формулу С6Н4(ОН)2. Один из трёх возможных изомеров дигидроксибензола, два других — гидрохинон и резорцин. Выглядит как бесцветные кристаллы с запахом фенола. Сильный восстановитель.
Синонимы: ортодигидроксибензол, ортодиоксибензол, бренцкатехин, динол, елконал, кахин.
История[править | править код]
Впервые выделено в 1839 году химиком из Германии Х. Рейншем при сухой перегонке экстракта катехина, полученного из акации катеху. Как проявляющее вещество предложено в 1880 году Й. М. Эдером и В. Тотом (англ. V. Toth)[1][2][3].
Физические свойства[править | править код]
Белые кристаллы с запахом фенола, на свету и воздухе темнеющие до коричневого цвета. Молярная масса 110,11 г/моль. Температура плавления 105 °C, кипения 240 °C[4]. Легко растворим в воде (43 г в 100 мл воды). Хранить следует в темной химической посуде.
Химические свойства[править | править код]
Проявляет свойства фенолов. Образует моно- и дисоли с основаниями, хелаты — с некоторыми металлами, в частности с титаном, цирконием, ниобием, оловом, свинцом. Проявляет сильные восстанавливающие свойства. Под действием солей серебра окисляется в 1,2-бензохинон по гетеролитическому механизму[4]:
Также может окисляться кислородом по гомолитическому механизму, образуя оксантрен-2,3-дион[4].
При сплавлении пирокатехина с фталевым ангидридом образуются красители — ализарин и гистазарин[4].
Аналитическое определение[править | править код]
Качественное определение пирокатехина выполняется при помощи реакции с хлорным железом, при этом появляется зелёное окрашивание, которое должно перейти в красное при добавлении соды и аммиака[4].
Фотографические свойства[править | править код]
Пирокатехин относится к медленно работающим проявляющим веществам, но при этом не даёт значительной вуали. По фотографическим свойствам и активности в составе растворов похож на гидрохинон, в особенности это касается взаимодействия с бромидами. Известно, что на первой ступени проявления основной активной формой выступает одновалентный ион пирокатехина[5][1].
Подобно пирогаллолу, пирокатехин при обработке чёрно-белых фотографических материалов в проявляющих растворах, содержащих низкую концентрацию сохраняющих веществ, образует, помимо серебряного еще и вторичное изображение, а также обладает дубящими свойствами. Упомянутое вторичное изображение состоит из окрашенных продуктов окисления пирокатехина и его присутствие улучшает места с низкой плотностью, что используется в фотографии, в частности для целей усиления. Пирокатехин способен создавать сильное изображение в проявителях, содержащих большое количество растворителей галогенида серебра, что делает его пригодным для монованн (проявляюще-фиксирующих растворов)[1][5].
Получение[править | править код]
На первой стадии получают 2-хлорфенол путем хлорирования фенола в бензоле и последующим разделением изомеров несколькими фракционными перегонками, либо из 2-дихлорбензола под давлением в 40—45 атм. На второй стадии из 2-хлорфенола и едкого натра в автоклаве под давлением 16 атм. получают натриевую соль пирокатехина, из которой путём подкисления серной кислотой получают основание[6].
Применение[править | править код]
Применяют в фотографии как проявитель, в производстве красителей, лекарственных веществ (например, адреналина)[4].
Этерифицированием из пирокатехина получают гваякол, — исходное вещество для синтеза ванилина[4].
Нахождение в природе[править | править код]
Как сам пирокатехин, так и его производные были найдены в различных растениях, как правило, в древесине и смолах, что можно использовать для их получения[3]. Пирокатехин – содержится в кофе и обладает противовоспалительной активностью[7].
Токсичность[править | править код]
Пирокатехин является аллергеном, а также имеет мутагенные и канцерогенные свойства.
Вызывает сильное раздражение кожи и дерматиты[8].
Примечания[править | править код]
- ↑ 1 2 3 Haist, 1979, с. 174.
- ↑ Рубцов, 1890—1907.
- ↑ 1 2 Рудаков.
- ↑ 1 2 3 4 5 6 7 Пуца, 1992.
- ↑ 1 2 Иофис, 1981.
- ↑ Беркенгейм, 1942, с. 104—107.
- ↑ Megumi Funakoshi-Tago, Mari Matsutaka, Shingo Hokimoto, Kenji Kobata, Kenji Tago. Coffee ingredients, hydroquinone, pyrocatechol, and 4-ethylcatechol exhibit anti-inflammatory activity through inhibiting NF-κB and activating Nrf2 (англ.) // Journal of Functional Foods. — 2022-03-01. — Vol. 90. — P. 104980. — ISSN 1756-4646. — doi:10.1016/j.jff.2022.104980. Архивировано 23 мая 2022 года.
- ↑ Новый справочник химика и технолога. Радиоактивные вещества. Вредные вещества. Гигиенические нормативы / Редкол.: Москвин А. В. и др.. — СПб.: АНО НПО «Профессионал», 2004. — 1142 с.
Литература[править | править код]
- Беркенгейм А. М. Практикум по синтетическим лекарственным и душистым веществам и фотореактивам. — М.,Л.: Государственное научно-техническое издательство химической литературы, 1942.
- Пирокатехин // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — С. 237—238. — 447 с.
- Пуца Г. И. Пирокатехин // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- Рубцов П. П., Менделеев Д. И. Фенолы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Barner B. A. Catechol // Encyclopedia of Reagents for Organic Synthesis : [англ.] / Ed: L. Paquette. — New York : J. Wiley & Sons, 2004. — doi:10.1002/047084289.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
- Panico, R.; & Powell, W. H. (Eds.). A Guide to IUPAC Nomenclature of Organic Compounds 1993 (англ.). — Oxford: Blackwell Science, 1994. — ISBN 0-632-03488-2.
Ссылки[править | править код]
- Рудаков О. Б. Пирокатехин. Большая Российская Энциклопедия. Министерство культуры Российской Федерации. Дата обращения: 22 марта 2019. Архивировано 21 марта 2019 года.
- International Chemical Safety Card 0411 Архивная копия от 14 декабря 2006 на Wayback Machine
- NIOSH Pocket Guide to Chemical Hazards Архивная копия от 8 декабря 2006 на Wayback Machine
- IARC Monograph: «Catechol»
- IUPAC Nomenclature of Organic Chemistry Архивная копия от 8 июня 2011 на Wayback Machine (online version of the «Blue Book»)