Гематоэнцефалический барьер

1. Эпендима
2. Нейрон
3. Аксон
4. Шванновская клетка
5. Астроцит
6. Миелин
7. Микроглия
8. Капилляр
Гема́то-энцефали́ческий барье́р (ГЭБ) (от др.-греч. αἷμα, род.п. αἷματο — «кровь» и др.-греч. εγκεφαλος — «головной мозг») — физиологический барьер между кровеносной системой и центральной нервной системой. ГЭБ имеется у всех позвоночных, главной его функцией является поддержание гомеостаза мозга.
Гемато-энцефалический барьер защищает нервную ткань от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают ткань мозга как чужеродную. Он выполняет функцию высокоселективного фильтра, через который в мозг поступают питательные вещества, а в кровеносное русло выводятся продукты его жизнедеятельности.
Вместе с тем, наличие ГЭБ затрудняет лечение многих заболеваний центральной нервной системы, так как он не пропускает целый ряд лекарственных препаратов.
История изучения

Первое свидетельство о существовании ГЭБ было получено в 1885 году Паулем Эрлихом. Он обнаружил, что введённый в кровеносное русло крысы краситель распространился по всем органам и тканям, кроме мозга[1]. В 1904 году он высказал неверное предположение о том, что краситель не проникает в ткань мозга при внутривенном введении, так как не имеет к ней сродства[2].
Эдвин Голдманн, ученик Эрлиха, в 1909 года отметил, что введённый внутривенно краситель трипановый синий, не проникая в ткань мозга, окрашивает сосудистое сплетение его желудочков[3]. В 1913 году он ввёл краситель в спинномозговую жидкость собаки и лошади. Было выявлено, что краситель попал в ткань головного и спинного мозга, не окрасив периферических органов и тканей[4]. На основании этих опытов, Голдманн предположил наличие барьера между мозгом и кровью, который задерживает нейротоксические вещества[5].
В 1898 году Артур Бидль и Рудольф Кра́ус провели эксперименты с желчными кислотами. При введении последних в кровеносное русло нейротоксический эффект отсутствовал, однако при инъекции непосредственно в ткань мозга развивалась кома[6].
Немецкий невропатолог Макс Левандовский повторил опыты Бидля и Крауса с гексацианофератом калия. Получив схожие результаты, он впервые использовал термин "гемато-энцефалический барьер"[7] [8]. Термин "гемато-энцефалический барьер" в 1921 году был также использован Линой Штерн — первой женщиной-членом Академии наук СССР[9]. Штерн, основываясь на анализе большого экспериментального материала, впервые сформулировала основы учения о ГЭБ и определила его значение для деятельности центральной нервной системы[10].
В 1890 году Чарльз Рой и будущий лауреат Нобелевской премии Шеррингтон высказали предположение о том, что кровоснабжение мозга напрямую зависит от его функциональной активности.
англ. The brain possesses an intrinsic mechanism by which its vascular supply can be varied locally in correspondence with local variations of functional activity
Мозг обладает внутренними механизмами, которые обеспечивают его кровоснабжение в зависимости от изменений функциональной активности[11] [12]
В 1930-х годах было проведено разграничение гемато-энцефалического и гемато-ли́кворного барьеров[5] [13] [14].
Окончательные доказательства существования ГЭБ были получены при проведении электрономикроскопических исследований в 1960-х годах[15] [16].
Функции
Масса головного мозга человека составляет приблизительно 2 % от массы его тела. При этом потребность в кислороде центральной нервной системы составляет 20 % от потребностей всего организма. Также, в противоположность другим органам, мозг обладает наименьшими запасами питательных веществ. Нервные клетки не могут обеспечить свои энергетические потребности путём одного лишь анаэробного гликолиза. Прекращение поступления крови к мозгу в течение нескольких секунд приводит к потере сознания, а через 10 минут отмечается полная гибель нейронов [15]. Данная особенность головного мозга требует от ГЭБ активного транспорта кислорода и питательных веществ[17].
Нормальное функционирование мозга возможно также лишь в условиях электролитного и биохимического гомеостаза. Колебания pH, концентрации калия крови и других показателей не должны отражаться на ткани головного мозга. Попадение циркулирующих в кровеносном русле нейромедиаторов в нервную ткань может разбалансировать её работу [15]. Также мозг должен быть защищён от попадания в него чужеродных агентов, таких как ксенобиотики и патогенные микроорганизмы. ГЭБ представляет собой в том числе и иммунологический барьер, так как является непроницаемым для различных микроорганизмов, антител и лейкоцитов[18][19].
Чтобы обеспечить задачи питания, выведения продуктов жизнедеятельности и поддержания гомеостаза вещества мозга, система сосудов центральной нервной системы имеет целый ряд структурно-функциональных отличий от сосудов других органов и тканей[15].
Изменения в функционировании ГЭБ могут вызывать нарушения функционирования центральной нервной системы. Целый ряд неврологических заболеваний напрямую или косвенно связан с его повреждением[17].
Строение



Существенным элементом структуры ГЭБ являются эндотелиальные клетки. Особенностью эндотелия сосудистой стенки церебральных сосудов является наличие между ними плотных межклеточных контактов. В структуре ГЭБ также большое значение имеют перици́ты и астроци́ты[15]. Межклеточные промежутки между эндотелиальными клетками, перицитами и астроцитами нейроглии ГЭБ являются наиболее узкими в сравнении с другими клетками организма. Эти три вида клеток являются структурной основой ГЭБ не только у человека, но и у большинства позвоночных[20] [21].
Эндотелий
Капиллярные сосуды выстланы эндотелиальными клетками. Эндотелий периферических сосудов содержит открытые промежутки (фенестра́ции) диаметром около 50 нм и межклеточные щели от 0,1 до 1 мкм. Через эти пространства происходит свободная циркуляция воды и растворённых в ней веществ между кровью и межклеточным пространством. В церебральных сосудах между эндотелиальными клетками отсутствуют как фенестрации, так и межклеточные щели[22]. Таким образом можно говорить о сплошной эндотелиальной выстилке просвета капилляров мозга[23].
Другим отличием эндотелия церебральных капилляров от периферических является низкое количество в них пиноцито́зных пузырьков (вези́кул)[24] [8].
В то же время количество митохондрий в эндотелиальных клетках сосудов мозга в 5-10 раз выше, чем в эндотелии периферических сосудов. Митохондрии являются органеллами, синтезирующими молекулы АТФ, являющиеся основным источником энергии для клетки. Большое количество митохондрий, соответственно, является показателем значительных энергетических потребностей эндотелиальных клеток ГЭБ, что связано с процессами активного транспорта и обмена веществ[19].
ГЭБ является также метаболическим или ферментативным (энзиматическим) барьером [5] [25] [26] [27] [28]. На поверхности клеточных мембран эндотелиальных клеток ГЭБ находится целый ряд ферментов в значительно большем количестве, чем на других клетках паренхимы. Среди них стоит отметить гамма-глутамилтрансферазы и фосфатазы (в частности глюкоза-6-фосфатазу), катехол-О-метилтрансферазу, моноаминоксидазу и цитохром Р450[29] [30] [31]. В связи с большой концентрацией различных ферментов в эндотелиальных клетках ГЭБ, многие вещества при транспортировании через цитоплазму эндотелия метаболизируются[8]. При этом по высоте эндотелиальная клетка ГЭБ составляет от 0,3 до 0,5 мкм. Энтероциты, эпителиальные клетки кишечника, к примеру имеют в высоту 17-30 мкм[32].

Соотношение холестерина к фосфолипидам в эндотелиальных клетках ГЭБ такое же, как и в эндотелиальных клетках периферических сосудов, и составляет ≈ 0,7[33]. Пассивный транспорт через клеточные мембраны ГЭБ мало чем отличается от пассивной диффузии в других эндотелиальных клетках[34]. В мембранах эндотелиальных клеток содержится большое количество каналов, которые свободно пропускают молекулы воды. Они делают возможным свободную диффузию моллекул воды как в направлении мозга, так и кровеносной системы[35].
Отсутствие фенестраций и небольшое число пиноцитарных везикул делают эндотелиальную выстилку капилляров мозга механическим барьером для крупных молекул и инородных веществ. Кроме этого, ГЭБ обладает значительным электрическим сопротивлением — около 1500—2000 Ом. К примеру, электрическое сопротивление для стенок капилляров мышечной ткани составляет 30 Ом[36].
Плотные контакты
Эндотелиальные клетки плотно прилежат к другу. Между соседними клетками образуются так называемые плотные контакты. Они вносят значительный вклад в обеспечении главной функции ГЭБ — предотвращении проникновения в ткань мозга различных нежелательных веществ из кровеносного русла[37] [38]. Плотные контакты между эндотелиальными клетками блокируют межклеточный (парацеллюля́рный) пассивный транспорт[39] [40] [41]. При этом блокируется парацеллюлярный транспорт веществ как из кровеносного русла в ткань мозга, так и в обратном направлении — из мозга в кровь[21].
Большое количество трансмембранных белков, таких как окклюди́н, разнообразные клауди́ны и замыкательные адгезионные молекулы связывают латеральные отделы клеточных стенок между собой, участвуют в формировании плотных контактов и делают возможным межклеточный транспорт и обмен веществ[42]. Основными белками, обеспечивающими адгезию эндотелиальных клеток и формирование плотных контактов, являются клаудин-5 и клаудин-24 [43]. Нокаут гена CLDN5, ответственного за синтез белка клаудина-5, приводило у экспериментальных мышей к тому, что их ГЭБ становился проницаемым для молекул с молярной массой до 800 г/моль. Такие генетически изменённые животные умирали через несколько часов после рождения[44].
Базальная мембрана

Эндотелиальные клетки полностью покрывают подлежащий белковый слой, называемый база́льной мембраной[23]. Вертикальный размер базальной мембраны колеблется от 40 до 50 нм. Она различима только под электронным микроскопом. Состоит в основном из коллагена IV типа, гепаринсульфат-протеоглика́нов, ламини́нов, фибронекти́на и других белков внеклеточного матрикса. Со стороны мозга базальная мембрана ограничена плазматической мембраной пластинчатых окончаний отростков астроцитов[8] [39].
Перициты

Перициты, ранее называвшиеся по имени первооткрывателя Шарля Мари Бенджами́на Руже́ (1824—1904) клетками Руже[45], являются составной частью ГЭБ[46]. Они обладают несколькими важными для его функционирования свойствами: способностью к сокращению, регулированию функций эндотелия и макрофага́льной активностью[47].

Около 20 % поверхности эндотелиальных клеток церебральных капилляров покрыты относительно маленькими, овальными перицитами. Каждая 2—4-я эндотелиальная клетка имеет контакт с клеткой-перицитом[21]. В основном перициты располагаются в местах контакта эндотелиальных клеток[48] [49]. Перициты имеются практически во всех артериолах, венулах и капиллярах организма. Уровень покрытия ими эндотелиального слоя капилляра коррелирует с проницаемостью сосудистой стенки. В органах и тканях с проницаемой сосудистой стенкой они могут мигрировать из кровеносного русла в межклеточное пространство. Так, например, в капиллярах скелетной мускулатуры соотношение перициты:эндотелиоци́ты составляет 1:100[50] [51].
Перициты, как и эндотелиоциты, располагаются на базальной мембране[23].
Также перициты синтезируют целый ряд вазоактивных веществ[51] и играют важную роль в а́нгиогене́зе[52] [53].
Клеточные контакты перицит — эндотелиоцит
Перициты крепко связаны с эндотелиоцитами. Эта связь осуществляется благодаря трём типам контактов: щелевым соединениям, фокальным адгезиям и инвагинациям мембраны одной клетки в полость другой[47]. Щелевые соединения непосредственно связывают цитоплазму двух клеток, являясь проницаемыми для ионов и небольших молекул[54]. С помощью фокальных адгезий осуществляется прочная механическая связь двух типов клеток[55]. Инвагинации участков цитоплазмы одной клетки в другую обеспечивают как механическое связывание, так и межклеточный обмен веществ[47] [56].
Благодаря тесным контактам клетки опосредованно влияют на митотическую активность, экспрессию генов и, соответственно, фенотип друг друга[52].
Сократительная функция
Перициты содержат большое количество способного к сокращению белка актина. Благодаря этой своей структурной особенности они в состоянии изменять просвет капилляров и таким образом регулировать местное кровяное давление[57] [58].
Макрофагальная активность
Данное свойство характерно только для церебральных перицитов. В капиллярной сети мозга они выполняют функцию макрофагов. Соответственно в цитоплазме церебральных перицитов располагается большое количество лизосом. В культуре тканей доказана способность перицитов к фагоцитозу[47] [59] [60] и презентации антигенов [61] [62].

Макрофагальные свойства перицитов образуют «вторую линию защиты мозга» от нейротоксических молекул, которые преодолели барьер эндотелиальных клеток[63]. Таким образом они являются важной составной частью иммуной системы мозга. Сбой макрофагальной активности перицитов может стать одним из факторов развития целого ряда аутоиммунных заболеваний. Имеются данные об опосредованной роли перицитов в развитии болезни Альцгеймера[64] [65].
Астроциты

Астроциты — большие нейроглиальные клетки звёздчатой формы. Своими отростками они выстилают стенки мозговых капилляров со стороны мозговой ткани. В то же время, несмотря на то, что пластинчатыми окончаниями их клеточных отростков выстлано около 99% капиллярных сосудов, астроциты не выполняют прямой барьерной функции[21] [66]. Астроциты тесно взаимодействуют с эндотелиальными клетками. Между ними осуществляется постоянный обмен веществ[67]. Астроглиальные клетки индуцируют возникновение и формирование ГЭБ. При проведении экспериментов по пересадке сосудов мозга в периферические органы и наоборот — периферических сосудов в ткань головного мозга, отмечено формирование ГЭБ в периферических сосудах, пересаженных в мозг (образование плотных контактов, перестройка эндотелиальных клеток), и разобщение эндотелиальных клеток и появление фенестраций между ними при пересадке мозговых сосудов[15] [68]. Также in vitro показано влияние астроцитов на фенотип эндотелия. В клеточной культуре, содержащей астроциты и эндотелиоциты, отмечено более плотное расположение эндотелия по сравнению с его чистой клеточной культурой[69].
Астроциты выделяют целый ряд веществ, которые влияют на проницаемость эндотелия[70]. Эндотелиоциты в свою очередь выделяют ингибирующий лейкемию фактор (LIF), цитоки́н интерлейки́н-6, которые воздействуют на процесс дифференциации астроцитов[70]. Расстояние от пластинчатых окончаний отростков астроцитов до клеток эндотелия и перицитов составляет всего лишь 20 нм[23] [12].
Главными задачами астроглиальных клеток является обеспечение нейронов питательными веществами и поддержание необходимой концентрации электролитов внеклеточного пространства[70] [71]. Астроциты синтезируют большую часть необходимого клеткам мозга холестерина. Холестерин не проникает через ГЭБ. В то же время в ткани мозга находится 25% от общего холестерина организма. Бо́льшая его часть входит в состав миелина, который окутывает отростки нейронов аксоны. Нарушения процессов миелинизации нервных волокон вызывают развитие демиелинизирующих заболеваний, в частности рассеянный склероз[72].
Пластинчатые окончания отростков астроцитов неплотно покрывают со стороны мозга базальную мембрану сосудистой стенки с расположенными на ней эндотелиоцитами и перицитами. За счёт этого между эндотелиоцитами и тканью мозга возможна прямая диффузия различных веществ[70].
Заболевания, при которых происходит прямое или опосредованное поражение астроцитов (например, болезнь Альцгеймера, астроцитомы), сопровождаются нарушением функционирования ГЭБ.
Области мозга без ГЭБ
ГЭБ имеется в капиллярах большинства, но не всех областей мозга. В 6 анатомических образованиях мозга ГЭБ отсутствует:
- Самое заднее поле (лат. area postrema) ромбовидной ямки (дна IV желудочка) — располагается между треугольником блуждающего нерва (лат. trigonum nervi vagi) с окаймляющим его самостоятельным канатиком (лат. funiculus separans) и бугорком тонкого ядра[73]
- Шишковидное тело (лат. corpus pineale) (синоним — эпифиз)
- Нейрогипофиз
- Прикреплённая пластинка (лат. lamina affixa) — эмбриональный остаток стенки конечного мозга, покрывающий верхнюю поверхность таламуса. Медиально она истончается, образует извитую пластинку — сосудистую ленту (лат. tenia choroidea)[74]
- Субфорника́льный орган
- Субкомиссура́льный орган
Данная гистологическая особенность имеет своё обоснование. Так например, нейрогипофиз выделяет в кровь гормоны, которые не могут пройти через ГЭБ, а нейроны (лат. area postrema) улавливают в крови наличие токсических веществ и стимулируют рвотный центр[75]. Защитным барьером соседней с данными образованиями мозговой ткани является скопление таницитов. Они представляют собой клетки эпендимы с плотными контактами[76].
Мозговой кровоток
Мозг взрослого человека содержит сеть из более чем 100 миллиардов мелких сосудов суммарной протяжённостью около 600 км[34]. В среднем просвет капилляра составляет около 40 нм[77]. Наибольшая их плотность отмечена в коре головного мозга — от 300 до 800 капилляров на 1 мм3 ткани[15].
Суммарная поверхность стенок сосудов мозга составляет 12[78] — 20[79] м2. Ежеминутно через сосудистую сеть мозга протекает около 610 мл крови со средней скоростью 1 мм/с создавая давление на её стенки 15-35 мм рт. ст.[19] Через капиллярное русло мозга она проходит значительно быстрее (в среднем за 5 секунд), чем в других органах и тканях (для сравнения, в кишечнике, площадь сосудов которого достигает 180 м2 среднее время прохождения крови (англ. mean transit time) равно 40 часам[80][81], а в печени с 70 м2 — 30 секундам[82][83][84].
Развитие
До конца 20-го столетия считалось, что у эмбриона и новорожденных ГЭБ не сформирован в полной степени и соответственно не выполняет своей функции. Причиной этого до сих пор широко распространённого мнения являются недостатки ранее проводившихся физиологических опытов. Эксперименты заключались в введении либо связанных с белками красителей, либо других маркеров взрослым животным и эмбрионам. Первые подобные опыты проводились в 1920 году [85]. Маркеры, вводимые эмбрионам, проникали в ткань мозга и спинномозговую жидкость, в то время как у взрослых животных — нет. В ходе данных экспериментов был допущен ряд методических ошибок (использование чрезмерного объёма вводимого вещества, повышение осмотического давления), из-за которых происходило частичное повреждение сосудистой стенки и соответственно маркер попадал в ткань мозга[86][87][88]. При правильной постановке экспериментов пассажа маркера через сосудистую сеть отмечено не было[89][90][91].
В крови плода в большом количестве содержатся молекулы таких веществ как альбумин, α1-фетопротеин и трансферрин, отсутствуя при этом в межклеточном пространстве ткани мозга[92]. В эмбриональном эндотелии обнаружен транспортёр Р-гликопротеин[93]. Это свидетельствует о наличии ГЭБ в пренатальном периоде. В ходе развития организма происходит дальнейшее совершенствование ГЭБ[92].
Для небольших поляризированных молекул, например инулина и сахарозы, проницаемость ГЭБ эмбриона и новорожденного значительно выше, чем у взрослых[94][95][96]. Схожий эффект отмечен и для ионов[97]. Транспорт аминокислот и инсулина через ГЭБ значительно ускорен, по всей видимости, в связи с большой потребностью в них растущего мозга[98][99][100][101].
С другой стороны, в мозге эмбриона имеется дополнительный, отсутствующий у взрослых, барьер на границе между ликвором и тканью мозга — так называемые ремневы́е контакты (англ. Strap Junctions) между клетками эпендимы[102].
Эволюция
В ходе эволюции нервной ткани от беспозвоночных к позвоночным с одной стороны отмечено её увеличение и приобретение центральных функций в жизнедеятельности организмов. С другой стороны бо́льшая масса мозга требует лучшего обеспечения питательными веществами и выведения ненужных и отработанных продуктов распада. Это привело к развитию густой капиллярной сети в ткани мозга. Следующим этапом эволюции стало появление защитного барьера от циркулирующих в крови токсичных для нейронов веществ — ксенобиотиков и токсинов[20] [103].
У многих беспозвоночных ГЭБ отсутствует. У них эндотелий капилляров нервной ткани не образует сплошной выстилки сосудистой стенки. У высших беспозвоночных — насекомых, ракообразных и головоногих[104] — защитный барьер между нейронами и кровью представлен исключительно глиальной тканью[105]. В этом случае речь идёт о глиальном гематоэнцефалическом барьере[106].
У всех видов позвоночных имеется ГЭБ, и у большинства из них он образован преимущественно клетками эндотелия сосудистой стенки скреплёнными между собой плотными контактами. Только у пластиножаберных (среди них акул и скатов), а также семейства осетровых рыб ГЭБ формируется периваскулярными астроцитами. Из этого следует, что в процессе эволюции происходит увеличение количества эндотелиальных клеток сосудов головного мозга, которые перенимают на себя барьерные функции.
Структурные различия глиального и эндотелиального гематоэнцефалических барьеров достаточно велики. Эндотелиальный барьер имеет целый ряд преимуществ. Одним из них является строгое разграничение функций эндотелиальных клеток и клеток астрогли́и, которые обеспечивают гомеостаз внеклеточной среды вещества мозга[105].
Гемато-ликворный барьер
Кроме гемато-энцефалического барьера существует также гемато-ликворный, который ограничивает центральную нервную систему от кровеносного русла. Он образован эпителиальными клетками с плотными контактами выстилающими сосудистое сплетение желудочков мозга[107] [108]. Гемато-ликворный барьер также имеет свою роль в поддержании гомеостаза мозга. Через него из крови в омывающую мозг спинномозговую жидкость поступают витамины, нуклеотиды и глюкоза. Общий вклад гемато-ликворного барьера в процессы обмена между мозгом и кровью невелик. Суммарная поверхность гемато-ликворного барьера сосудистых сплетений желудочков мозга приблизительно в 5000 раз меньше в сравнении с площадью гемато-энцефалического.
Кроме гематоэнцефалического и гематоликворного барьеров в организме человека существуют гематоплацентарный, гемато-тестикулярный, гемато-клубочковый, гемато-ретинальный, гемато-тимальный и гемато-лёгочный барьеры.
Транспорт веществ через ГЭБ

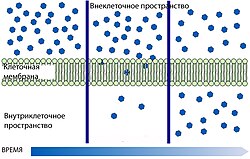
Гематоэнцефалический барьер не только задерживает и не пропускает целый ряд веществ из крови в вещество мозга, но и выполняет противоположную функцию — транспортируют необходимые для метаболизма ткани мозга вещества. Гидрофобные вещества и пептиды проникают в мозг либо с помощью специальных транспортных систем, либо через каналы клеточной мембраны. Для большинства других веществ возможна пассивная диффузия[5] [28].
Межклеточный транспорт
В капиллярах периферических органов и тканей, транспорт веществ осуществляется в основном через фенестра́ции сосудистой стенки и межклеточные промежутки. В норме между клетками эндотелия сосудов мозга такие промежутки отсутствуют. В связи с этим питательные вещества проникает в мозг лишь через клеточную стенку[109]. Вода, глицерин и мочевина являются примерами тех небольших поляризированных молекул, которые могут свободно диффундировать через плотные контакты между эндотелиальными клетками ГЭБ[110].
Свободная диффузия

Самой простой формой транспорта через ГЭБ является свободная (или пассивная) диффузия. Она может осуществляться как через клеточные мембраны эндотелиоцитов так и через плотные межклеточные контакты. Для диффузии веществ движущей силой является разница концентраций. Диффузия веществ пропорциональна градиенту концентраций в кровеносном русле и ткани мозга. Для неё не требуется затрат клеточной энергии[111].
Липофи́льные структурные элементы клеточной мембраны, а также плотные межклеточные контакты снижают количество веществ, которые могут свободно диффундировать через ГЭБ. Проницаемость ГЭБ напрямую зависит от липофильности каждого конкретного вещества[112].
Проницаемость ГЭБ также зависит от молярной массы вещества. Молекулы с массой более 500 г/моль не могут диффундировать через ГЭБ. В то же время ГЭБ не является механическим барьером, который свободно пропускает молекулы меньшего размера и не пропускает большего. Процесс клеточной диффузии является динамическим, при этом он легче для веществ с молярной массой 200 г/моль, чем для веществ с 450 г/моль[33] [113]. Чем липофильнее и меньше вещество, тем легче оно диффундирует через клеточную мембрану[5].

Немецким биофизиком Германном Тро́йбле в 1971 году была высказана гипотеза о транспорте молекул с низкой массой через клеточную мембрану. Согласно ей они проникают в клетку через небольшие промежутки между цепями жирных кислот двойного слоя мембраны. Эти промежутки изменчивы, их образование не требует клеточной энергии[114][115][116][117]. Теория Тройбле была спектроскопически доказана в 1974 году[118][119].
Прогноз и исследования проницаемости ГЭБ тем или иным веществом возможно проводить как in vitro [28] [120][121][113] [122] так и in silico [123].
Липофильность и небольшая молекулярная масса не являются гарантией проницаемости ГЭБ для каждого конкретного вещества. Высокомолекулярные соединения (например, моноклона́льные антитела, рекомбина́нтные белки и другие) удерживаются ГЭБ[124].
Канальцевая проницаемость
Небольшие полярные вещества, например молекулы воды, с трудом могут диффундировать через гидрофобные отделы клеточной мембраны эндотелиоцита. Несмотря на это доказана высокая проницаемость ГЭБ для воды[125].
В клеточной мембране эндотелиоцита располагаются специальные гидрофильные каналы — аквапоры. В эндотелии периферических сосудов они образованы белком аквапорином-1 (AQP1), экспрессия которого ингибируется астроцитами в клетках сосудов мозга[126]. На поверхности мембран клеток капиллярной сети мозга представлены в основном аквапорин-4 (AQP4) и аквапорин-9 (AQP9)[127].
Через аквапоры происходит регуляция содержания воды в веществе мозга. Они делают возможным быструю диффузию воды как в направлении мозга так и в направлении сосудистого русла в зависимости от осмотического градиента концентраций электролитов[128]. Для глицерина, мочевины и ряда других веществ на поверхности клеточных мембран формируются собственные каналы — акваглицеропорины. В ГЭБ они представлены в основном белком аквапорином-9 (который также образует аквапоры)[129].

Процесс транспорта молекул через специализированные каналы осуществляется быстрее активного переноса с помощью специальных белков транспортёров. В то же время различные биологически активные вещества могут активировать или инактивировать транспортные каналы расположенные на клеточных мембранах[109].
Облегчённая диффузия
Особой формой диффузии через клеточную мембрану является облегчённая диффузия. Целый ряд необходимых для мозга веществ, как например, глюкоза и многие аминокислоты, полярны и слишком велики для непосредственной диффузии через клеточную мембрану. Для них на поверхности клеточных мембран эндотелиоцитов располагаются специальные транспортные системы. Например, для глюкозы и аскорбиновой кислоты (витамина С)[130] это GLUT-1-транспортёр. Их количество на поверхности обращённой в полость сосуда в 4 раза больше, чем на обращённой к мозгу.
Кроме транспортёров глюкозы на поверхности эндотелия располагаются множество белковых молекул выполняющих подобную функцию для других веществ. Так например MCT-1 и MCT-2 ответственны за перенос лактата, пирувата, мевалоновой кислоты, бутиратов и ацетатов. SLC7 транспортирует аргинин, лизин и орнитин. В геноме мыши выявлено 307 генов отвечающих за синтез SLC-белков, ответственных за облегчённую диффузию через клеточную мембрану различных веществ[131].
Транспортёры могут осуществлять перенос веществ в одном либо двух направлениях[132]. В отличие от активного транспорта облегчённая диффузия проходит по градиенту концентраций и не требует затрат клеточной энергии.
Активный транспорт

В отличие от пассивного транспорта, не требующего затрат энергии и проходящего по градиенту концентраций, активный заключается в переносе веществ против градиента концентраций и требует больших затрат клеточной энергии, получаемой при распаде молекул АТФ[109]. При активном транспорте веществ из кровеносного русла в ткань мозга говорят о притоке вещества (англ. Influx), в обратном направлении — об оттоке (англ. Efflux).
В ГЭБ располагаются активные транспортёры энкефалина[133][134], антидиуретического гормона[135], [D-Пеницилламин2,D-Пеницилламин5]-энкефалина (DPDPE)[136].
Первым индентифицированным Efflux-транспортёром ГЭБ[137] является Р-гликопротеин, который закодирован геном MDR1.[138][139]
Впоследствии были открыты, относящийся к классу ABC-транспортёров англ. Multidrug Resistance-Related Proteine (MRP1)[140], англ. Breast Cancer Resistance Proteine (BCRP) [141][142] расположенный преимущественно на обращённой в просвет сосуда поверхности[143] [144].
Некоторые Efflux- и Influx-транспортёры являются стереоселективными, т.е. переносят лишь определённый стереоизомер (энантиоме́р) того или иного вещества. Так например, D-изомер аспарагиновой кислоты является преку́рсором N-метил-D-аспартата (NMDA), который влияет на секрецию различных гормонов: лютеинизирующего гормона, тестостерона или окситоци́на[145]. L-изомеры аспарагиновой и глутаминовой кислоты являются стимулирующими аминокислотами и их избыток токсичен для ткани мозга[146]. Efflux-транспортёр ASCT2 (аланин-серин-цистеин-транспортёр) ГЭБ выводит в кровеносное русло L-изомер аспарагиновой кислоты, чьё накопление имеет токсический эффект. Необходимый для формирования NMDA D-изомер поступает в мозг с помощью других транспортных белков (EAAT, SLC1A3, SLC1A2, SLC1A6) [17][147][148].
В эпилептогенной ткани в эндотелии и астроцитах представлено большее количество белка Р-гликопротеина по сравнению с нормальной тканью мозга[149][150].
На клеточных мембранах эндотелиоцитов располагаются также транспортёры анионов (OAT и OATP)[151][152]. Большое количество Efflux-транспортёров выводят из эндотелиоцитов целый ряд веществ в кровеносное русло[111]
Для многих молекул до сих пор не ясно выводятся ли они путём активного транспорта (с затратами клеточной энергии) или путём облегчённой диффузии[17].
Везикулярный транспорт
Рецептор-опосредованный трансцитоз

С помощью рецептор-опосредованного трансцито́за происходит перенос больших молекул. На обращённой в просвет сосуда поверхности клетки расположены специальные рецепторы для опознавания и связывания определённых веществ[15]. После контакта рецептора с веществом-мишенью происходит их связывание, участок мембраны инвагинируется в полость клетки и образуется внутриклеточный пузырёк — везикула. Затем она перемещается к обращённой к нервной ткани поверхности эндотелиальной клетки, сливается с ней и высвобождает связанные вещества. Таким образом во внеклеточное пространство мозга переносятся состоящий из 679 аминокислот белок трансферрин массой 75,2 кДа[153], липопротеины низкой плотности из которых образуется холестерин[121][154], инсулин[155] и другие пептидные гормоны[15].
Абсорбцио-опосредованный трансцитоз
Одним из подвидов везикулярного транспорта является абсорбцио-опосредованный трансцитоз. Отмечается "прилипание" ряда положительно заряженных веществ (катионов) к негативно заряженной клеточной мембране с последующем образованием везикулярного пузырька и его переносом к противоположной поверхности клетки. Данный вид транспорта также называется катионным. Он проходит относительно быстрее рецептор-опосредованного трансцитоза [156][157][158][159].
Исследование проницаемости
Появление большого количества новых лекарственных веществ сделало изучение степени проницаемости ГЭБ для различных веществ крайне актуальным. Это относится не только к тем препаратам, которые используются в неврологии и нейрохирургии и чьё действие непосредственно зависит от их способности преодолевать ГЭБ, но и тем, которые используются в других областях медицины[160]. Для исследования проницаемости ГЭБ применяется ряд методов. Классическим является проведение опытов на живых организмах (in vivo). Новые достижения науки сделали возможными эксперименты на клеточных культурах (in vitro), а также моделирование процесса на компьютере (in silico)[161]. Результаты полученные у млекопитающих (in vivo) могут быть использованы для описания проницаемости ГЭБ для того или иного вещества у человека.
Физические основы
Для определения проницаемости ГЭБ Ренкином (1959) и Кроне (1965) предложена модель, которая основывается на исследовании одного капилляра. Несмотря на свою упрощённость она приближена к реальности[162]. На основании данной модели определяется величина Кроне-Ренкина, которая показывает какая часть вещества при прохождении через кровеносное русло мозга проникнет через ГЭБ[163]. При её значении менее 0,2 ГЭБ слабопроницаем для вещества, при 0,2-0,8 — умеренно проницаем[162].
Исследования in silico
Симуляция процесса с использованием ЭВМ проводится в самых ранних фазах исследования. Высчитывается уровень свободной диффузии учитывая ряд характеристик вещества: его липофильность, молярную массу, количество водородных связей и др.[161]
Исследования in vitro
Опыты in vitro проводятся для изучения транспортных процессов на клеточном уровне на изолированных капиллярах[28]. В ходе эксперимента у подопытного животного выделяются сосуды. Обязательным является сохранение в них метаболической активности[164]. Затем они помещаются между растворами с различными концентрациями исследуемых веществ. Молекулы могут быть маркированы. Метод позволяет определить проницаемость ГЭБ для конкретного вещества, а также процессы его переноса[161][165][166].
Исследования in vivo
Первым, кто провёл in vivo исследования ГЭБ был Пауль Эрлих. Эксперименты по проницаемости тех или иных веществ через ГЭБ заключаются в их непосредственном введении в кровеносное русло, а затем определении содержания в ткани мозга. По Вальтеру (F. Walter, 1929), вещества применяемые с этой целью, должны удовлетворять следующим требованиям: распределяться в крови и цереброспинальной жидкости до того, как наступает их выделение, не расщепляться в организме и не связываться с белками; они не должны изменять состояние ГЭБ и приносить вред организму[10]. Лишь при выполнении этих условий возможно определение проницаемости ГЭБ для определённого вещества in vivo.
Повреждения ГЭБ
Повреждения ГЭБ у человека наблюдается при целом ряде заболеваний.
Синдром дефицита белка GLUT-1
Синдром дефицита белка GLUT-1 (G93.4 по международной классификации болезней ВОЗ[167]) — редкое аутосомно-доминантное наследственное заболевание при котором отмечается нарушение синтеза белка GLUT-1, который ответственен за проницаемость ГЭБ для глюкозы и аскорбиновой кислоты. Заболевание проявляется в раннем детском возрасте. Недостаток поступления в ткань мозга глюкозы вызывает развитие микроцефалии, психомоторных нарушений, атаксии и целого ряда других неврологических расстройств[168].
Наследственная мальабсорбция фолиевой кислоты
Наследственная мальабсорбция фолиевой кислоты (D52.8 по международной классификации болезней ВОЗ[167]) — редкое аутосомно-рецессивное наследственное заболевание при котором отмечается недостаток синтеза белка обеспечивающего проницаемость ГЭБ для фолиевой кислоты.
Сахарный диабет
Сахарный диабет (E10-E14 по международной классификации болезней ВОЗ[167]) является заболеванием при котором возникает целый ряд функциональных и структурных изменений различных органов и тканей организма. Также отчечаются значительные изменения ГЭБ, которые проявляются в физикохимической перестройке мембраны эндотелиальных клеток и плотных контактов между ними[169].
Рассеянный склероз
Рассеянный склероз (G35 по международной классификации болезней ВОЗ[167]) — хроническое прогрессирующее заболевание нервной системы при котором отмечается преимущественное поражение белка миелина ткани мозга.
Сосуды мозга здоровых людей непроницаемы для клеток крови, в том числе иммунных клеток. У больных рассеянным склерозом происходит миграция активированных Т-лимфоцитов в паренхиму мозга через ГЭБ, повышается уровень провоспалительных цитокинов — g-интерферона, ФНО-a, ИЛ-1 и других; активируются В-лимфоциты. В результате начинают синтезироваться антитела к белку миелину, что приводит к формированию очагов воспалительной демиелинизации[170].
Ишемический инсульт

Ишемический инсульт (I63 по международной классификации болезней ВОЗ[167]) — острое нарушение мозгового кровообращения, обусловленное недостаточностью поступления крови к участкам центральной нервной системы.
Ишемический инсульт приводит к высвобождению оксидантов, протеолитических ферментов и цитокинов в ткани мозга, что в итоге вызывает развитие цитотоксического отёка и изменение проницаемости ГЭБ[171]. В результате запускается процесс трансэндотелиальной миграции лейкоцитов в ткань мозга, которые вызывают в том числе поражение здоровых клеток нервной ткани [172][173].
Бактериальная инфекция центральной нервной системы
Лишь немногие попадающие в кровь патогенные микроорганизмы способны проникать через ГЭБ. К ним относятся менингококки (лат. Neisseria meningitidis), некоторые виды стрептококков (в том числе пневмококки (лат. Streptococcus pneumoniae)), гемофильная палочка (лат. Haemophilus influenzae), листерии, кишечные палочки (лат. Escherichia coli) и ряд других. Все они могут вызывать воспалительные изменения как мозга — энцефалит так и его оболочек — менингит. Точный механизм проникновения этих патогенов через ГЭБ до конца не изучен, однако показана важная роль воспаленительных процессов[174].
Листерии прикрепляются к эндотелиоцитам капилляров мозга, выделяют целый ряд липополисахаридов и токсинов, которые, воздействуя на ГЭБ, делают его проницаемым для лейкоцитов. Проникшие в ткань мозга лейкоциты запускают воспалительный процесс в результате которого ГЭБ становится проницаемым для данных бактерий[174].
Пневмококки секретируют фермент группы гемолизинов, который образует поры в эндотелии, через которые и проникает бактериальный агент[175].
Менингококки и E. coli проникают ГЭБ трансэндотелиально[174].
Вирусы и ГЭБ
Кроме бактерий через ГЭБ в ткань мозга могут проникать некоторые вирусы. К ним относятся цитомегаловирус, вирус иммунодефицита человека (ВИЧ)[176], Т-лимфотропный вирус человека (HTLV-1).
Опухоли головного мозга
Внутримозговые опухоли головного мозга (глиобластомы, метастазы в мозг и др.) выделяют целый ряд веществ[174], которые дезинтегрируют работу ГЭБ и соответственно нарушают его избирательную проницаемость. В результате повреждения гемато-энцефалического барьера вокруг опухоли возникает вазогенный отёк мозга[177].
Проницаемость ГЭБ для антибактериальных препаратов
ГЭБ избирательно проницаем для различных лекарственных веществ. Это имеет важное прикладное значение в медицине. Препараты, используемые для лечения заболеваний центральной нервной системы (ЦНС), должны проникнуть в ткань мозга к клеткам-мишеням. При инфекционно-воспалительных заболеваниях ЦНС проницаемость ГЭБ увеличивается, и через него могут проходить те вещества, для которых он в нормальном состоянии служил непреодолимой преградой. Особенно актуально это для антибактериальных препаратов.
Проникновение антибактериальных препаратов через ГЭБ[178]
| Хорошо | Хорошо при воспалении | Плохо даже при воспалении | Не проникают |
|---|---|---|---|
| Изониазид | Азтреонам | Гентамицин | Клиндамицин |
| Пефлоксацин | Амикацин | Карбенициллин | Линкомицин |
| Рифампицин | Амоксициллин | Макролиды | |
| Хлорамфеникол | Ампициллин | Норфлоксацин | |
| Ко-тримоксазол | Ванкомицин | Стрептомицин | |
| Меропенем | Ломефлоксацин | ||
| Офлоксацин | |||
| Цефалоспорины III-IV поколения | |||
| Ципрофлоксацин |
Примечания
- ↑ P. Ehrlich. Das Sauerstoff-Bedürfniss des Organismus: Eine Farbenanalytische Studie // August Hirschwald, Berlin (die Habilitationsschrift von Paul Ehrlich). — 1885. — С. 167.
- ↑ P. Ehrlich. Ueber die Beziehungen von chemischer Constitution, Verteilung und Pharmakologischer Wirkung // Gesammelte Arbeiten zur Immunitaetsforschung. August Hirschwald, Ber. — 1904. — С. 574.
- ↑ E. E. Goldmann. Die äußere und innere Sekretion des gesunden und kranken Organismus im Lichte der vitalen Färbung // Beitr Klin Chirurg. — 1909. — № 64. — С. 192–265.
- ↑ E. E. Goldmann. Vitalfärbung am Zentralnervensystem // Abh. K. Preuss. Akad. Wiss. Phys. Med. — 1913. — № 1. — С. 1–60.
- ↑ 1 2 3 4 5 S. Nobmann. Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2001.
- ↑ A. Biedl, R. Kraus. Über eine bisher unbekannte toxische Wirkung der Gallensäuren auf das zentrale Nervensystem // Zentralblatt Innere Medizin. — 1898. — № 19. — С. 1185–1200.
- ↑ M. Lewandowsky. Zur Lehre von der Cerebrospinal Flüssigkeit // Zentralblatt Klinische Medizin. — 1900. — № 40. — С. 480–494.
- ↑ 1 2 3 4 B. T. Hawkins, T. P. Davis. The blood-brain barrier/neurovascular unit in health and disease // Pharmacol Rev. — 2005. — № 57. — С. 173–185.
- ↑ A. A. Vein. Lina Stern: Science and fate // Neurologie-Abteilung der Universität Leiden. — 2006.
- ↑ 1 2 Гемато-энцефалический барьер // Большая медицинская энциклопедия / Гл. ред. Б.В.Петровский. — 3-е изд.. — М.:: Советская энциклопедия, 1977. — Т. V (Гамбузия-Гипотиазид). — С. 127-129. — 576 с.
- ↑ C. S. Roy, C. S. Sherrington. Zur Lehre von der Cerebrospinal Flüssigkeit // J Physiol. — 1890. — № 11. — С. 85–108.
- ↑ 1 2 Paulson OB, Newman EA. Does the release of potassium from astrocyte endfeet regulate cerebral blood flow? // Science. — 1987. — № 237. — С. 896-898.
- ↑ F. K. Walter. Die allgemeinen Grundlagen des Stoffaustausches zwischen dem Zentralnervensystem und dem übrigen Körper // Arch Psychiatr Nervenkr. — 1930. — № 101. — С. 195–230.
- ↑ H. Spatz. Die Bedeutung der vitalen Färbung für die Lehre vom Stoffaustausch zwischen dem Zentralnervensystem und dem übrigen Körper // Arch Psychiatr Nervenkr. — 1933. — С. 267–358.
- ↑ 1 2 3 4 5 6 7 8 9 S. Wolf, B. Seehaus, Minol K. und andere. Die Blut-Hirn-Schranke: Eine Besonderheit des cerebralen Mikrozirkulationssystems // Naturwissenschaften. — 1996. — № 83. — С. 302-311.
- ↑ Reese TS, Karnovsky MJ. Fine structural localization of a blood-brain barrier to exogenous peroxidase // J Cell Biol. — 1967. — № 34. — С. 207–217.
- ↑ 1 2 3 4 S. Ohtsuki. New Aspects of the Blood–Brain Barrier Transporters; Its Physiological Roles in the Central Nervous System // Biological & Pharmaceutical Bulletin. — 2004. — № 27 (10). — С. 1489–1496.
- ↑ W. Risau, B. Engelhardt, H. Wekerle. Immune function of the blood-brain barrier: incomplete presentation of protein (auto-) antigens by rat brain microvascular endothelium in vitro // The Journal of Cell Biology. — 1990. — № 110. — С. 1757–1766.
- ↑ 1 2 3 B. Bauer. In vitro Zellkulturmodelle der Blut-Hirn-Schranke zur Untersuchung der Permeation und P-Glykoprotein-Interaktion von Arzneistoffen // Диссертация. Гейдельбергский университет им. Рупрехта-Карла. — 2002.
- ↑ 1 2 M. Bundgaard, N. J. Abbott. All vertebrates started out with a glial blood-brain barrier 4-500 million years ago // Glia. — 2008. — № 56. — С. 699–708.
- ↑ 1 2 3 4 W. M. Pardridge. Molecular biology of the blood–brain barrier // Mol Biotechnol. — 2005. — № 30 (1). — С. 57–70.
- ↑ J. C. Lee. Evolution in the concept of the blood-brain barrier phenomen // Progress in neuropathology. — Verlag Grune und Stratton, 1971. — Т. 1. — С. 84–145. — ISBN 0-88167-188-6.
- ↑ 1 2 3 4 M. Pavelka, J. Roth. Funktionelle Ultrastruktur. — Verlag Springer. — С. 234–235. — ISBN 3-211-83563-6..
- ↑ R. S. el-Bacha, A. Minn. Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain // Cell Mol Biol. — 1999. — № 45. — С. 15–23.
- ↑ Chat M, Bayol-Denizot C, Suleman G, Roux F, Minn A. Drug metabolizing enzyme activities and superoxide formation in primary and immortalized rat brain endothelial cells // Life Sci. — 1998. — № 62. — С. 151–163.
- ↑ Minn A, Ghersi-Egea JF, Perrin R, Leininger B, Siest G. Drug metabolizing enzymes in the brain and cerebral microvessels // Life Sci. — 1991. — № 116. — С. 65–82.
- ↑ 1 2 3 4 Takakura Y, Audus KL, Borchardt RT. Blood-brain barrier: transport studies in isolated brain capillaries and in cultured brain endothelial cells // Adv Pharmacol. — 1991. — № 22. — С. 137–165.
- ↑ Méresse S, Dehouck MP, Delorme P, Bensaïd M, Tauber JP, Delbart C, Fruchart JC, Cecchelli R. Bovine brain endothelial cells express tight junctions and monoamine oxidase activity in long-term culture // J Neurochem. — 1989. — № 53. — С. 1363–1371.
- ↑ Perrin R, Minn A, Ghersi-Egea JF, Grassiot MC, Siest G. Distribution of cytochrome P450 activities towards alkoxyresorufin derivatives in rat brain regions, subcellular fractions and isolated cerebral microvessels // Biochem Pharmacol. — 1990. — № 40. — С. 2145–2151.
- ↑ Bendayan R, Lee G, Bendayan M. Functional expression and localization of P-glycoprotein at the blood brain barrier // Res Tech. — 2002. — № 57. — С. 365–380.
- ↑ Su Y, Sinko PJ. Drug delivery across the blood-brain barrier: why is it difficult? how to measure and improve it? // Expert Opin Drug Deliv. — 2006. — № 3. — С. 419–435.
- ↑ 1 2 Fischer H, Gottschlich R, Seelig A. Blood-brain barrier permeation: molecular parameters governing passive diffusion // J Membr Biol. — 1998. — № 165. — С. 201–211.
- ↑ 1 2 U. Fagerholm. The highly permeable blood-brain barrier: an evaluation of current opinions about brain uptake capacity // J Membr Biol. — 2007. — № 12. — С. 1076–1082.
- ↑ Nico B, Frigeri A, Nicchia GP, Quondamatteo F, Herken R, Errede M, Ribatti D, Svelto M, Roncali L. Role of aquaporin-4 water channel in the development and integrity of the blood-brain barrier // J Cell Sci. — 2001. — № 114. — С. 1297–1307.
- ↑ Butt AM, Jones HC, Abbott NJ. Electrical resistance across the blood-brain barrier in anaesthetized rats: a developmental study // J Physiol. — 1990. — № 429. — С. 47-62.
- ↑ P. Claude, D. A. Goodenough. Fracture faces of zonulae occludentes from "tight" and "leaky" epithelia // J Cell Biol. — 1973. — № 58. — С. 390-400.
- ↑ Wolburg H, Neuhaus J, Kniesel U, Krauss B, Schmid EM, Ocalan M, Farrell C, Risau W. Modulation of tight junction structure in blood-brain barrier endothelial cells. Effects of tissue culture, second messengers and cocultured astrocytes // J Cell Sci. — 1994. — № 107. — С. 1347–1357.
- ↑ 1 2 H. B. Newton. Advances in strategies to improve drug delivery to brain tumors // Expert Rev Neurother. — 2006. — № 6. — С. 1495–1509.
- ↑ J. L. Madara. Tight junction dynamics: is paracellular transport regulated? // Cell. — 1988. — № 53. — С. 497–498.
- ↑ H. C. Bauer et al. Proteins of the tight junctions in the blood-brain barrier // Blood-spinal Cord and Brain Barriers in Health and Disease. — Verlag Elsevier, 2004. — С. 1–10.
- ↑ Cecchelli R, Berezowski V, Lundquist S, Culot M, Renftel M, Dehouck MP, Fenart L. Modelling of the blood-brain barrier in drug discovery and development // Nat Rev Drug Discov. — 2007. — № 6. — С. 650–661.
- ↑ Matter K, Balda MS. Holey barrier: claudins and the regulation of brain endothelial permeability // J Cell Biol.. — 2003. — № 161. — С. 459–460.
- ↑ Nitta T, Hata M, Gotoh S, Seo Y, Sasaki H, Hashimoto N, Furuse M, Tsukita S. Size-selective loosening of the blood-brain barrier in claudin-5-deficient mice // J Cell Biol. — 2003. — № 161. — С. 653–660.
- ↑ P. Dore-Duffy. Pericytes: pluripotent cells of the blood brain barrier // Curr Pharm Des. — 2008. — № 14. — С. 1581-1593.
- ↑ Balabanov R, Dore-Duffy P. Role of the CNS microvascular pericyte in the blood-brain barrier // J Neurosci Res.. — 1998. — № 53. — С. 637-644.
- ↑ 1 2 3 4 Rucker HK, Wynder HJ, Thomas WE. Cellular mechanisms of CNS pericytes // Brain Res Bull. — 2000. — № 51. — С. 363-369.
- ↑ P. A. D'Amore. Culture and Study of Pericytes // Cell Culture Techniques in Heart and Vessel Research. — Verlag Springer, 1990. — С. 299. — ISBN 3-540-51934-3..
- ↑ N. J. Abbott. Neurobiology. Glia and the blood-brain barrier // Nature. — 1987. — № 325. — С. 195.
- ↑ Lai CH, Kuo KH. The critical component to establish in vitro BBB model: Pericyte // Brain Res Brain Res Rev. — 2005. — № 50. — С. 258-265.
- ↑ 1 2 Shepro D, Morel NM. Pericyte physiology // FASEB. — 1993. — № 7. — С. 1031–1038.
- ↑ 1 2 Sims DE. Diversity within pericytes // Clin Exp Pharmacol Physiol. — 2000. — № 27. — С. 842–846.
- ↑ Engelhardt B. Development of the blood-brain barrier // Cell Tissue Res. — 2003. — № 314. — С. 119–129.
- ↑ Fujimoto K. Pericyte-endothelial gap junctions in developing rat cerebral capillaries: a fine structural study // Anat Rec. — 1995. — № 242. — С. 562-565.
- ↑ Díaz-Flores L, Gutiérrez R, Varela H, Rancel N, Valladares F. Microvascular pericytes: A review of their morphological and functional characteristics // Histol Histopath. — 1991. — № 6. — С. 269–286.
- ↑ D. E. Sims. Recent advances in pericyte biology--implications for health and disease // Can J Cardiol. — 1991. — № 7. — С. 431–443.
- ↑ Herman IM, D'Amore PA. Microvascular pericytes contain muscle and nonmuscle actins // J Cell Biol. — 1985. — № 101. — С. 43–52.
- ↑ Hirschi KK, D'Amore PA. Pericytes in the microvasculature // Cardiovasc Res. — 1996. — № 32. — С. 687-698.
- ↑ Mato M, Ookawara S, Sugamata M, Aikawa E. Evidence for the possible function of the fluorescent granular perithelial cells in brain as scavengers of high-molecular-weight waste products // Experientia. — 1984. — № 40. — С. 399-402.
- ↑ Balabanov R, Washington R, Wagnerova J, Dore-Duffy P. CNS microvascular pericytes express macrophage-like function, cell surface integrin alphaM, and macrophage marker ED-2 // Microvasc Res. — 1996. — № 52. — С. 127-142.
- ↑ Hickey WF, Kimura H. Perivascular microglial cells of the CNS are bone marrow-derived and present antigen in vivo // Science. — 1988. — № 239. — С. 290-292.
- ↑ Fabry Z, Sandor M, Gajewski TF, Herlein JA, Waldschmidt MM, Lynch RG, Hart MN. Differential activation of Th1 and Th2 CD4+ cells by murine brain microvessel endothelial cells and smooth muscle/pericytes // J Immunol. — 1993. — № 151. — С. 38-47.
- ↑ Krause D, Kunz J, Dermietzel R. Cerebral pericytes - a second line of defense in controlling blood-brain barrier peptide metabolism // Adv Exp Med Biol. — 1993. — № 331. — С. 149-152.
- ↑ Thomas WE. Brain macrophages: on the role of pericytes and perivascular cells // Brain Res Brain Res Rev. — 1999. — № 31. — С. 42-57.
- ↑ Iadecola C. Neurovascular regulation in the normal brain and in Alzheimer's disease // Nat Rev Neurosci. — 2004. — № 5. — С. 347-360.
- ↑ Johanson CE. Permeability and vascularity of the developing brain: cerebellum vs cerebral cortex // Brain Res. — 2004. — № 190. — С. 3–16.
- ↑ Neuhaus J, Risau W, Wolburg H. Induction of blood-brain barrier characteristics in bovine brain endothelial cells by rat astroglial cells in transfilter coculture // Ann N Y Acad Sci. — 1991. — № 633. — С. 578–580.
- ↑ Stewart PA, Wiley MJ. Developing nervous tissue induces formation of blood-brain barrier characteristics in invading endothelial cells: a study using quail–chick transplantation chimeras // Dev Biol.. — 1981. — № 84. — С. 183–192.
- ↑ Raub TJ, Kuentzel SL, Sawada GA. Permeability of bovine brain microvessel endothelial cells in vitro: barrier tightening by a factor released from astroglioma cells // Exp Cell Res. — 1992. — № 199. — С. 330–340.
- ↑ 1 2 3 4 Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability // J Anat.. — 2002. — № 200. — С. 629–638.
- ↑ Abbott NJ, Rönnbäck L, Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier // Nat Rev Neurosci. — 2006. — № 7. — С. 41–53.
- ↑ Björkhem I, Meaney S. Brain cholesterol: long secret life behind a barrier. // Arterioscler Thromb Vasc Biol. — 2004. — № 24. — С. 806-815.
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 82. — 320 с. — ISBN 5-225-02723-7.
- ↑ Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека в 4 томах. Т.4.. — М.:: Медицина, 1996. — С. 56. — 320 с. — ISBN 5-225-02723-7.
- ↑ Duvernoy HM, Risold PY. The circumventricular organs: an atlas of comparative anatomy and vascularization // Brain Res Rev. — 2007. — № 56. — С. 119-147.
- ↑ C. Lohmann. Die Blut-Hirn-Schranke in vitro: Regulation der Permeabilität durch Matrixmetalloproteasen // Диссертация. Вестфальский университет имени Вильгельма. — 2003.
- ↑ W. M. Pardridge. Peptide Drug Delivery to the Brain. — Raven Press, 1991. — С. 123. — ISBN 0-88167-793-0.
- ↑ Chiou WL, Barve A. Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats // Pharm Res. — 1998. — № 15. — С. 1792-1795.
- ↑ Goodwin JT, Clark DE. In silico predictions of blood-brain barrier penetration: considerations to "keep in mind" // J Pharmacol Exp Ther. — 2005. — № 315. — С. 477-483.
- ↑ Lindstedt L, Schaeffer PJ. Use of allometry in predicting anatomical and physiological parameters of mammals // Lab Anim. — 2002. — № 36. — С. 1-19.
- ↑ Lindstedt L, Schaeffer PJ. A proposed blood circulation model for Reference Man // Health Phys. — 1995. — № 69. — С. 187-201.
- ↑ Willmann S, Schmitt W, Keldenich J, Lippert J, Dressman JB. A physiological model for the estimation of the fraction dose absorbed in humans // J Med Chem. — 2004. — № 47. — С. 4022-4031.
- ↑ Fagerholm U, Johansson M, Lennernäs H. Comparison between permeability coefficients in rat and human jejunum // J Med Chem. — 1996. — № 13. — С. 1336-1342.
- ↑ Leggett RW, Williams LR. Suggested reference values for regional blood volumes in humans // Health Phys. — 1991. — № 60. — С. 139-154.
- ↑ G. B. Wislocki. Experimental studies on fetal absorption. I. The vitally stained fetus // Contrib Embryol Carnegie Inst. — 1920. — № 5. — С. 45-52.
- ↑ Wakai S, Hirokawa N. Development of the blood-brain barrier to horseradish peroxidase in the chick embryo // Cell Tissue Res. — 1978. — № 195. — С. 195-203.
- ↑ Risau W, Hallmann R, Albrecht U. Differentiation-dependent expression of proteins in brain endothelium during development of the blood-brain barrier // Dev Biol.. — 1986. — № 117. — С. 537-545.
- ↑ Reynolds ML, Evans CA, Reynolds EO, Saunders NR, Durbin GM, Wigglesworth JS. Intracranial haemorrhage in the preterm sheep fetus // Early Hum Dev. — 1979. — № 3. — С. 163-186.
- ↑ L. Stern, R. Peyrot. Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu des Societe de Biologie (Paris). — 1927. — № 96. — С. 1124–1126.
- ↑ L. Stern et al. Le fonctionnement de la barrière hémato-éncephalique aux divers stades de développement chez les diverses espèces animales // Compte Rendu Soc Biol. — 1929. — № 100. — С. 231–233.
- ↑ Saunders NR, Habgood MD, Dziegielewska KM. Barrier mechanisms in the brain, II. Immature brain // Clin Exp Pharmacol Physiol. — 1999. — № 26. — С. 85–91.
- ↑ 1 2 N. R. Saunders. Development of the blood–brain barrier to macromolecules // The Fluids and Barriers of the Eye and Brain / M. B. Segal. — Verlag MacMillan. — Raven Press, 1991. — С. 128-155. — ISBN 0-8493-7707-2.
- ↑ Schumacher U, Mollgård K. The multidrug-resistance P-glycoprotein (Pgp, MDR1) is an early marker of blood-brain barrier development in the microvessels of the developing human brain // Histochem Cell Biol. — 1997. — № 108. — С. 179–182.
- ↑ Dziegielewska KM, Evans CA, Malinowska DH, Møllgård K, Reynolds JM, Reynolds ML, Saunders NR. Studies of the development of brain barrier systems to lipid insoluble molecules in fetal sheep // J Physiol. — 1979. — № 292. — С. 207–231.
- ↑ Ferguson RK, Woodbury DM. Penetration of 14C-inulin and 14C-sucrose into brain, cerebrospinal fluid and skeletal muscle of developing rats // Exp Brain Res. — 1969. — № 7. — С. 181–194.
- ↑ Habgood MD, Knott GW, Dziegielewska KM, Saunders NR. The nature of the decrease in blood-cerebrospinal fluid barrier exchange during postnatal brain development in the rat // J Physiol. — 1993. — № 468. — С. 73–83.
- ↑ C. E. Johanson. Ontogeny of the blood–brain barrier // Implications of the Blood–Brain Barrier and Its Manipulation / E. A. Neuwelt. — Plenum Press, 1989. — С. 157-198.
- ↑ Braun LD, Cornford EM, Oldendorf WH. Newborn rabbit blood-brain barrier is selectively permeable and differs substantially from the adult // J Neurochem. — 1980. — № 34. — С. 147–152.
- ↑ Cornford EM, Braun LD, Oldendorf WH. Developmental modulations of blood–brain barrier permeability as an indicator of changing nutritional requirements in the brain // Pediatr Res. — 1982. — № 16. — С. 324–328.
- ↑ Brenton DP, Gardiner RM. Transport of L-phenylalanine and related amino acids at the ovine blood-brain barrier // J Physiol. — 1988. — № 402. — С. 497–514.
- ↑ Frank HJ, Jankovic-Vokes T, Pardridge WM, Morris WL. Enhanced insulin binding to blood–brain barrier in vivo and to brain microvessels in vitro in newborn rabbits // Diabetes. — 1985. — № 34. — С. 728–733.
- ↑ Saunders NR, Knott GW, Dziegielewska KM. Barriers in the immature brain // Cell Mol Neurobiol. — 2000. — № 20. — С. 29–40.
- ↑ Abbott NJ, Bundgaard M. Electron-dense tracer evidence for a blood-brain barrier in the cuttlefish Sepia officinalis // J Neurocytol. — 1992. — № 21. — С. 276–294.
- ↑ Abbott NJ, Pichon Y. The glial blood-brain barrier of crustacea and cephalopods: a review // J Physiol (Paris). — 1982. — № 21. — С. 304–313.
- ↑ 1 2 Abbott NJ. Dynamics of CNS barriers: evolution, differentiation, and modulation // Cell Mol Neurobiol. — 2005. — № 25. — С. 5–23.
- ↑ N. J. Abbott. Comparative physiology of the blood-brain barrier // Physiology and pharmacology of the bloodbrain barrier / M. W. B. Bradbury. — Springer-Verlag, 1992. — С. 371-396. — ISBN 0-387-54492-5.
- ↑ N. Hettenbach. Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten // Диссертация. Мюнхенский университет Людвига-Максимилиана. — 2008.
- ↑ S. I. Rapoport. Blood-brain Barrier in Physiology and Medicine. — Raven Press, 1976. — ISBN 0-89004-079-6.
- ↑ 1 2 3 M. Fromm. Physiologie des Menschen // Transport in Membranen und Epithelien / R. F. Schmidt, F. Lang. — Verlag Springer. — С. 41-54. — ISBN 978-3-540-32908-4.
- ↑ I. Sauer. Apolipoprotein E abgeleitete Peptide als Vektoren zur Ьberwindung der Blut-Hirn-Schranke // Диссертация. Свободный университет Берлина. — 2004.
- ↑ 1 2 Egleton RD, Davis TP. Development of neuropeptide drugs that cross the blood-brain barrier // NeuroRx. — 2005. — № 2. — С. 44-53.
- ↑ Oldendorf WH. Lipid solubility and drug penetration of the blood brain barrier // Proc Soc Exp Biol Med. — 1974. — № 147. — С. 813-815.
- ↑ 1 2 R. Kaliszan, M. Markuszewski. Brain/blood distribution described by a combination of partition coefficient and molecular mass // International Journal of Pharmaceutics. — 1996. — № 145. — С. 9-16.
- ↑ Träuble H. Carriers and specificity in membranes. 3. Carrier-facilitated transport. Kinks as carriers in membranes // Neurosci Res Program Bull. — 1971. — № 9. — С. 361-372.
- ↑ Träuble H. Phase transitions in lipids. Possible switch processes in biological membranes // Naturwissenschaften. — 1971. — № 58. — С. 277-284.
- ↑ O. Vostowsky. Chemie der Naturstoffe - Lipoproteine und Membranen // Эрлангенский университет. — 2005. — № 58. — С. 42.
- ↑ W. Hoppe, R. D. Bauer. Biophysik. — Verlag Birkhäuser, 1982. — С. 447-448. — ISBN 0-387-11335-5.
- ↑ Seelig A, Seelig J. The dynamic structure of fatty acyl chains in a phospholipid bilayer measured by deuterium magnetic resonance // Biochemistry. — 1974. — № 13. — С. 4839-4845.
- ↑ A. Elbert. Die Permeation kleiner polarer Moleküle durch Phospholipidmodellmembranen // Диссертация. Университет Кайзерслаутерна. — 1999.
- ↑ Seelig A, Gottschlich R, Devant RM. A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci U S A. — 1994. — № 91. — С. 68-72.
- ↑ 1 2 Dhopeshwarkar GA, Mead JF. Uptake and transport of fatty acids into the brain and the role of the blood-brain barrier system // Adv Lipid Res. — 1973. — № 11. — С. 109-142.
- ↑ Gerebtzoff G, Seelig A. In silico prediction of blood-brain barrier permeation using the calculated molecular cross-sectional area as main parameter // J Chem Inf Model. — 2006. — № 46. — С. 2638-2650.
- ↑ Seelig A, Gottschlich R, Devant RM. A method to determine the ability of drugs to diffuse through the blood-brain barrier // Proc Natl Acad Sci USA. — 1994. — № 91. — С. 68-72.
- ↑ Pardridge WM. The blood-brain barrier: bottleneck in brain drug development // NeuroRx. — 2005. — № 2. — С. 3-14.
- ↑ W. H. Oldendorf. Measurement of brain uptake of radiolabeled substances using a tritiated water internal standard // Brain Res. — 1970. — № 24. — С. 372–376.
- ↑ Dolman D, Drndarski S, Abbott NJ, Rattray M. Induction of aquaporin 1 but not aquaporin 4 messenger RNA in rat primary brain microvessel endothelial cells in culture // J Neurochem. — 2005. — № 93. — С. 825-833.
- ↑ Bloch O, Manley GT. The role of aquaporin-4 in cerebral water transport and edema // Neurosurg Focus. — 2007. — № 22 (E3).
- ↑ Verkman AS. More than just water channels: unexpected cellular roles of aquaporins // J Cell Sci. — 2005. — № 118. — С. 3225-3232.
- ↑ Badaut J, Brunet JF, Regli L. Aquaporins in the brain: from aqueduct to "multi-duct" // Metab Brain Dis. — 2007. — № 3-4. — С. 251-263.
- ↑ Agus DB, Gambhir SS, Pardridge WM, Spielholz C, Baselga J, Vera JC, Golde DW. Vitamin C crosses the blood-brain barrier in the oxidized form through the glucose transporters // J Clin Invest. — 1997. — № 100. — С. 2842-2848.
- ↑ Dahlin A, Royall J, Hohmann JG, Wang J. Expression profiling of the solute carrier gene family in the mouse brain // J Pharmacol Exp Ther. — 2009. — № 329. — С. 558-570.
- ↑ Cornford EM, Hyman S. Blood-brain barrier permeability to small and large molecules // Adv Drug Deliv Rev. — 1999. — № 36. — С. 145-163.
- ↑ Zloković BV, Lipovac MN, Begley DJ, Davson H, Rakić L. Transport of leucine-enkephalin across the blood-brain barrier in the perfused guinea pig brain // J Neurochem. — 1987. — № 49. — С. 310-315.
- ↑ Zlokovic BV, Mackic JB, Djuricic B, Davson H. Kinetic analysis of leucine-enkephalin cellular uptake at the luminal side of the blood-brain barrier of an in situ perfused guinea-pig brain // J Neurochem. — 1989. — № 53. — С. 1333-40.
- ↑ Zlokovic BV, Hyman S, McComb JG, Lipovac MN, Tang G, Davson H. Kinetics of arginine-vasopressin uptake at the blood-brain barrier // Biochim Biophys Acta. — 1990. — № 1025. — С. 191-198.
- ↑ Thomas SA, Abbruscato TJ, Hruby VJ, Davis TP. The entry of [D-penicillamine2,5enkephalin into the central nervous system: saturation kinetics and specificity] // J Pharmacol Exp Ther. — 1997. — № 280. — С. 1235-1240.
- ↑ Begley DJ. ABC transporters and the blood-brain barrier // Curr Pharm Des. — 2004. — № 10. — С. 1295-1312.
- ↑ Rao VV, Dahlheimer JL, Bardgett ME, Snyder AZ, Finch RA, Sartorelli AC, Piwnica-Worms D. Choroid plexus epithelial expression of MDR1 P glycoprotein and multidrug resistance-associated protein contribute to the blood-cerebrospinal-fluid drug-permeability barrier // Proc Natl Acad Sci USA. — 1999. — № 96. — С. 3900-5.
- ↑ Thiebaut F, Tsuruo T, Hamada H, Gottesman MM, Pastan I, Willingham MC. Immunohistochemical localization in normal tissues of different epitopes in the multidrug transport protein P170: evidence for localization in brain capillaries and crossreactivity of one antibody with a muscle protein // J Histochem Cytochem. — 1989. — № 37. — С. 159-164.
- ↑ Seetharaman S, Barrand MA, Maskell L, Scheper RJ. Multidrug resistance-related transport proteins in isolated human brain microvessels and in cells cultured from these isolates // J Neurochem. — 1998. — № 70. — С. 1151-1159.
- ↑ Cooray HC, Blackmore CG, Maskell L, Barrand MA. Localisation of breast cancer resistance protein in microvessel endothelium of human brain // Neuroreport. — 2002. — № 13. — С. 2059-2063.
- ↑ Eisenblätter T, Galla HJ. A new multidrug resistance protein at the blood-brain barrier // Biochem Biophys Res Commun. — 2002. — № 293. — С. 1273-1278.
- ↑ Tanaka Y, Abe Y, Tsugu A, Takamiya Y, Akatsuka A, Tsuruo T, Yamazaki H, Ueyama Y, Sato O, Tamaoki N, et al. Ultrastructural localization of P-glycoprotein on capillary endothelial cells in human gliomas // Virchows Arch. — 1994. — № 425. — С. 133-138.
- ↑ de Lange EC. Potential role of ABC transporters as a detoxification system at the blood-CSF barrier // Adv Drug Deliv Rev. — 2004. — № 56. — С. 1793-1809.
- ↑ Wolosker H, Panizzutti R, De Miranda J. Neurobiology through the looking-glass: D-serine as a new glial-derived transmitter // Neurochem Int. — 2002. — № 41. — С. 327-332.
- ↑ Zorumski CF, Olney JW. Excitotoxic neuronal damage and neuropsychiatric disorders // Pharmacol Ther. — 1993. — № 59. — С. 145-165.
- ↑ Hosoya K, Sugawara M, Asaba H, Terasaki T. Blood-brain barrier produces significant efflux of L-aspartic acid but not D-aspartic acid: in vivo evidence using the brain efflux index method // J Neurochem. — 1999. — № 73. — С. 1206-1211.
- ↑ Palacín M, Estévez R, Bertran J, Zorzano A. Molecular biology of mammalian plasma membrane amino acid transporters // Physiol Rev. — 1998. — № 78. — С. 969-1054.
- ↑ Löscher W, Potschka H. Blood-brain barrier active efflux transporters: ATP-binding cassette gene family // NeuroRx. — 2005. — № 2. — С. 86-98.
- ↑ Tishler DM, Weinberg KI, Hinton DR, Barbaro N, Annett GM, Raffel C. MDR1 gene expression in brain of patients with medically intractable epilepsy // NeuroRx. — 1995. — № 36. — С. 1-6.
- ↑ Kusuhara H, Sekine T, Utsunomiya-Tate N, Tsuda M, Kojima R, Cha SH, Sugiyama Y, Kanai Y, Endou H. Molecular cloning and characterization of a new multispecific organic anion transporter from rat brain // J Biol Chem. — 1999. — № 274. — С. 13675-13680.
- ↑ Gao B, Stieger B, Noé B, Fritschy JM, Meier PJ. Localization of the organic anion transporting polypeptide 2 (Oatp2) in capillary endothelium and choroid plexus epithelium of rat brain // J Histochem Cytochem. — 1999. — № 47. — С. 1255-1264.
- ↑ Roberts RL, Fine RE, Sandra A. Receptor-mediated endocytosis of transferrin at the blood-brain barrier // J Cell Sci. — 1993. — № 104. — С. 521-532.
- ↑ Dehouck B, Dehouck MP, Fruchart JC, Cecchelli R. Upregulation of the low density lipoprotein receptor at the blood-brain barrier: intercommunications between brain capillary endothelial cells and astrocytes // J Cell Biol. — 1994. — № 126. — С. 465-473.
- ↑ Duffy KR, Pardridge WM, Rosenfeld RG. Human blood-brain barrier insulin-like growth factor receptor // Metabolism. — 1988. — № 37. — С. 136-140.
- ↑ Tamai I, Sai Y, Kobayashi H, Kamata M, Wakamiya T, Tsuji A. Structure-internalization relationship for adsorptive-mediated endocytosis of basic peptides at the blood-brain barrier // J Pharmacol Exp Ther. — 1997. — № 280. — С. 410-415.
- ↑ Smith MW, Gumbleton M. Endocytosis at the blood-brain barrier: from basic understanding to drug delivery strategies // J Drug Target. — 2006. — № 14. — С. 191-214.
- ↑ Hervé F, Ghinea N, Scherrmann JM. CNS delivery via adsorptive transcytosis // J Drug Target. — 2008. — № 10. — С. 455-472.
- ↑ Scherrmann JM. Drug delivery to brain via the blood-brain barrier // Vascul Pharmacol. — 2002. — № 38. — С. 349-354.
- ↑ Bodor N, Buchwald P. Recent advances in the brain targeting of neuropharmaceuticals by chemical delivery systems // Adv Drug Deliv Rev. — 1999. — № 36. — С. 229-254.
- ↑ 1 2 3 Bickel U. How to measure drug transport across the blood-brain barrier // NeuroRx. — 2005. — № 2. — С. 15-26.
- ↑ 1 2 J. Fenstermacher, L. Wei. Measuring local cerebral capillary permeability-surface area products by quantitative autoradiography // Introduction to the Blood-brain Barrier / W. M. Pardridge. — Cambridge University Press, 1998. — С. 122-132. — ISBN 0-521-58124-9.
- ↑ C. Crone, D. G. Levitt. Capillary permeability to small solutes // Handbook of Physiology. — American Physiological Society, 1984. — С. 375-409.
- ↑ Lasbennes F, Gayet J. Capacity for energy metabolism in microvessels isolated from rat brain // Neurochem Res. — 1984. — № 9. — С. 1-10.
- ↑ Miller DS, Nobmann SN, Gutmann H, Toeroek M, Drewe J, Fricker G. Xenobiotic transport across isolated brain microvessels studied by confocal microscopy // Mol Pharmacol. — 2000. — № 58. — С. 1357-1367.
- ↑ Huwyler J, Pardridge WM. Examination of blood-brain barrier transferrin receptor by confocal fluorescent microscopy of unfixed isolated rat brain capillaries // J Neurochem. — 1998. — № 70. — С. 883-886.
- ↑ 1 2 3 4 5 Сайт всемирной организации здоровья
- ↑ De Vivo DC, Trifiletti RR, Jacobson RI, Ronen GM, Behmand RA, Harik SI. Defective glucose transport across the blood-brain barrier as a cause of persistent hypoglycorrhachia, seizures, and developmental delay // NEJM. — 1991. — № 325. — С. 703-709.
- ↑ Horani MH, Mooradian AD. Effect of diabetes on the blood brain barrier // Curr Pharm Des. — 2003. — № 9. — С. 833-840.
- ↑ Correale J, Villa A. The blood-brain-barrier in multiple sclerosis: functional roles and therapeutic targeting // Autoimmunity. — 2007. — № 40. — С. 148-160.
- ↑ Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of ischaemic stroke: an integrated view // Trends Neurosci. — 1999. — № 22. — С. 391-397.
- ↑ Kuroda S, Siesjö BK. Reperfusion damage following focal ischemia: pathophysiology and therapeutic windows // Clin Neurosci. — 1997. — № 4. — С. 199-212.
- ↑ Planas AM, Gorina R, Chamorro A. Signalling pathways mediating inflammatory responses in brain ischaemia // Biochem Soc Trans. — 2006. — № 34. — С. 1267-1270.
- ↑ 1 2 3 4 Weiss N, Miller F, Cazaubon S, Couraud PO. The blood-brain barrier in brain homeostasis and neurological diseases // Biochim Biophys Acta. — 2009. — № 1788. — С. 842-857.
- ↑ Zysk G, Schneider-Wald BK, Hwang JH, Bejo L, Kim KS, Mitchell TJ, Hakenbeck R, Heinz HP. Pneumolysin is the main inducer of cytotoxicity to brain microvascular endothelial cells caused by Streptococcus pneumoniae // Infect Immun. — 2001. — № 69. — С. 845-852.
- ↑ Banks WA, Freed EO, Wolf KM, Robinson SM, Franko M, Kumar VB. Transport of human immunodeficiency virus type 1 pseudoviruses across the blood-brain barrier: role of envelope proteins and adsorptive endocytosis // J Virol. — 2001. — № 75. — С. 4681-4691.
- ↑ Квитницкий-Рыжов Ю. Н. Современное учение об отёке и набухании головного мозга. — Здоров’я. — Київ, 1988.
- ↑ А. В. Кузнецов, О. Н. Древаль. Посттравматические менингит и менингоэнцефалит // Клиническое руководство по черепно-мозговой травме / Под редакцией А. Н. Коновалова, Л. Б. Лихтермана, А. А. Потапова. — М.:: "Антидор", 2002. — Т. 3. — С. 420. — 632 с. — 1 100 экз. — ISBN 5-900833-13-5.
Внешние ссылки
- Подраздел учебника "Физиология человека" под редакцией В.М.Покровского, Г.Ф.Коротько посвящённый ГЭБ
- Научно-популярная статья д.м.н. Г.Кассиля о ГЭБ опубликованная в журнале Наука и жизнь в 1986 году
- Определение и краткое описание ГЭБ Е. В. Трифонова
- Краткое описание ГЭБ на сайте medbiol.ru
- Определение БСЭ
Статья является кандидатом в хорошие статьи с 16 мая 2010. |